Ecetsavas víz. Az ecetsav alkalmazásai
Név:
Ecetsav(etánsav) az alifás sorozat egybázisú karbonsavja.
Kémiai formula:
Nyitási előzmények:
Az ecetsav ősidők óta ismert, mivel borok savanyítása során keletkezik (borecet).
A tudósok azonban csak azután kezdtek érdeklődni az ecetsav szerkezete és előfordulásának oka iránt, hogy szenzációsan publikálták Dumas hüvelykujjszabályát a hidrogén klórral való helyettesítésére a szerves vegyületekben. Ezt megelőzően a kémiát Jens Jakob Berzelius elmélete uralta. Az elemeket elektropozitívra és elektronnegatívra osztotta, és teljesen tagadta a hidrogén és a klór helyettesítését anélkül, hogy megváltoztatta volna. kémiai szerkezete anyagokat.
1839-es munkájában Dumas jelentést nyújtott be a Svéd Akadémiának, amelyben megszentelte az általa a szerves anyagokra, és különösen az ecetsavra megfogalmazott hüvelykujjszabály kezdeti elveit: „A szervetlen kémiában az izomorfizmus, a tényeken alapuló elmélet, mint ismeretes, kevesen értenek egyet az elektrokémiai elméletekkel. A szerves kémiában a szubsztitúció elmélete ugyanazt a szerepet tölti be... és talán a jövő megmutatja, hogy mindkét nézet szorosabban kapcsolódik egymáshoz, hogy ugyanazon okokból következnek, és ugyanazon a néven általánosíthatók.
Több évbe telt, mire erre a következtetésre jutott. Dumas első kísérleteit az ecetsav tanulmányozásával és klór-ecetsavvá történő átalakításával kezdte. Ebben a reakcióban a hidrogént teljesen klórral helyettesítik, 1:1 arányban, és ami a legfontosabb, a bázikus veszteség nélkül. kémiai tulajdonságokés az anyag viszonya az osztályhoz. A hidrogén jóddal és brómmal való helyettesítésével kapcsolatos további kísérletek végül meggyőzték erről a tudóst.
A szervetlen és szerves vegyületek képződése közötti alapvető különbségre vonatkozó következtetés forradalminak bizonyult.
Berzelius azonban, megvédve elméletét, példát ad az oxálsavra, és a kapott sóra, ha kloriddal kombinálják, ami a savas tulajdonságok elvesztését jelenti. Mind a szerves, mind a szervetlen vegyületek példáján azzal érvel, hogy oxigéntartalmú részük reakcióba léphet a bázisokkal, és elveszítheti azokat anélkül, hogy elveszítené a kapcsolatot a klórtartalmú résszel. A kémikus szerint ez az a szempont, amelyet Dumas kísérletei során elkövetett fő mulasztás, mivel. nem cáfolta és nem erősítette meg ezt a közismert tényt.
Annak érdekében, hogy valamilyen módon megmagyarázza Dumas eredményeit, Berzelius felteszi a következő feltevést: „Dumas klór-ecetsava,
nyilvánvalóan ebbe a vegyületosztályba tartozik; benne a széngyök kapcsolódik
oxigént és klórt egyaránt. Ez tehát lehet oxálsav, in
amelyben az oxigén felét klór vagy 1 atomos vegyület helyettesíti
(molekulák) oxálsav 1 atomos (molekula) szeszkvikloriddal
C2Cl6. Az első feltevés nem fogadható el, mert elismeri
a klór 11/2, oxigénatomok helyettesítésének lehetősége (Berzelius szerint oxálsav
a sav C2O3 volt.). Dumas viszont a harmadik gondolathoz ragaszkodik, teljesen
összeegyeztethetetlen a fenti kettővel, miszerint a klór nem helyettesíti az oxigént, hanem
elektropozitív hidrogén, C4Cl6 szénhidrogént képezve, amelynek ugyanaz
komplex gyökök, például C4H6 vagy acetilcsoport tulajdonságai, és feltételezhetően 3
oxigénatomokat, hogy olyan savat kapjunk, amely tulajdonságaiban megegyezik az U.-val, de amint látja
összehasonlításból (fizikai tulajdonságaikból), teljesen eltér attól"
De a Dumas által elültetett magok kiadták a hajtásaikat. Most sok tudós hátat fordított Berzelius elméletének, és folytatta az innovációt. Tehát Charles Frederic Gerard először a gyökök elméletével ellentétben (amelynek alkotója és híve Berzelius volt) megállapította, hogy a gyökök nem léteznek önállóan, hanem atomcsoportok - „maradékok”, amelyek kombinációja molekulát alkot. . 1851-ben "A savak bázikusságáról" című esszéjében kidolgozta a típuselméletet, amely szerint minden kémiai vegyület négy típus származékai közé sorolható - hidrogén, hidrogén-klorid, víz és ammónia. Különösen a triklór-ecetsav és az ecetsav szerkezetének hasonlóságára gondoltak. Védelmében Berzelius visszavág: „Gerard új nézetet fogalmazott meg az alkohol, az éter és az éter összetételével kapcsolatban.
származékok; ez a következő: egy jól ismert króm, oxigén és klór vegyület rendelkezik
képlet \u003d CrO2Cl2, a klór helyettesíti benne az oxigénatomot (azt jelenti
Berzelius 1 króm-anhidrid oxigénatomja - CrO3). U. sav C4H6 + 3O
2 atom (molekula) oxálsavat tartalmaz, ebből az egész
oxigén helyett hidrogén = C2O3+C2H6.” De egy ilyen számjáték nem tartotta fenn az elmélet tekintélyét, és egy évvel később Dumas megsemmisítő csapást mért, kidolgozta a típuselméletet, a triklór-ecetsav és az ecetsav hasonló tulajdonságait vizsgálva a bomlási reakcióban, az ún. lúgok.
Másrészt Liebig és Graham nyilvánosan támogatta
a helyettesítés elmélete alapján elért nagyobb egyszerűség, ha figyelembe vesszük
közönséges éter klórszármazékai és hangyasav- és U. sav-észterek
Malagutti.
Berzelius, engedve az új tények nyomásának, az V. sz. övé
"Lehrbuch der Chemie" (1842. novemberi előszó), a 709. oldalon,
megfeledkezve Gerardról írt éles kritikájáról, lehetségesnek találta a következőket írni: „Ha mi
felidézzük az U. sav átalakulását (a szövegben bomlását) klór hatására
klóroxálsav (Chloroxalsaure - Chloroxalsaure - Berzelius hívja
triklór-ecetsav. , akkor megjelenik
az U. sav összetételének egy másik nézete is lehetséges, nevezetesen lehet kombinált oxálsav, amelyben a kombinált csoport (Paarling) a C2H6, ahogy a klóroxálsavban a kombinált csoport a C2Cl6, majd a klór hatása a Az U. sav csak a C2H6 átalakításából állna C2Cl6-dá. Egyértelmű, hogy nem lehet eldönteni, hogy egy ilyen ábrázolás helyesebb-e..., azonban érdemes odafigyelni ennek lehetőségére.
De a típuselmélet támogatóinak ezredében minden megérkezett. Kolbe munkájának kiindulópontja egy kristályos anyag, a CCl4SO2 összetétel tanulmányozása volt, amelyet korábban Berzelius és Marse aqua regia hatására CS2-n, Kolbe pedig nedves klór hatására CS2-n alakított ki. Az átalakulások közelében Kolbe megmutatta, hogy ez
a test modern szóhasználattal a klór-anhidridet képviseli
triklór-metil-szulfonsav, CCl4SO2 \u003d CCl3.SO2Cl, amely lúgok hatására a megfelelő sav sóit képezheti - CCl3.SO2 (OH), amely cink hatására először egy Cl-atomot hidrogénnel helyettesít, így képződik a sav CHCl2.SO2 (OH) Hidratált víz, mint általában, Berzelius által nem elfogadható
figyelembe.), majd egy másik, a CH2Cl.SO2 (OH) savat képezve [Kolbe szerint -
Chlorelaylunterschwefelsaure], és végül árammal vagy káliummal helyreállítva
amalgám (a reakciót nem sokkal korábban alkalmazta a Melsance a
triklór-ecetsav redukálása ecetsavvá.) hidrogénnel helyettesíti és mindhárom
Cl atom, metilszulfonsavat képezve. CH3.SO2(OH) [Kolbe szerint -
Methylunterschwefelsaure].
Ezeknek a vegyületeknek analógiája klór-ecetsavval
önkéntelenül megakadt a szem; valóban, az akkori képletekkel kettő
párhuzamos sorozatok, amint az a következő táblázatból látható: H2O+C2Cl6.S2O5
H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5
H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Ez nem kerülte el Kolbét,
aki megjegyzi (I. o. 181. o.): "a fentebb leírt egyesített kénes savakra
savakban és közvetlenül klórszén-kénsavban (fent -
H2O + C2Cl6.S2O5) a klóroxálsavhoz kapcsolódik, más néven
klór-ecetsav. Folyékony klór-szénhidrogén - CCl (Cl=71, C=12; most írjuk
A C2Cl4 klór-etilén.), ismert, hogy a fény hatására átalakul
klór in - hexaklór-etán, és várható, hogy ha egyidejűleg víz hatásának lenne kitéve, akkor képződéskor, mint a bizmut-klorid, klórantimon stb., a klórt oxigénnel helyettesíti. A tapasztalat megerősítette a feltételezést. „Fény hatására és
klórt C2Cl4-re, amely víz alatt volt, Kolbe hexaklór-etánnal együtt kapott
és triklór-ecetsav, és az átalakulást a következőképpen fejezte ki: (Mivel a C2Cl4
fűtött) csövön átvezetve CCl4-ből nyerhető, és a CCl4
Cl2 hevítés hatására CS2-n képződik, akkor a Kolbe-reakció volt
az U. sav első szintézise az elemekből.) „Egyszerre keletkezik-e
és szabad oxálsav, nehéz eldönteni, hiszen a fényben klór azonnal
oxidálja U. savvá "...
Berzelius nézete a klór-ecetsavról
"meglepő módon (auf eine tiberraschende Weise) megerősítést nyert
a kombinált kénes savak tulajdonságainak megléte és párhuzamossága, és mint I
úgy tűnik (mondja Kolbe I. 186. o.), túlmutat a hipotézisek és
nagy valószínűségre tesz szert.
Előrelátása a természet további felfedezéseiről szerves savak megerősíti egy cikk, amelyben kísérletekre támaszkodva ezt írja: „Nem
hihetetlen, hogy a jövőben kénytelenek leszünk a kombinált savakkal foglalkozni
jelentős része azoknak a szerves savaknak, amelyekben jelenleg a
információink korlátai - elfogadjuk a hipotetikus gyököket...".
A gyökök elmélete is jellemző rá, megerősítve a korábban elmondottakat, és hozzáteszi: „Ami a szubsztitúciós jelenségeket illeti ezekben a kombinált savakban, egyszerű magyarázatot kapnak arra a körülményre, hogy különféle, valószínűleg izomorf vegyületek képesek helyettesíteni. egymást a csoportok összevonásának szerepében nem változtatva jelentősen a velük kombinált szervezet savas tulajdonságait!
Ennek a nézetnek további kísérleti megerősítését találjuk Frankland és Kolbe cikkében: „Azon az elképzelésen alapul, hogy a sorozat összes sav
(CH2)2nO4, úgy épül fel, mint a metil-oxálsav (most CnH2nO2 és
metil-oxálsavat nevezünk ecetsavnak. kombinálva
hangyasav, a hidrogén csak azért vesz részt a reakcióban, mert egyesül vele
cianid, hidrogén-cianidot képez: fordított oktatás hangyasavat származó
hidrogén-cianid lúgok hatására nem más, mint ismétlés
a vízben oldott cianid ismert átalakulása oxálsavvá és ammóniává,
azzal az egyetlen különbséggel; hogy a képződéskor az oxálsav egyesül azzal
hidrogén-cianid."
Az a tény, hogy például a benzol-cianid (C6H5CN), Fehling szerint, nem rendelkezik savas tulajdonságokkal, és nem képez poroszkéket, Kolbe és Fankland szerint párhuzamba állítható azzal, hogy az etil-klorid nem tud reagálni AgNO3-mal, és mutatásuk helyessége Kolbe és
Frankland szintézissel bizonyítja a nitrilek módszerével (Nitrileket kaptak
szernovinsav desztillációja KCN-nel (Dumas és Malagutti módszer Leblanc-cal):
R.SO3 (OH) + KCN \u003d R.CN + KHSO4) U., propionos (az akkori met-aceton szerint), ill.
kapronsav.
Aztán a következő évben Kolbe lúgosra elektrolizálta
egybázisú telített savak sói, és az ő sémájával összhangban megfigyelték:
Ugyanakkor az ecetsav elektrolízise során etán, szénsav, ill.
hidrogén:
H2O+C2H6.C2O3=H2+,
és a valerián elektrolízisében - oktán, szénsav és hidrogén: H2O + C8H18.C2O3 \u003d H2 +.
Kolbe művei, az ecetsav szerkezete, és egyben minden
végül más szerves savakra és a későbbi vegyészek szerepére is fény derült
csak megosztottságra redukálva - elméleti megfontolások és Gerard tekintélye miatt,
Kolbe képletei fele és lefordítása a strukturális nézetek nyelvére,
aminek következtében a C2H6.C2O4H2 képlet CH3.CO(OH)-vá alakult.
Megszerzésének módjai:
Az ecetsav előállításának fő technikai módszere az acetaldehid oxidációja légköri oxigénnel mangán katalizátorok jelenlétében.
acetaldehid ecetsav
Kémiai tulajdonságok:
Kölcsönhatás:
Fémek
Ecetsav Magnézium-acetát
Alkalmazás:
Az ecetsavat széles körben használják az iparban:
- Hús- és haltermékek befőzése,
- szintetikus (acetát) szál gyártása,
- gyomirtó szerek gyártása,
- aromás anyagok és oldószerek szintézise,
- A bőr-, textilipar- és más iparágakban,
- Az ecetsav széles körben használt sói - acetátok.
Az alifás egybázisú savakkal kapcsolatos ismert oldószerek közül kétségtelenül a legsokoldalúbb a jól ismert ecetsav. Más nevek is vannak: ecet esszencia vagy etánsav. Ennek az anyagnak az alacsony költsége és különböző koncentrációkban (3-100%) elérhetősége, stabilitása és könnyű tisztíthatósága oda vezetett, hogy ma ez a legjobb és leghíresebb szer, amely a legtöbb anyagot feloldja. szerves eredetű, amelyre nagy a kereslet az emberi tevékenység különböző területein.
Az ecetsav és ennek megfelelően az egyes iparágakban való felhasználásának lehetősége a koncentrációban változhat. Élelmiszerre, azaz ecetre (3-15%) és technikai - ecetesszenciára (70-80%) és jégre (100%) osztják.
Mind háztartási szinten, mind általában benn Élelmiszeripar, nagy kereslet van egy alacsony töménységű oldatra, amelyben az ecetsav százalékos aránya körülbelül 3-15%. Készételekkel ízesítik, számos termék ízesítésére használják, nélkülözhetetlen a hús- és haltermékek befőzéséhez, pácolásához, sózásához stb.
Műszaki ecetsav 70, vásárolni amely az élelmiszerektől eltérően nem található meg egy közönséges élelmiszerboltban, aktívan használják a vegyiparban kiváló oldószerként és kémiai reagensként, amely más anyagokat, például acetont szintetizál.
A technikai ecetesszenciát gyakran használják az orvostudományban (például aszpirin), a cellulóz és a papír (festés és nyomtatás), a festék és lakk, a textilparfüméria, a bőr és más ipari területeken. Illatos anyagok kombinálására, gyomirtó szerek előállítására és acetát (szintetikus) rostok előállítására használják.
Az ecetsav jelentősége az orvosi és gyógyszeripar is nagyszerű. Ez az anyag számos gyógyszer szerves összetevője és gyógyszerekólom- és alumínium-acetátsók, acetilszalicilsav. Kombinált formában számos betegség kezelésére használják gyulladásos folyamatokés különféle betegségek, főleg pediculosis, alkoholmérgezés, zuzmó, radiculitis, polyarthritis stb.
Ecet esszencia, valamint oldószer 646, ár ami szintén kicsi, kivétel nélkül szinte bármelyik háztartási boltban megvásárolható. Gyorsan megrendelheti és megvásárolhatja az interneten keresztül is. A költség olcsóbb lesz. Ez különösen előnyös azok számára, akik az iparban dolgoznak, ahol jelentős mennyiségekre van szükség, és ahol ecetsav, mint más kémiai oldószerek, sok literes palackban és hordóban árulják. Ezért a legjobb, ha olyan beszállítóktól vásárolja meg, akik már bizonyították magukat és áruikat ezen a piacon.
Megtekintve: 11 857 alkalommal
Az ecetsav (ecetsav, etánsav, E260) gyenge, limitáló egybázisú karbonsav.
Az ecetsav színtelen folyadék, jellegzetes csípős szagú és savanyú ízű. Nedvszívó. Vízben korlátlanul oldódik. Kémiai képlet CH3COOH.
Az ecetsav 70-80%-os vizes oldatát ecetesszenciának, 3-6%-át ecetnek nevezzük. Az ecetsav vizes oldatait széles körben használják az élelmiszeriparban és a háztartási főzésben, valamint a konzervgyártásban.
Száraz szőlőborok természetes savanyításának, valamint alkoholok és szénhidrátok erjesztésének terméke. Részt vesz a szervezet anyagcseréjében. Széles körben használják konzervek, pácok, vinaigrettek készítéséhez.
Az ecetsavat gyógyászati és aromás anyagok előállítására használják oldószerként (például cellulóz-acetát, aceton előállításához). Nyomtatáshoz és festéshez használják.
Az ecetsav sóit és észtereit acetátoknak nevezzük.
Az E260 élelmiszer-adalékanyagot mindenki ecetsavként vagy ecetként ismeri. Az E260 adalékanyagot az élelmiszeriparban savszabályozóként használják. Alapvetően az ecetsavat vizes oldatok formájában használják 3-9% (ecet) és 70-80% (ecetesszencia) arányban. Az E260 adalék jellegzetes csípős szagú. Vizes oldatokban az E260 savanyúságot szabályozó anyag meglehetősen gyenge sav. Az ecetsav tiszta formájában színtelen, maró folyadék, amely magába szívja a nedvességet környezetés már 16,5 °C-on lefagyasztjuk, szilárd színtelen kristályok képződésével. Az ecetsav kémiai képlete C 2 H 4 O 2.
Az ecet évezredek óta ismert a sör vagy a bor természetes fermentációs termékeként. 1847-ben a német kémikus, Hermann Kolbe először szintetizált ecetsavat a laboratóriumban. Jelenleg a világon az ecetsav teljes termelésének mindössze 10%-át nyerik ki természetes módszerekkel. De a természetes fermentációs módszer továbbra is fontos, mivel sok országban vannak olyan törvények, amelyek csak bioalapú ecetsavat írnak elő az élelmiszeriparban. Az E260 adalék biokémiai előállítása során egyes baktériumok etanol (alkohol) oxidáló képességét használják fel. Ez a módszer ecetsavas fermentációként ismert. Az E260 adalékanyag előállításához erjesztett gyümölcsleveket, bort vagy alkoholos vizes oldatot használnak alapanyagként. Az ecetsav szintézisére számos ipari módszer is létezik. Ezek közül a legnépszerűbb, amely a világ ecetsavszintézisének több mint felét teszi ki, a metanol katalizátorok jelenlétében végzett karbonilezése. A reakció kezdeti komponensei a metanol (CH 3 OH) és a szén-monoxid (CO).
Az ecetsav elengedhetetlen a munkához emberi test. Származékai segítik a szervezetben a szénhidrátok és zsírok lebontását, amelyek táplálékkal kerülnek a szervezetbe. Ecetsav szabadul fel bizonyos típusú baktériumok létfontosságú tevékenysége során, különösen Clostridium acetobutylicumés a nemzetséghez tartozó baktériumok Acetobaktérium. Ezek a baktériumok mindenütt megtalálhatók a vízben, a talajban, az élelmiszerekben és természetesen bejutni az emberi szervezetbe.
Az E260 adalékanyag mérgező hatása az emberi szervezetre az ecetsav vízzel való hígításának mértékétől függ. Azok az oldatok, amelyekben az ecetsav koncentrációja 30% feletti, egészségre és életre veszélyesnek minősülnek. Az erősen koncentrált ecetsav bőrrel és nyálkahártyával érintkezve súlyos kémiai égési sérüléseket okozhat.
Az élelmiszeriparban az E260 adalékanyagot édességek sütéséhez, zöldségkonzervekhez, majonéz és egyéb élelmiszerek előállításához használják.
Az E260 savanyúságot szabályozó anyag felhasználása engedélyezett élelmiszer termékek minden országban az emberi egészségre biztonságos adalékanyagként.
Az ecetsavat is használják:
- a mindennapi életben (vízkő eltávolítása a vízforralókról, felületek gondozása);
- a vegyiparban (oldószerként és vegyszerként);
- az orvostudományban (gyógyszerek beszerzése);
- más iparágakban.
Élelmiszer-tartósítószer E260 Az ecetsavat minden, a gasztronómia művészete iránt érdeklődő ember jól ismeri. Ez a termék a szőlőborok természetes körülmények között történő savanyításának eredménye, melynek során az alkohol és a szénhidrátok erjesztődnek. Ezenkívül ismert, hogy az ecetsav közvetlenül részt vesz az emberi szervezet anyagcsere-folyamataiban.
Az ecetsav erős szaga van, de tiszta forma ez egy teljesen színtelen folyadék, amely képes felszívni a nedvességet a környezetből. Ez az anyag mínusz 16 fokos hőmérsékleten képes megfagyni, ennek eredményeként átlátszó kristályok képződnek.
Figyelemre méltó, hogy az ecetsav 3-6%-os oldatát ecetnek nevezik, míg 70-80%-ban ecetesszenciát kapnak. Az E260 vízbázisú megoldásokat nem csak az élelmiszeriparban, hanem a háztartási főzésben is széles körben alkalmazzák. Az E260 ecetsav élelmiszer-tartósítószer fő felhasználási területe pácok és konzervek gyártása.
Ezenkívül ezt az anyagot aktívan hozzáadják és mikor ipari termelés számos édesipari termék, valamint majonéz és zöldségkonzerv. Gyakran szükség esetén az E260 E260 Ecetsav élelmiszer-tartósítószer fertőtlenítőszerként és fertőtlenítőszerként is használható.
Az élelmiszer-előállítási terület azonban nem az egyetlen terület az E260 élelmiszer-tartósítószer használatára. Így széles körben használják a vegyipari gyártásban szerves üveg, acetátszálak gyártásában, valamint észterek és gyógyszerek gyártásában.
A farmakológiában egyébként széles körben használják az úgynevezett ecetsav-észtert, amelyet az ember acetilszalicilsav vagy aszpirin néven ismer jobban. Oldószerként az ecetsav is számos esetben segít az embernek, az összetételéből izolált sókat pedig sikeresen alkalmazzák a növényi kártevők elleni küzdelemben.
Élelmiszer-tartósítószer káros hatása E260 Ecetsav
Az E260 ecetsav élelmiszer-tartósítószer emberre gyakorolt káros hatása különösen akkor szembetűnő, ha ezt az anyagot nagy koncentrációban fogyasztják, mivel ebben a formában nagyon mérgező. Mellesleg, a savas toxicitás mértéke közvetlenül attól függ, hogy mennyit hígítottunk vízzel. Az egészségre leginkább veszélyesnek azokat az oldatokat tekintik, amelyek koncentrációja meghaladja a 30 százalékot. Ha a nyálkahártya vagy a bőr tömény ecetsavval érintkezik, súlyos kémiai égési sérülések keletkeznek.
Élelmiszer-tartósítószer E260 Az ecetsav a világ minden országában engedélyezett az élelmiszeriparban, mivel nem minősül egészségre veszélyesnek. Az egyetlen dolog, amit a szakértők javasolnak az E260 ecetsav élelmiszer-tartósítószer lehetséges károsodásának elkerülése érdekében, hogy korlátozzák az ezt az anyagot tartalmazó termékek használatát a máj- és gyomor-bélrendszeri betegségekben szenvedők összetételében. Az ilyen termékek 6-7 év alatti gyermekeknek nem ajánlottak.
Ecetsav
A bor illékony savai olyan egybázisú zsírsavak, amelyek összetételében általános képlet szerepel.
Ezek a hangyasav, ecetsav, propionsav, vajsav, valeriánsav, kaprilsav és más magasabb zsírsavak. Az illékony savak közül mennyiségileg és értékükben a fő az ecetsav. A borok illósavtartalmának minden analitikai meghatározása ecetsavval történik.
A bor illékony savai alkoholos erjedés melléktermékei. Az erjedés során a legkisebb mennyiségű illósav a 15 ºС és 25 ºС közötti hőmérséklet-tartományban képződik. Magasabb és több alacsony hőmérsékletek az erjedés hozzájárul az illékony savak nagyobb tömegének kialakulásához. Aerob fermentációs körülmények között kevésbé illékony körülmények képződnek.
Az illékony savakat vízgőzdesztillálják. Ez a tulajdonság a mennyiségi meghatározásuk valamennyi módszerének hátterében.
Az illékony savak sói vízben és alkoholban könnyen oldódnak. Az illékony savak észterei kis mennyiségben kívánatosak szerves része csokrok borok és konyakok.
Ecetsav(CH3COOH) ősidők óta ismert. Savas gyökét ún Acetil"a sav latin megnevezéséből - « Acidum Aceticum» . A vízmentes ecetsav tiszta formájában színtelen, szúrós szagú folyadék, amely 16°C alatti hőmérsékleten kristályos masszává szilárdul. Az ecetsav forráspontja + 118,5 ºС.
Magát az ecetsavat és sóit egyaránt használják a mérnöki iparban. A sókat a textiliparban, a vegyiparban, a bőr- és a gumiiparban használják. Magából az ecetsavat acetont, cellulóz-acetátot, aromás anyagokat készítenek, használják a gyógyászatban, az élelmiszeriparban, pácok készítésére használják.
ólomecet (CH3 COOH)2Pb· Pb(Ó)2 Fehér gyártásánál és in kémiai elemzés fenolos anyagok kicsapására.
Ecetsavból készül az úgynevezett asztali ecet, amelyet kis mennyiségben széles körben használnak különféle ételek ízesítésére. A borból nyert természetes borecetre nagy a kereslet a főzés során.
Az asztali borecet elkészítéséhez a vízzel hígított bort ecettel enyhén megsavanyítják és lapos kádakba vagy nyitott hordókba helyezik. A folyadék felületére ecetsavbaktérium filmet visznek fel. Széles levegő hozzáférés (levegőztetés), lázés a szulfitáció teljes hiánya hozzájárul az ecetsavbaktériumok gyors fejlődéséhez és az etil-alkohol gyors átalakulásához ecetsavvá.
Az ecetsav az alkoholos erjedés kötelező mellékterméke, és az illékony savak nagy részét alkotja.
A borok illósav-tartalmának növekedését számos borbetegségben való előfordulásuk és a különféle borok aktivitásának eredményeként magyarázzák. patogén baktériumok. A legveszélyesebb és egyben a leggyakoribb borbetegség az Ecetes savanyú. Ezzel a betegséggel etanol a nemzetség ecetsavbaktériumok (Bact. aceti stb.) hatására ecetsavvá oxidálódik:
Az időben történő utántöltés, a boranyagok tárolása 10-12 ºС hőmérsékleten, a mérsékelt szulfitáció megakadályozza az ecetes savanyúság előfordulását a borban. Az ecetsavbaktériumok aerobok, és nagyon érzékenyek a kénsavra, ami korlátozza az oxigén hozzáférését a borhoz.
Az ecetsavas savanyúságban szenvedő borok korrigálására a bor felületére sherry filmet nevelhetünk. A boron fejlődő sherry élesztő jelentősen csökkenti az illékony savak tartalmát. A magas (több mint 4 g/dm3) illósav tartalmú asztali borokat az ecetsavas film eltávolítása után pasztőrözik az ecetsavbaktériumok elpusztítására, alkoholizálják és hagyományos erős borok keverékeihez használják. Az ecetsavbaktériumok legalább 100 mg/dm3 dózisú szulfitációval is elpusztíthatók azonnali bentonitkezeléssel és borszűréssel.
A bor illékony savai - 3 szavazat alapján 3,0 az 5-ből
Kolbe munkáival az ecetsav, és egyben az összes többi szerves sav szerkezete végleg tisztázódott, és a későbbi kémikusok szerepe csak a felosztásra redukálódott - elméleti megfontolások és Gerard tekintélye, Kolbe képlete fele-fele. és lefordítani azokat a szerkezeti nézetek nyelvére, aminek következtében a C2H6.C2O4H2 képlet CH3.CO(OH)-ra változott.
2. Az ecetsav tulajdonságai
Karbonsavak - egy vagy több -COOH karboxilcsoportot tartalmazó szerves vegyületek, amelyek szénhidrogén gyökhöz kapcsolódnak.
Savas tulajdonságok karbonsavak Az elektronsűrűség karbonil-oxigénre való eltolódása és az ebből eredő (az alkoholokhoz képest) О–Н kötés további polarizációja okozza. Vizes oldatban a karbonsavak ionokra disszociálnak:A növekedéssel molekuláris tömeg a savak vízben való oldhatósága csökken. A karboxilcsoportok száma szerint a savakat egybázisú (monokarbonsav) és többbázisú (dikarbonsav, trikarbonsav stb.) csoportra osztják.
A szénhidrogén gyök természete szerint megkülönböztetünk telített, telítetlen és aromás savakat.
A savak szisztematikus neveit a megfelelő szénhidrogén neve adja meg az utótag hozzáadásával -ovayaés szavakat sav. Gyakran használnak triviális neveket is.
Néhány telített egybázisú sav
|
Képlet |
Név |
|
|
szisztematikus |
jelentéktelen |
|
|
metán |
hangyás |
|
|
etán |
ecetsav |
|
|
propán |
propionos |
|
|
bután |
olajos |
|
|
pentán |
macskagyökér |
|
|
hexán |
kapron |
|
|
pentadekános |
palmitin- |
|
|
heptadecanoic |
sztearinsav |
|
A karbonsavak nagyon reaktívak. Különböző anyagokkal reagálnak, és sokféle vegyületet képeznek, amelyek között nagy jelentősége van funkcionális származékai, azaz a karboxilcsoporton végzett reakciók eredményeként kapott vegyületek.
2.1 Sók képződése a) fémekkel való kölcsönhatás során:
2RCOOH + Mg® (RCOO) 2Mg + H2
b) fém-hidroxiddal való reakciókban:
2RCOOH + NaOH ® RCOONa + H2O
A karbonsavak helyett gyakrabban használják savhalogenideiket: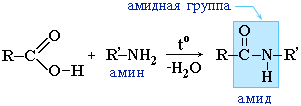 |
Az amidok fontos szerepet játszanak a természetben. A természetes peptidek és fehérjék molekulái a-aminosavakból épülnek fel amidcsoportok - peptidkötések - részvételével.
Ecetsav (etánsav).
Képlet: CH3-COOH; átlátszó színtelen folyadék szúrós szaggal; az olvadáspont alatt (olvadáspont 16,6 C) jégszerű massza (ezért a tömény ecetsavat jégecetnek is nevezik). Vízben, etanolban oldódik.
1. táblázat Az ecetsav fizikai tulajdonságai
| Név | Sav formula |
Oldhatóság (g/100 ml H2O; 25°C) | Ka (25°C-on) |
|||||
|
sói (észterei) |
||||||||
|
ecetsav |
etán | |||||||
Hasonló cikkek
-
Angol - óra, idő
Mindenkinek, aki érdeklődik az angol tanulás iránt, furcsa elnevezésekkel kellett megküzdenie p. m. és a. m , és általában, ahol az időt említik, valamiért csak 12 órás formátumot használnak. Valószínűleg nekünk, akik élünk...
-
"Alkímia papíron": receptek
A Doodle Alchemy vagy az Alchemy papíron Androidra egy érdekes kirakós játék gyönyörű grafikával és effektusokkal. Tanuld meg játszani ezt a csodálatos játékot, és találd meg az elemek kombinációit, hogy befejezd az Alkímiát a papíron. A játék...
-
A játék összeomlik a Batman: Arkham Cityben?
Ha szembesül azzal a ténnyel, hogy a Batman: Arkham City lelassul, összeomlik, a Batman: Arkham City nem indul el, a Batman: Arkham City nem települ, nincsenek vezérlők a Batman: Arkham Cityben, nincs hang, felbukkannak a hibák fent, Batmanben:...
-
Hogyan válasszunk le egy személyt a játékgépekről Hogyan válasszunk le egy személyt a szerencsejátékról
A Rating Bookmakers a moszkvai Rehab Family klinika pszichoterapeutájával és a szerencsejáték-függőség kezelésének specialistájával, Roman Gerasimovval együtt nyomon követte a szerencsejátékosok útját a sportfogadásban - a függőség kialakulásától az orvoslátogatásig,...
-
Rebuses Szórakoztató rejtvények rejtvények rejtvények
A „Riddles Charades Rebuses” játék: a válasz a „REJTÁSOK” részre, 1. és 2. szint ● Nem egér, nem madár – az erdőben hancúroz, fákon él és diót rág. ● Három szem – három parancs, piros – a legveszélyesebb. 3. és 4. szint ● Két antenna...
-
A méregpénzek átvételének feltételei
MENNYI PÉNZ KERÜL A SBERBANK KÁRTYASZÁMLÁRA A fizetési tranzakciók fontos paraméterei a jóváírás feltételei és mértéke. Ezek a kritériumok elsősorban a választott fordítási módtól függenek. Milyen feltételekkel lehet pénzt utalni a számlák között
