Vízmentes ecetsav formula. Kémia: Ecetsav, Absztrakt
a témán:
« Ecetsav»
Által végzett:_____________
______________________
Ellenőrizve:_____________
______________________
Volgograd 2004
Bevezetés…………………………………………………….3
1. Az ecetsav felfedezése…………………………..5
2. Az ecetsav tulajdonságai………………………..13
3. Ecetsav beszerzése………………………19
4. Az ecetsav használata…………………….22
Következtetés…………………………………………………..26
Felhasznált irodalom jegyzéke………………..…27
Bevezetés
ECECSAV, CH3COOH, szúrós szagú, színtelen gyúlékony folyadék, vízben jól oldódik. Jellegzetes savanyú ízű, elektromos áramot vezet.
Az ecetsav volt az egyetlen, amelyet az ókori görögök ismertek. Innen a neve: "oksos" - savanyú, savanyú íz. Az ecetsav a szerves savak legegyszerűbb fajtája, amely a növényi és állati zsírok szerves részét képezi. Kis koncentrációban élelmiszerekben és italokban van jelen, és részt vesz az anyagcsere folyamatokban a gyümölcsérés során. Az ecetsav gyakran megtalálható növényekben, állati váladékokban. Az ecetsav sóit és észtereit acetátoknak nevezzük.
Az ecetsav gyenge (vizes oldatban csak részben disszociál). Mivel azonban a savas környezet gátolja a mikroorganizmusok létfontosságú tevékenységét, a konzervgyártásban ecetsavat használnak élelmiszer termékek mint például a pácokban.
Az ecetsavat acetaldehid oxidációjával és más módszerekkel, az élelmiszer-ecetsavat az etanol ecetsavas fermentációjával nyerik. Gyógyászati és aromás anyagok előállítására használják oldószerként (például cellulóz-acetát előállításához), asztali ecet formájában ízesítők, pácok és konzervek gyártásához. Az ecetsav az élő szervezetekben számos anyagcsere-folyamatban vesz részt. Ez az illékony savak egyike, amely szinte minden élelmiszerben megtalálható, savanyú ízű, és az ecet fő összetevője.
A munka célja: az ecetsav tulajdonságainak, előállításának és felhasználásának tanulmányozása.
Feladatok ez a tanulmány:
1. Meséljen az ecetsav felfedezésének történetéről!
2. Tanulmányozza az ecetsav tulajdonságait!
3. Ismertesse az ecetsav előállításának módszereit!
4. Mutassa be az ecetsav használatának jellemzőit!
1. Az ecetsav felfedezése
Az ecetsav szerkezete a triklór-ecetsav Dumas általi felfedezése óta foglalkoztatja a vegyészeket, mivel ez a felfedezés csapást mért Berzelius akkoriban uralkodó elektrokémiai elméletére. Ez utóbbi, az elemeket elektropozitívra és elektronegatívra osztva, nem ismerte fel a szerves anyagokban való helyettesítés lehetőségét anélkül, hogy ezekben mélyreható változás történt volna. kémiai tulajdonságok , hidrogént (elektropozitív elem) klórral (elektronegatív elem), de közben Dumas megfigyelései szerint ("Comptes rendus" a Párizsi Akadémia, 1839) kiderült, hogy "a klór bevezetése hidrogén helyett nem teljesen megváltoztatja a molekula külső tulajdonságait ...", miért Dumas és felteszi a kérdést "az egyszerű testek molekuláinak (atomjainak) polaritására vonatkozó elektrokémiai nézetek és elképzelések olyan egyértelmű tényeken alapulnak, hogy tárgyaknak tekinthetők a feltétlen hitről; ha ezeket hipotéziseknek kell tekinteni, akkor vajon ezek a hipotézisek alkalmasak-e a tényekre "... El kell ismernünk – folytatja –, hogy a helyzet más. A szervetlen kémiában az izomorfizmus, a tényeken alapuló elmélet, amely, mint ismeretes, alig egyezik az elektrokémiai elméletekkel. A szerves kémiában a szubsztitúció elmélete ugyanazt a szerepet tölti be... és talán a jövő megmutatja, hogy a két nézet szorosabban kapcsolódik egymáshoz , hogy ugyanazokból az okokból következnek és általánosíthatók egy és ugyanaz a név. Mindeközben az U. sav klór-ecetsavvá és aldehid klóraldehiddé (klóral) való átalakulása alapján, valamint abból a tényből, hogy ezekben az esetekben minden hidrogén helyettesíthető azonos térfogatú klórral anélkül, hogy az alapvető kémiai természet megváltozna. Az anyag alapján megállapíthatjuk, hogy a szerves kémiában vannak olyan típusok, amelyek akkor is megmaradnak, ha hidrogén helyett egyenlő térfogatú klórt, brómot és jódot viszünk be. Ez pedig azt jelenti, hogy a szubsztitúció elmélete tényeken alapul, és ráadásul a szerves kémiában a legbriliánsabb." A Svéd Akadémia éves jelentésében ("Jahresbericht stb.", 19. köt., 1840. o.) idézve ezt a kivonatot. Berzelius megjegyzi: "Dumas előállított egy vegyületet, amelyhez a C4Cl6O3 + H2O racionális képletet adja (Az atomsúlyok modernek; a triklór-ecetsavat vízzel képzett anhidridvegyületnek tekintik.); ezt a megfigyelést a faits les plus eclatants de la Chimie organque közé sorolja; ez az alapja a helyettesítés elméletének. ami szerinte megdönti az elektrokémiai elméleteket... de közben kiderül, hogy csak egy kicsit másképp kell írni a képletét ahhoz, hogy oxálsav vegyület legyen. a megfelelő kloriddal, C2Cl6 + C2O4H2, amely az oxálsavval együtt marad savban és sókban egyaránt. Tehát egyfajta vegyülettel van dolgunk, amelyre számos példa ismert; sok ... mind az egyszerű, mind az összetett gyököknek megvan az a tulajdonsága, hogy oxigéntartalmú részük bázisokkal keveredik, és elveszíti azokat anélkül, hogy elveszítené a kapcsolatot a klórtartalmú résszel. Ezt a nézetet Dumas nem mutatta be és nem vetették alá kísérleti igazolásnak, de közben, ha igaz, akkor az új tanítás, amely Dumas szerint összeegyeztethetetlen az eddig uralkodó elméleti elképzelésekkel, megvan a talaj kihúzódik a lába alól és le kell esnie.majd néhány szervetlen vegyület, véleménye szerint a klór-ecetsavhoz hasonló (köztük Berzelius a krómsav-kloridot is idézte - CrO2Cl2, amit a perklór-króm vegyületének tartott ( a mai napig ismeretlen) króm-anhidriddel: 3CrO2Cl2 \u003d CrCl6 + 2CrO3) , Berzelius így folytatja: „A Dumas-klór-ecetsav nyilvánvalóan ebbe a vegyületosztályba tartozik; benne a széngyök oxigénnel és klórral is egyesül. Ez tehát lehet oxálsav, amelyben az oxigén felét klór helyettesíti, vagy 1 atomos (molekula) oxálsav és 1 szénatomos (molekula) szeszkviklorid - C2Cl6. Az első feltevés nem fogadható el, mert megengedi 11/2 oxigénatom klórral való helyettesítésének lehetőségét (Berzelius szerint az oxálsav C2O3 volt.). Dumas ezzel szemben ragaszkodik a fenti kettővel teljesen összeegyeztethetetlen harmadik gondolathoz, miszerint nem a klór helyettesíti az oxigént, hanem az elektropozitív hidrogént, így a C4Cl6 szénhidrogén keletkezik, amely ugyanolyan komplex gyök tulajdonságaival rendelkezik, mint a klór. C4H6 vagy acetil, és állítólag 3 oxigénatomos savat képes adni, tulajdonságaiban megegyezik a W.-vel, de mint az összehasonlításból (fizikai tulajdonságaikból) látható, teljesen eltér attól. ugyanabban az évben ( "Jahresb.", 19, 1840, 558) Gerard cikkével kapcsolatban ("Journ. f. pr. Ch.", XIV, 17): "Gerard, azt mondja, új véleményt fogalmazott meg az alkohol, az éter és azok összetételéről származékok; ez a következő: a króm, oxigén és klór jól ismert vegyületének képlete = CrO2Cl2, a klór helyettesíti benne az oxigénatomot (Berzelius jelentése 1 króm-anhidrid oxigénatom - CrO3). Az U. sav C4H6 + 3O 2 atomot (molekulát) tartalmaz oxálsavat, amelyek közül az egyikben az összes oxigént hidrogén \u003d C2O3 + C2H6 helyettesíti. És egy ilyen képletjáték 37 oldalt töltött meg. De már a következő évben Dumas, a típusok gondolatát továbbfejlesztve, rámutatott, hogy az U. és a triklór-ecetsav tulajdonságainak azonosságáról beszélve kémiai tulajdonságaik azonosságára gondolt, egyértelműen kifejezve pl. a lúgok hatására bekövetkező bomlásukhoz hasonlóan: C2H3O2K + KOH \u003d CH4 + K2CO8 és С2Cl3O2K + KOH \u003d CHCl3 + K2CO8, mivel a CH4 és a CHCl3 ugyanazon mechanikai típus képviselői. Másrészt Liebig és Graham nyilvánosan szót emelt a szubsztitúcióelmélet alapján elért nagy egyszerűség mellett, amikor a közönséges éter klórszármazékait, valamint a Malagutti és Berzelius által nyert hangya- és U. sav észtereit vizsgálták, és így kaptak. az új tények nyomására, az 5. sz. "Lehrbuch der Chemie" című művéből (1842. novemberi előszó), megfeledkezve Gerardról írt kemény kritikájáról, lehetségesnek találta a következőket írni: "Ha felidézzük az ecetsav átalakulását (a bomlás szövegében) klór hatására. klóroxálsavba (Chloroxalic acid - Chloroxalsaure - Berzelius triklór-ecetsavat nevez ("Lehrbuch", 5. kiadás, 629. o.), akkor lehetséges az ecetsav összetételének más nézete is (az ecetsavat Berzelius Acetylsaure-nak nevezi), nevezetesen lehet kombinált oxálsav, amelyben az illesztőcsoport (Paarling) a C2H6, ahogy a klóroxálsavban a C2Cl6, és akkor a klór ecetsavra gyakorolt hatása csak a C2H6 C2Cl6 átalakulásából állna. ., azonban érdemes odafigyelni ennek lehetőségére”.
Így Berzeliusnak el kellett ismernie annak lehetőségét, hogy a hidrogént klórral helyettesítse anélkül, hogy megváltoztatná az eredeti test kémiai funkcióját, amelyben a helyettesítés megtörténik. Anélkül, hogy nézeteinek más vegyületekre való alkalmazásán kitérnék, áttérek Kolbe munkáira, aki az ecetsavra, majd más korlátozó egybázisú savakra vonatkozóan számos olyan tényt talált, amelyek összhangban voltak Berzelius (Gerard) nézeteivel. . Kolbe munkájának kiindulópontja egy kristályos anyag, a CCl4SO2 összetétel tanulmányozása volt, amelyet korábban Berzelius és Marse aqua regia hatására CS2-n, Kolbe pedig nedves klór hatására CS2-n alakított ki. Számos Kolbe-transzformáció (Lásd Kolbe, "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph.", 54, 1845, 145).) azt mutatta, hogy ez a test modern szóhasználattal triklór-metil-szulfon-klór-anhidrid. savak, CCl4SO2 = CCl3.SO2Cl (Kolbe Schwefligsaures Kohlensuperchloridnak nevezte), amely lúgok hatására képes a megfelelő sav - CCl3.SO2 (OH) sóit adni [Kolbe szerint HO + C2Cl3S2O5 - Chlorkohlenunterschwe:Hofelsuperschwe] =2, Cl=71, C \u003d 12 és O \u003d 16; ezért a modern atomtömegeknél ez C4Cl6S2O6H2.), amely a cink hatására először egy Cl atomot hidrogénnel helyettesít, így savat képez CHCl2.SO2 (OH) [Kolbe szerint - wasserhaltige Chlorformylunterschwefelsaure (Berzelius (" Jahresb. "25, 1846, 91)) megjegyzi, hogy helyes az S2O5 ditionsav és kloroformil kombinációjának tekinteni, ezért nevezi CCl3SO2-nak (CCl3SO2) Kohlensuperchlorur (C2Cl6) - Dithionsaure (S2O5). A hidratált vizet, mint általában, Berzelius nem veszi figyelembe, és eszünk, a másik pedig CH2Cl.SO2 (OH) savat képezve [Kolbe - Chlorelaylunterschwefelsaure szerint], végül pedig az árammal vagy kálium-amalgámmal történő redukció során (a reakciót nem sokkal korábban a Melsance használta a triklór-ecetsav ecetsavvá történő redukálására sav.) hidrogénnel és mindhárom Cl atommal helyettesíti, metilszulfonsavat képezve. CH3.SO2(OH) [Kolbe - Methylunterschwefelsaure szerint]. Ezeknek a vegyületeknek a klór-ecetsavval való analógiája önkéntelenül feltűnő volt; valóban, az akkori képletekkel két párhuzamos sorozatot kaptunk, amint az a következő táblázatból is látható: S2O5 H2O + C2H6.C2O3 Ez nem kerülte el Kolbét, aki megjegyzi (I. 181. o.): "az egyesített kénes savakra fent leírt módon és közvetlenül klór-szénhidrogénben (fent - H2O + C2Cl6. S2O5) a klóroxálsavhoz, más néven klór-ecetsavhoz kapcsolódik. Folyékony klórozott szénhidrogén - СCl (Сl=71, С=12; most C2Cl4-et írunk - ez klór-etilén.), Mint ismeretes, klór - hexaklór-etán (az akkori nómenklatúra szerint - Kohlensuperchlorurur) hatására fénnyé válik, és arra számíthatunk, hogy ha egyidejűleg víz hatásának lenne kitéve, akkor, mint a bizmut-klorid, klórantimon stb., a képződés pillanatában a klórt oxigénnel helyettesíti. A tapasztalatok megerősítették a feltételezést. "A víz alatt lévő C2Cl4-re fény és klór hatására Kolbe hexaklór-etánnal együtt triklór-ecetsavat kapott, és az átalakulást a következőképpen fejezte ki: (Mivel a C2Cl4 a CCl4-ből nyerhető ki egy fűtött) csőben, és a CCl4 a Cl2 CS2-re történő hevítésével történő hatására képződik, majd a Kolbe-reakció volt az első ecetsav szintézis az elemekből.) „Az, hogy egyidejűleg szabad oxálsav képződik-e, nehéz meghatározni. döntsön, mivel a klór azonnal ecetsavvá oxidálja a fényben "... Berzeliusnak a klór-ecetsavról alkotott nézetét "meglepő módon (auf eine tiberraschende Weise) megerősíti a kombinált kénes savak tulajdonságainak megléte és párhuzamossága, és úgy tűnik, én (mondja Kolbe I. 186. o.), túllép a hipotézisek mezején, és nagy valószínűséggel tesz szert. Ha ugyanis a klór-ecetsavnak (Chlorkohlenoxalsaure, ahogy Kolbe manapság klór-ecetsavnak nevezi.) van összetétele, kompozíciószerű klór-karbonsavat, akkor a metil-kénsavért felelős ecetsavat is vegyes savnak kell tekintenünk, és metil-oxálsavnak kell tekintenünk: C2H6.C2O3 (Ezt Gerard korábban kifejtette). Nem hihetetlen, hogy a jövőben kénytelenek leszünk a kombinált savak közül jelentős számban venni azokat a szerves savakat, amelyekben jelenleg információnk korlátai miatt feltételezett gyököket fogadunk el... "" Ami a jelenségeket illeti ezekben a kombinált savakban való szubsztitúció, akkor egyszerű magyarázatot kapnak, hogy a különböző, valószínűleg izomorf vegyületek képesek egymást helyettesíteni a kombinált csoportok szerepében (als Paarlinge, l. p. 187. o.), anélkül, hogy jelentősen megváltoztatnák a savak savas tulajdonságait. "További kísérleti megerősítés Ezt a nézetet találjuk Frankland és Kolbe cikkében: "Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen" ("Ann. Chem. . n. Pharm.", 65, 1848, 288) Abból az elgondolásból kiindulva, hogy a (CH2)2nO4 sorozat összes savja úgy épül fel, mint a metiloxálsav (most CnH2nO2-t írunk, és metiloxálsavat - ecetsavnak nevezünk), a következőket veszik észre. általános: "ha a H2O + H2.C2O3 képlet a hangyasav racionális összetételének valódi kifejezését jelenti, vagyis ha egy ekvivalens hidrogénnel kombinált oxálsavnak tekintjük (A kifejezés nem helyes; H helyett. Frankland és Kolbe az áthúzott betűt használja, ami 2 N.-nek felel meg), majd a -val való transzformációt magas hőmérsékletű ammónium-formiát vizes hidrogén-ciánsavvá, mert Dobereiner tudja és megállapította, hogy az ammónium-oxalát hevítéskor vízzé és ciánná bomlik. A hangyasavval keverve a hidrogén csak azáltal vesz részt a reakcióban, hogy ciánnal kombinálva hidrogén-cianidot képez: fordított oktatás a hidrogén-cianidból lúgok hatására keletkező hangyasav nem más, mint a vízben oldott cianid jól ismert átalakulásának megismétlése oxálsavvá és ammóniává, az egyetlen különbséggel; hogy a képződés pillanatában az oxálsav a hidrogén-ciánsav hidrogénjével kombinálódik. "Az a tény, hogy például a benzol-cianidnak (C6H5CN) Fehling szerint nincs savas tulajdonságai és nem képez poroszkéket, Kolbe szerint lehet és Frankland, párhuzamba állítható azzal, hogy az etil-klorid nem képes az AgNO3-mal való reakcióra, Kolbe és Frankland pedig nitril-módszerrel végzett szintézissel bizonyítja helyességét (Nitrileket kénsavak KCN-nel történő desztillálásával nyertek (Dumas és Malagutti módszerrel Leblanc-cal) : R "SO3 (OH) + KCN \u003d R. CN + KHSO4) ecetsav, propionsav (az akkori szerint met-aceton) és kapronsav. Majd a következő évben Kolbe alávetette az egybázisú telített savak lúgos sóit. elektrolízishez és sémájának megfelelően az ecetsav elektrolízise során egyidejűleg megfigyelt etán, szénsav és hidrogén képződése: H2O+C2H6.C2O3=H2+, valamint valeriánsav elektrolízisében - oktán , szénsav és hidrogén: H2O+C8H18.C2O3=H2+. Nem lehet azonban figyelmen kívül hagyni, hogy Kolbe ecetsavból hidrogénnel kombinált metilt (CH3), azaz mocsári gázt, valeriánsavból pedig hidrogénnel kombinált butil-C4H9-et várt, azaz C4H10-et (a C4H9 vallilnek nevezi) , de ebben az elvárásban engedményt kell látni Gerard képleteivel szemben, aki már jelentős állampolgári jogokat kapott, aki feladta az ecetsavról alkotott korábbi nézetét, és nem tartotta a C4H8O4-nek, amely képlet a krioszkópos adatokból ítélve valójában rendelkezik. , hanem a C2H4O2-ra, ahogy az minden modern kémia tankönyvben meg van írva.
Kolbe munkáival az ecetsav, és egyben az összes többi szerves sav szerkezete végleg tisztázódott, és a későbbi kémikusok szerepe csak a felosztásra redukálódott - elméleti megfontolások és Gerard tekintélye, Kolbe képlete fele-fele. és lefordítani azokat a szerkezeti nézetek nyelvére, aminek következtében a C2H6.C2O4H2 képlet CH3.CO(OH)-ra változott.
2. Az ecetsav tulajdonságai
karbonsavak- egy vagy több karboxilcsoportot tartalmazó szerves vegyületek -COOH szénhidrogén gyökkel kapcsolatban.
Savas tulajdonságok a karbonsavak az elektronsűrűség karboniloxigénné való eltolódásának és az ebből eredő (az alkoholokhoz képest) az O–H kötés további polarizációjának köszönhető.
Vizes oldatban a karbonsavak ionokra disszociálnak:
A molekulatömeg növekedésével a savak vízben való oldhatósága csökken.
A karboxilcsoportok száma szerint a savakat egybázisú (monokarbonsav) és többbázisú (dikarbonsav, trikarbonsav stb.) csoportra osztják.
A szénhidrogén gyök természete szerint megkülönböztetünk telített, telítetlen és aromás savakat.
A savak szisztematikus neveit a megfelelő szénhidrogén neve adja meg az utótag hozzáadásával -ovayaés szavakat sav. Gyakran használnak triviális neveket is.
Néhány telített egybázisú sav
| Képlet | Név |
|
| szisztematikus | jelentéktelen |
|
| HCOOH | metán | hangyás |
| etán | ecetsav | |
| propán | propionos | |
| bután | olajos | |
| pentán | macskagyökér | |
| hexán | kapron | |
| pentadekános | palmitin- | |
| heptadecanoic | sztearinsav | |
A karbonsavak nagyon reaktívak. Különböző anyagokkal reagálnak, és sokféle vegyületet képeznek, amelyek között nagy jelentősége van funkcionális származékai, azaz a karboxilcsoport reakcióiból származó vegyületek.
2.1 Sóképződés
a) fémekkel való kölcsönhatás során:
2RCOOH + Mg ® (RCOO) 2 Mg + H 2
b) fém-hidroxiddal való reakciókban:
2RCOOH + NaOH ® RCOONa + H 2 O
A karbonsavak helyett gyakrabban használják savhalogenideiket:
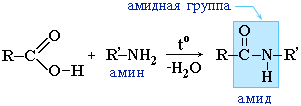 |
Amidok karbonsavak (halogenidjeik vagy anhidridjeik) és szerves ammóniaszármazékok (aminok) kölcsönhatásából is keletkeznek:
Az amidok fontos szerepet játszanak a természetben. A természetes peptidek és fehérjék molekulái a-aminosavakból épülnek fel amidcsoportok - peptidkötések - részvételével.
Ecetsav (etánsav).
Képlet: CH3-COOH; átlátszó színtelen folyadék szúrós szaggal; az olvadáspont alatt (olvadáspont 16,6 C) jégszerű massza (ezért a tömény ecetsavat jégecetnek is nevezik). Vízben, etanolban oldódik.
1. táblázat Az ecetsav fizikai tulajdonságai
| Név | Képlet | tforr | Megoldás- | Ka |
||||
| savak | a sóját |
|||||||
| ecetsav | etán | acetát | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
A szintetikus élelmiszer-ecetsav színtelen, tiszta, gyúlékony folyadék, erős ecetszaggal. A szintetikus élelmiszeripari minőségű ecetsavat metanolból és szén-monoxidból állítják elő ródiumkatalizátoron. A szintetikus élelmiszer-ecetsavat a vegyiparban, a gyógyszeriparban és a könnyűiparban, valamint az iparban használják Élelmiszeripar tartósítószerként. Formula CH 3 COOH.
A szintetikus élelmiszeripari minőségű ecetsav koncentrált (99,7%) és vizes oldat (80%) formájában kapható.
A fizikai és kémiai mutatók szerint a szintetikus élelmiszer-ecetsavnak meg kell felelnie a következő szabványoknak:
2. táblázat Főbb műszaki követelmények
| Az indikátor neve | |
| 1. Megjelenés | Színtelen, átlátszó folyadék, mechanikai szennyeződések nélkül |
| 2. Vízben való oldhatóság | Teljes, tiszta oldat |
| 3. Az ecetsav tömeghányada, %, nem kevesebb, mint | 99,5 |
| 4. Az acetaldehid tömeghányada,%, nem több | 0,004 |
| 5. A hangyasav tömeghányada, %, nem több | 0,05 |
| 6. Szulfátok tömeghányada (SO 4),%, nem több | 0,0003 |
| 7. A kloridok tömeghányada (Cl),%, nem több | 0,0004 |
| 8. A hidrogén-szulfiddal kicsapott nehézfémek tömeghányada (Pb),%, nem több | 0,0004 |
| 9. Vas tömeghányada (Fe),%, nem több | 0,0004 |
| 10. Nem illékony maradék tömeghányada,%, nem több | 0,004 |
| 11. Kálium-permanganát oldat színtartóssága, min, nem kevesebb | 60 |
| 12. Kálium-dikromáttal oxidált anyagok tömeghányada, cm 3 nátrium-tioszulfát oldat, c koncentráció (Na 2 SO 3 * 5H 2 O) \u003d 0,1 mol / dm 3 (0,1 H), nem több | 5,0 |
A szintetikus élelmiszer-ecetsav gyúlékony folyadék, a szervezetre gyakorolt hatás mértéke szerint a 3. veszélyességi osztályba tartozó anyagok közé tartozik. Ha ecetsavval dolgozik, használja egyéni eszközökkel védelem (szűrős gázálarcok). Elsősegély égési sérüléseknél - bőséges lemosás vízzel.
A szintetikus élelmiszer-ecetsavat tiszta vasúti tartálykocsikba, tartálykocsikba öntik belső felület rozsdamentes acélból, akár 275 dm3 űrtartalmú rozsdamentes konténerekbe, tartályokba és hordókba, valamint 50 dm3 űrtartalmú üvegpalackokba és polietilén hordókba. A polimer tartály alkalmas az ecetsav egy hónapon belüli öblítésére és tárolására. A szintetikus élelmiszeripari minőségű ecetsavat légmentesen záródó rozsdamentes acél tartályokban tárolják. A konténereket, konténereket, hordókat, palackokat és polietilén palackokat raktárakban vagy lombkorona alatt tárolják. Erős oxidálószerekkel (salétromsav, kénsav, kálium-permanganát stb.) együttes tárolás nem megengedett.
12X18H10T vagy 10X17H13M2T rozsdamentes acélból készült vasúti tartályokban szállítják, felső ürítéssel.
3. Ecetsav kinyerése
Az ecetsav a legfontosabb vegyi termék, amelyet az iparban széles körben használnak észterek, monomerek (vinil-acetát) előállítására, az élelmiszeriparban stb. Világtermelése eléri az évi 5 millió tonnát. Egészen a közelmúltig az ecetsav előállítása petrolkémiai nyersanyagokon alapult. A Walker-eljárásban etilént használnak enyhe körülmények között légköri oxigénnel acetaldehiddé oxidálódik PdCl2 és CuCl2 katalitikus rendszer jelenlétében. Továbbá az acetaldehidet ecetsavvá oxidálják:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
Egy másik módszer szerint az ecetsavat úgy állítják elő, hogy n-butánt 200 C hőmérsékleten és 50 atm nyomáson kobaltkatalizátor jelenlétében oxidálnak.
A kecses Walker-eljárást, a petrolkémia fejlődésének egyik szimbólumát, fokozatosan felváltják a szén nyersanyag felhasználásán alapuló új módszerek. Az ecetsav metanolból történő előállítására szolgáló módszereket fejlesztettek ki:
CH3OH + COCH3COOH
Ez a nagy ipari jelentőségű reakció kiváló példa a homogén katalízis sikerére. Mivel a reakció mindkét komponense - CH3OH és CO - kinyerhető szénből, a karbonilezési eljárás gazdaságosabbá válik az olajárak emelkedésével. A metanol karbonilezésére két ipari eljárás létezik. A BASF által kifejlesztett régebbi módszer kobalt katalizátort használt, a reakciókörülmények szigorúak voltak: hőmérséklet 250°C és nyomás 500-700 atm. Egy másik, a Monsanto által elsajátított eljárás ródiumkatalizátort használt, a reakciót több helyen végezték alacsony hőmérsékletek(150-200 C) és nyomás (1-40 atm). Érdekes ennek a folyamatnak a felfedezésének története. A cég tudósai ródium-foszfin katalizátorok segítségével vizsgálták a hidroformilezést. A petrolkémiai osztály műszaki igazgatója ugyanezt a katalizátort javasolta a metanol karbonilezéséhez. A kísérletek eredménye negatív volt, ennek oka a fém-szén kötés kialakításának nehézsége. Emlékeztek azonban egy cég tanácsadójának előadására a metil-jodid könnyű oxidatív hozzáadásával fémkomplexekhez, a kutatók úgy döntöttek, hogy jód-promotert adnak a reakcióelegyhez, és ragyogó eredményt értek el, amit először nem hittek el. Hasonló felfedezést tettek a rivális Union Carbide cég tudósai is, akik csak néhány hónappal voltak lemaradva. A metanol-karbonilezési technológiát fejlesztő csapat mindössze 5 hónapos intenzív munka után megalkotta a Monsanto ipari eljárást, melynek segítségével 1970-ben 150 ezer tonna ecetsavat nyertek. Ez a folyamat lett a tudományterület előhírnöke, amelyet C1-kémiának neveztek.
A karbonilezési mechanizmust alaposan vizsgálták. A reakcióhoz szükséges metil-jodidot az egyenlettel kapjuk meg
CH3OH + HI CH3I + H2O
A katalitikus ciklus a következőképpen ábrázolható:
A - (I) négyzet-sík komplexhez oxidatív úton metil-jodidot adva hatkoordinációs II komplex keletkezik, majd a metil-ródium kötésen keresztül CO bejuttatása eredményeként acetilródium komplex (III) keletkezik. Az ecetsav-jodid reduktív eliminációja regenerálja a katalizátort, a jodid hidrolízise pedig ecetsavat eredményez.
Ecetsav ipari szintézise:
a) bután katalitikus oxidációja
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
b) szén-monoxid (II) és metanol elegyét nyomás alatt melegítjük katalizátoron
CH3OH + COCH3COOH
Ecetsav előállítása fermentációval (ecetsavas fermentáció).
Nyersanyagok: etanol tartalmú folyadékok (bor, erjesztett gyümölcslevek), oxigén.
Segédanyagok: ecetsavbaktériumok enzimei.
Kémiai reakció: Az etanol biokatalitikusan ecetsavvá oxidálódik.
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
Fő termék: ecetsav.
4. Ecetsav alkalmazása
Az ecetsavat gyógyászati és aromás anyagok előállítására használják oldószerként (például cellulóz-acetát előállításához), asztali ecet formájában fűszerek, pácok és konzervek gyártásához.
Az ecetsav vizes oldatát ízesítőként és tartósítószerként (élelmiszerek fűszerezése, gomba, zöldségek pácolása) használják.
Az ecet összetétele olyan savakat tartalmaz, mint az almasav, tejsav, aszkorbin, ecetsav.
Almaecet (4%-os ecetsav)
Az almaecet 20 esszenciális anyagot tartalmaz ásványokés nyomelemek, valamint ecetsav, propionsav, tejsavas és citromsav, számos enzim és aminosav, értékes élelmi rost, például hamuzsír, pektin. Az almaecetet széles körben használják főzéshez és konzervgyártáshoz. Jól passzol mindenféle salátához, friss zöldségekből, húsból és halból egyaránt. Használható hús, uborka, káposzta, kapribogyó, porcsin, szarvasgomba pácolására. Nyugaton azonban az almaecet leginkább arról ismert gyógyászati tulajdonságait. Magasra használják vérnyomás, migrén, asztma, fejfájás, alkoholizmus, szédülés, ízületi gyulladás, vesebetegség, magas láz, égési sérülések, felfekvés stb.
Egészséges emberek minden nap ajánlott egy egészséges és frissítő ital fogyasztása: egy pohár vízben keverjünk el egy kanál mézet és adjunk hozzá 1 kanál almaecetet. Ha fogyni szeretne, javasoljuk, hogy minden étkezéskor igyon meg egy pohár cukrozatlan vizet két evőkanál almaecettel.
Az ecetet széles körben használják az otthoni konzervgyártásban különféle erősségű pácok készítéséhez. NÁL NÉL népi gyógymód Az ecetet nem specifikus lázcsillapítóként használják (a bőr 3: 1 arányú víz és ecet oldatával történő dörzsölésével), valamint fejfájás esetén krémekkel. Rovarcsípés esetén borogatással ecetet szoktak használni.
Az alkoholecet kozmetológiában való felhasználása ismert. Mégpedig azért, hogy dauer és tartós festés után puhaságot és fényt adjon a hajnak. Ehhez ajánlatos a hajat meleg vízzel öblíteni alkoholecet hozzáadásával (3-4 evőkanál ecet 1 liter vízhez).
Szőlőecet (4%-os ecetsav)
A szőlőecetet a vezető szakácsok széles körben használják nemcsak Szlovéniában, hanem az egész világon. Szlovéniában hagyományosan különféle zöldség- és szezonális saláták készítésére használják (2-3 evőkanál salátástálonként). egyedi és kifinomult ízt ad az ételnek. A szőlőecet különféle halsalátákhoz és tengeri ételekhez is jól passzol. Ha különféle húsokból, de különösen sertéshúsból készít kebabot, a szőlőecet egyszerűen pótolhatatlan.
A gyártáshoz ecetsavat is használnak gyógyszerek.
Az aszpirin tabletták (ES) acetilszalicilsavat tartalmaznak, amely egy ecetsav-észter. szalicil sav.
Acetilszalicilsav szalicilsavat vízmentes ecetsavval kis mennyiségű kénsav jelenlétében (katalizátorként) állítanak elő.
Ha nátrium-hidroxiddal (NaOH) vizes oldatban hevítjük, az acetilszalicilsav nátrium-szaliciláttá és nátrium-acetáttá hidrolizál. Amikor a közeget megsavanyítjuk, a szalicilsav kicsapódik, és az olvadáspontja alapján (156-1600 C) azonosítható. Egy másik módszer a hidrolízis során keletkező szalicilsav azonosítására, hogy vas-klorid (FeCl3) hozzáadásakor oldatát sötétlilára színezzük. A szűrletben lévő ecetsav etanollal és kénsavval melegítéssel etoxietanollá alakul, amely jellegzetes szagáról könnyen felismerhető. Ezenkívül az acetilszalicilsav különböző kromatográfiás módszerekkel azonosítható.
Az acetilszalicilsav kikristályosodik, és színtelen monoklin poliédereket vagy tűket képez, amelyek íze enyhén savanyú. Száraz levegőn stabilak, de nedves környezetben fokozatosan szalicilsavvá és ecetsavvá hidrolizálnak (Leeson és Mattocks, 1958; Stempel, 1961). A tiszta anyag fehér kristályos por, szinte szagtalan. Az ecetsav szaga azt jelzi, hogy az anyag elkezdett hidrolizálni. Az acetilszalicilsav észterezésen megy keresztül lúgos hidroxidok, lúgos hidrogén-karbonátok hatására, valamint forrásban lévő vízben is.
Az acetilszalicilsav gyulladáscsökkentő, lázcsillapító és fájdalomcsillapító hatású, széles körben alkalmazzák lázra, fejfájásra, neuralgiára stb., valamint reumaellenes szerként.
Az ecetsavat a vegyiparban is használják (cellulóz-acetát gyártása, amelyből acetátszálat, szerves üveget, fóliát nyernek; színezékek, gyógyszerek és észterek szintéziséhez), nem éghető fóliák, parfümtermékek gyártásában, oldószerek a színezékek szintézisében, gyógyászati anyagok mint például az aszpirin. Az ecetsav sóit a növényi kártevők elleni védekezésre használják.
Következtetés
Ebben a cikkben az ecetsav felfedezésének, főbb tulajdonságainak, előállításának és alkalmazásának kérdéseit tárgyaltuk.
Tehát az ecetsav (CH3COOH), színtelen gyúlékony, szúrós szagú folyadék, vízben jól oldódik. Jellegzetes savanyú ízű, elektromos áramot vezet. Az ecetsav ipari felhasználása igen nagy.
Nál nél Az Oroszországban előállított ecetsav a legjobb világszabványok szintjén van, nagy a kereslet a világpiacon, és a világ számos országába exportálják.
Az ecetsav előállításának számos sajátos követelménye van, ezért olyan szakemberekre van szükség, akik széleskörű tapasztalattal rendelkeznek nemcsak az ipari automatizálás és folyamatirányítás területén, hanem tisztában vannak ezen iparág speciális követelményeivel is.
Felhasznált irodalom jegyzéke
1. Artemenko, Alekszandr Ivanovics. Útmutató a kémiához / A.I. Artemenko, I.V. Tikunova, V.A. Festett. - 2. kiadás, átdolgozva. és további - M.: Felsőiskola, 2002. - 367 p.
2. Akhmetov, Nail Sibgatovich. Általános és szervetlen kémia: Tankönyv tanulóknak. kémiai-technológiai szakember. egyetemek / Akhmetov N.S. - 4. kiadás / Rev. - M .: Higher School, 2002.-743 p.
3. Berezin, Borisz Dmitrijevics. Modern szerves kémia tantárgy: Proc. juttatás diákoknak. egyetemek, oktatás a kémiai-technológiai speciális / Berezin B.D., Berezin D.B.-M.: Felsőiskola, 2001.-768 p.
4. I. G. Bolesov, G. S. Zaiceva. Karbonsavak és származékaik (szintézis, reakcióképesség, felhasználás a szerves szintézisben). Módszertani anyagok a szerves kémia általános kurzusában. 5. szám. Moszkva 1997
5. Sommer K. Kémiai tudásgyűjtő. Per. német nyelven, 2. kiadás. – M.: Mir, 1985. – 294 p.
6. Karakhanov E.A. Szintézisgáz az olaj alternatívájaként. I. Fischer-Tropsch folyamat és oxoszintézis // Soros Educational Journal. 1997. No. 3. S. 69-74.
Továbbiak a kémiából:
- Vizsgálat: Kémiai módszerek a víz és a nitrogén összegének kinyerésére
- Összefoglalás: Folyamatos üzemű desztillációs egység 4,1 t/h aceton-etanol bináris keverék elválasztására
Tanfolyami projekt az OHT-ról
"Ipari módszer az ecetsav előállítására"
Bevezetés
Ecetsav (etánsav). egy szerves anyag, amelynek molekulaképlete CH 3COOH (rövidítve AcOH). Ez egy korlátozó gyenge egybázisú sav. Az ecetsav és észtereinek sóit nevezzük acetátok .
Ecet (ecetsav oldat) ősidők óta ismert fermentációs termékként. Az ókorban (Kr. e. 3. században) ecetet használtak fehér ólom előállításához. Jelenleg az ecetsavnak három fő felhasználási területe van: egyrészt egyes szerves szintézisek oldószereként, másrészt gyengén savas reagensként (a keletkező főtermékek kioltására stb.), végül harmadszor fontos származékok előállítására, mint pl. savklorid vagy ecetsav-anhidrid , valamint őt is amid Stb. Az acil-klorid és az ecetsavanhidrid fontos acilezőszerek, amelyeket gyakran használnak a szerves szintézisekben.
Az élelmiszeriparban (valamint a háztartási főzésben és sózásban) használt ecetsavas oldatoknak van neve ecet (3-15%) és ecet esszencia (70-80%). Abszolút ecetsavat (kb. 99,8%) nevezünk jég , mert fagyott állapotban jégre emlékeztető masszát képez.
Az ecetsav termelési mennyisége körülbelül 5 millió tonna/év, ennek körülbelül 50%-a Kolbe-módszerrel készül (lásd alább).
. Fizikokémiai tulajdonságok
A n.o. Az ecetsav színtelen, rendkívül szúrós szagú folyadék. Az alábbi táblázat összefoglalja az ecetsav fő fizikai állandóit.
M r , g/molp, g/cm 3Tmelt., ról ről STkip., ról ről SKrit. pointRes., J/mol*KDN ról ről , kJ/molrKan60.051.049216.75118.1321.6 ról ről C 5,79 MPa123,4-4874,761,372
Az ecetsav az oldószerek szempontjából környezetbarát, mert összetételében egy poláris csoport (-COOH) és egy nem poláris (-CH 3). Így vízben és néhány szerves oldószerben tökéletesen oldódik. Az "ecetsav-víz-szerves oldószer" típusú kettős és háromszoros azeotrópokat is képezi.
Az ecetsav gyenge szerves sav. Képes reagálni az aktív fémekkel hidrogén felszabadulásával:
Megfelelő reagensek hatására savszármazékokká alakul (fontos reakciók a szerves szintézisben):
a) savhalogenidekké
b) észterekké
c) amidokká
Visszaállítás etil-alkohollá:
És vegyen részt szubsztitúciós reakciókban a metilcsoportnál, amelyek közül a legfontosabb a Gel-Volhard-Zelinsky reakció, amelyet egy fontos aminosav - glicin - előállítására használnak:
Sőt, minden további helyettesítéssel a halogén induktív hatása miatt a sav erőssége nő. Így például a trifluor-ecetsav erőssége közel áll az ásványi savakhoz.
. Hogyan lehet eljutni
A legjövedelmezőbb és legnyilvánvalóbb kémiai módszerAz ecetsav előállítása a megfelelő aldehid oxidációját jelenti ( acetaldehid vagy ethanal ), amelyet viszont kétféle módon lehet elérni: hidratálás acetilén higany(II) sók jelenlétében (Chugaev-reakció), vagy oxidációval (dehidrogénezés) etilalkohol forró réz felett:
Maga az acetaldehid a légköri oxigén hatására könnyen oxidálódik, és lassan ecetsavvá alakul.
Az etanol Chugaev-reakcióval történő előállításának első módszere sok okból nem jövedelmező, beleértve a robbanásveszélyes acetilénnel végzett munkát, a termék mérgező higanysókkal való szennyeződését, nagy mennyiségű reaktort stb. A legelterjedtebb az etil-alkoholból történő kinyerés második módja (amelyet hatalmas mennyiségben állítanak elő és viszonylag olcsó).
A kapott acetaldehidet oxigénnel oxidálják katalizátor - mangán (II) sói - jelenlétében. Ezt a módszert vizsgáljuk meg a következőkben.
Korszerűbb a metanol katalitikus karbonilezésének módszere (Kolbe-módszer) a következő reakció szerint:
Ezzel a módszerrel a metanol 99%-os, a CO esetében pedig 90%-os hozam érhető el. Szén-monoxid buborékolásából áll 180°C hőmérsékleten és 200-700 atm nyomáson reagensek keverékén keresztül. A katalizátorok kobalt- vagy ródium-jodidok, valamint ritkábban irídiumvegyületek. A Ebben a pillanatban a világon termelt összes ecetsav mintegy 50%-át ezzel a módszerrel állítják elő.
Vannak még biokémiai módszerek(azaz cukrok fermentálásával) azonban ritkán használják őket, elsősorban alacsony termelékenységük és a keletkező termékkeverék szétválasztásának nehézsége miatt.
. A technológiai eljárás megválasztásának indoklása az etanol oxidáció módszerével
Ez a módszer számos pozitív tulajdonsággal rendelkezik, mint pl.
)Olcsó kiinduló reagensek
)Nagy teljesítményű
)Viszonylag alacsony energiaköltség (50-60 o TÓL TŐL)
)A kezdeti reagensek magas kitermelése
)Magas konverziós és folyamatszelektivitással
)Viszonylag könnyű elválasztás
A reakciót buborékoszlopban hajtjuk végre. Emelkedett hőmérséklet szükséges a peroxidok képződésének mellékreakciójának megakadályozásához (ami miatt robbanásveszélyes keverék képződhet). A felső hőmérsékleti határt az acetaldehid illékonysága határozza meg. Az ecetsav nemcsak reakciótermék, hanem oldószer is, ami nagyban leegyszerűsíti a folyamatot.
A folyamat fő technológiai mutatóit az alábbi táblázat foglalja össze:
. A folyamat technológiai sémája
Az alábbiakban egy egyszerűsített folyamatábra látható az ecetsav acetaldehid oxidációjával történő előállításához. A diagramon megadott jelöléseket táblázatokban foglaltuk össze.
A kezdeti keverék (I) belép a hőcserélőbe (1), ahol a reakcióhőmérsékletre (50-80 °C) melegszik. A melegítést gőz hevítésével (IX) végzik, amely ezután kondenzátum (X) formájában távozik a gyűrű alakú térből. Az aldehid utánpótlást centrifugálszivattyúk (5) állítják elő, és szelepek szabályozzák.
A felmelegített aldehid belép a tekercshűtőkkel felszerelt buborékoszlopba (2) (a reakció exoterm). Technikai oxigént (II) fújnak az oszlopba, megindul az aldehid oxidációja.
A keletkező termékeket gőz-folyadék keverék formájában az oszlop tetején ürítik ki, és belépnek az elosztóba (4), majd a reakciótömeg egy része az első desztillációs oszlopba (3), amelyet az illékony szennyeződések eltávolítására terveztek ( kipufogógázok - VII). Továbbá a reakciómassza (IV) többi része a második oszlopba kerül, ahol a keletkező ecetsavat (V) a fogyasztóhoz vagy a raktárba ürítik. Az etilidén-diacetátot tartalmazó áfa-maradékot (VI) szintén eltávolítjuk az oszlopról. Az el nem reagált acetaldehidet (VIII) visszavezetjük a buborékoszlopba, ezzel csökkentve az adott teljesítmény biztosításához kezdetben szükséges aldehid mennyiségét (megnövekedett nyersanyag-konverzió). .
A fő áramlatok és megnevezések táblázatai:
Települési rész
. Anyagmérleg készítése
Az anyagmérleg elkészítése a technológiai folyamatok számításának egyik fő pontja. Lényege a tömegmegmaradás törvényében rejlik (Érkezés-Eltávozás=0). Köszönhetően az egyenletek megfogalmazásának mat. egyensúly, különféle folyamatjelzőkkel (koncentrációk, tömegáramok stb.) működhet a folyamat optimalizálása érdekében.
El kell kezdenie a mérleg összeállítását egy egyszerűsített diagrammal, blokkok formájában. Mindegyik blokk tartalmazza a fő funkciót - keverést, oxidációt vagy elosztást. Ennél a folyamatnál a folyamatábra így fog kinézni (a folyamatok összetételét a fenti táblázat mutatja):
Így látható, hogy a technológiai séma négy fő blokkra oszlik:
1) Keverő egység.
)Oxidációs egység (közvetlenül maga a buborékoszlop).
)Elválasztó blokk (az első desztillációs oszlop, amelyből eltávolítják az illékony anyagokat, a kipufogógázokat).
)Az elválasztás blokkja és a reagálatlan nyersanyagok visszavezetése az első blokkba.
A második blokkban a tömegek újraelosztásra kerülnek a kémiai átalakulások miatt a fő reakció szerint:
CH 3CHO + 0,5O 2 = CH 3UNSD
És kettőre mellékhatások metil-acetát és etilidén-diacetát képződése:
CH 3CHO + 1,5O 2= CH 3SOOSH 3+ CO2 + H 2O
CH 3CHO + O 2= CH 3CH(OOCH 3)2+ H 2O
A termék adott termelékenysége, valamint az acetaldehid szelektivitása és konverziós foka alapján a szükséges etanolmennyiség az alapegyenlet segítségével számítható ki:
ahol N az első reaktorba való belépéshez szükséges eredeti acetaldehid móljainak száma; M a termék (ecetsav) moláris tömege; a és c a reaktáns és a termék sztöchiometrikus együtthatói,
Ezért az 1. blokknak 31,6265 kmol acetaldehidet kell kapnia. Meg kell jegyezni, hogy az acetaldehid tiszta (eredeti) és fordított (a negyedik blokk után) is bejut a recirkuláció révén. A tömegáram:
Kiszámoljuk a képződött melléktermékek mennyiségét is:
a) metil-acetát:
b) etilidén-diacetát:
Ahol 0,5 és 0,33 konverziós tényező (figyelembe véve a reakció sztöchiometriáját). Számítsa ki a reakcióhoz szükséges oxigén mennyiségét (figyelembe véve annak átalakulását, azaz nem teljes átalakulását):
A technikai oxigén kis mennyiségű nitrogént (2,5%) tartalmaz, amit figyelembe kell venni:
El nem reagált aldehid:
A keletkezett szén-dioxid mennyisége:
Kialakult a víz reakciók által:
Nem szabad megfeledkezni arról, hogy víz is jár az alapanyaggal.
Aldehid (atmoszférához):
Aldehid (a 4. blokkban):
Mivel a 4. blokkba áthaladó összes aldehid visszakerül az 1. blokkba, így most már kiszámítható az 1. blokkba keveréshez belépő friss aldehid mennyisége:
Valamint a szennyeződések (ecetsav és víz) mennyisége a friss aldehidben:
A teljes vízmennyiség (reakcióval és friss aldehiddel):
A reakció eredményeként ecetsav képződik, és friss aldehiddel bejutva:
A víz egy részét ecetsavval együtt eltávolítják (0,2 tömeg%):
A vízmérleget a következőképpen állítjuk össze: reakcióval keletkezik + friss aldehiddel - savval - a légkörbe = 0. Ezután:
A kényelem érdekében az összes számított értéket egy áramlási táblázatban és egy anyagmérleg-táblázatban foglaljuk össze.
*Megjegyzés #1: A metil-acetát forráspontja 57°C, és erősen illékony, ezért a kipufogógázokkal, pl. a harmadik blokkban (az első desztillációs oszlopban).
*2. megjegyzés: Azt is figyelembe kell venni, hogy az oszlopban állandó mennyiségű ecetsav (oldószerként) van, és az acetaldehidet újrahasznosítják.
Következtetés
savas aldehid etanol
Összefoglalva, meg kell jegyezni, hogy ez a módszer gyakorlatilag a fő módszer az ecetsav előállításában. A közelmúltban egyre inkább felváltja a Kolbe-módszer (metil-alkohol karboxilezése), amely a kiindulási reagensek nagyobb hozamát adja.
Ennek a módszernek vannak hátrányai is, mint például az el nem reagált acetaldehid és metil-acetát légkörbe jutása, magas vérnyomás melléktermékek képződése stb.
Ennek ellenére a világon előállított összes ecetsav mintegy 50%-át ilyen módon állítják elő, katalizátorként mangán(II)-acetátot használva. Általában ez a módszer az egyik legkényelmesebb és legelőnyösebb a technológia számára.
Az ecetsav az egyik legnépszerűbb és leghasználtabb nyersanyag, amelyre az élelmiszeriparban és a vegyiparban is nagy a kereslet.
Felhasznált irodalom jegyzéke
1) „Környezeti tényező ill környezet az ipari kémia fejlődésének ösztönzőjeként". Roger A. Sheldon
) "Szerves kémia". Morrison R., Boyd R. 1974
) „Reakciómechanizmusok a szerves kémiában”. Sykes P., 1991
) "A vegyipari és technológiai iparágak anyagmérlegének számításához szükséges megbízások és útmutatók gyűjteménye." MITHT, 2008
További irodalom:
5) "A kémiai technológia folyamatainak és berendezéseinek általános menete". Einstein V.G., Zakharov M.K., 1999
) "A fizikai és kémiai mennyiségek rövid referenciakönyve". Ravdel A.A., 1999
) „A vegyi-technológiai folyamatok sémái”. Nosov G.A., Vyshnepolsky V.I., Lapshenkov G.I., 2011
Hosszúság és távolság Tömeg Ömlesztett termékek és élelmiszerek térfogatának mértéke Terület Térfogat és mértékegységek receptek Hőmérséklet Nyomás, mechanikai igénybevétel, Young-modul Energia és munka Erő Erő Idő Lineáris sebesség Lapos szög Hőhatékonyság és üzemanyag-hatékonyság Számok Az információ mennyiségének mértékegységei Árfolyamok Női ruhák és cipők méretei Férfi ruhák és cipők méretei Szögsebesség és forgás frekvencia Gyorsulás Szöggyorsulás Sűrűség Fajlagos térfogat Tehetetlenségi nyomaték Erőnyomaték Nyomaték Fajlagos fűtőérték (tömegben) Energiasűrűség és a tüzelőanyag fajlagos fűtőértéke (térfogatban) Hőmérséklet különbség Hőtágulási együttható Hőellenállás Hővezetés Fajlagos hőkapacitás Energiaterhelés, hő sugárzási teljesítmény Hőáram-sűrűség Hőátbocsátási tényező Térfogatáramlás Tömegáram áramlási sebesség Moláris áramlási sebesség Tömegáram sűrűsége Moláris koncentráció Tömegkoncentráció az oldatban Dinamikus (abszolút) viszkozitás Kinematikai viszkozitás Felületi feszültség Gőzáteresztő képesség áteresztőképesség, páraáteresztési sebesség Hangszint Mikrofon érzékenység Hangnyomásszint (SPL) Fényerő Fényerősség Megvilágítás Felbontás számítógépes grafikában Frekvencia és hullámhossz optikai teljesítmény dioptriában és gyújtótávolságban Teljesítmény dioptriában és lencsenagyításban (×) Elektromos töltés Lineáris töltéssűrűség Felületi töltéssűrűség Töltési sűrűség Elektromosság Lineáris áramsűrűség Felületi áramsűrűség Elektromos térerősség Elektrosztatikus potenciál és feszültség Elektromos ellenállás Elektromos ellenállás Elektromos vezetőképesség Elektromos vezetőképesség Elektromos kapacitás Induktivitás Amerikai huzalmérő Szint dBm-ben (dBm vagy dBmW), dBV (dBV), wattban stb. Mágneses hajtóerő mértékegységei erősség Mágneses fluxus Mágneses indukció Ionizáló sugárzás elnyelt dózisteljesítménye Radioaktivitás. Radioaktív bomlás Sugárzás. Expozíciós dózis Sugárzás. Elnyelt dózis Tizedes előtagok Adatátvitel Tipográfia és képfeldolgozás Fa térfogategységei Moláris tömeg számítása D. I. Mengyelejev kémiai elemeinek periódusos rendszere
Kémiai formula
CH 3 COOH moláris tömege, ecetsav 60.05196 g/mol
12,0107+1,00794 3+12,0107+15,9994+15,9994+1,00794
A vegyületben lévő elemek tömegrészei
A moláris tömeg kalkulátor használata
- A kémiai képleteket kis- és nagybetűk között kell megadni
- Az indexek normál számként vannak megadva
- A középvonalon lévő pontot (szorzási jel), amelyet például a kristályos hidrátok képleteiben használnak, egy szabályos pont helyettesíti.
- Példa: CuSO₄ 5H2O helyett a konverter a CuSO4.5H2O írásmódot használja a könnyebb bevitel érdekében.
Moláris tömeg kalkulátor
anyajegy
Minden anyag atomokból és molekulákból áll. A kémiában fontos a reakcióba belépő és az abból eredő anyagok tömegének pontos mérése. Definíció szerint a mól egy anyag azon mennyisége, amely annyi szerkezeti elemet (atomot, molekulát, iont, elektront és egyéb részecskét vagy ezek csoportját) tartalmaz, ahány atom van egy 12 grammos 12 relatív atomtömegű szénizotópban. Ezt a számot konstansnak nevezzük, vagy az Avogadro szám egyenlő 6,02214129(27)×10²³ mol⁻¹.
Avogadro-szám N A = 6,02214129(27)×10²³ mol⁻¹
Más szóval, a mól egy anyagnak az a tömege, amely megegyezik az anyag atomjai és molekuláinak atomtömegeinek összegével, megszorozva az Avogadro-számmal. A mól az SI rendszer hét alapegységének egyike, és a mól jelöli. Mivel az egység neve és szimbóluma megegyezik, meg kell jegyezni, hogy a szimbólum nem ragozott, ellentétben az egység nevével, amely elutasítható szokásos szabályok Orosz nyelv. Definíció szerint egy mól tiszta szén-12 pontosan 12 gramm.
Moláris tömeg
A moláris tömeg egy anyag fizikai tulajdonsága, amelyet az adott anyag tömegének és az anyag mólokban mért mennyiségének arányában határoznak meg. Más szóval, ez egy mól anyag tömege. Az SI rendszerben a moláris tömeg mértékegysége kilogramm/mol (kg/mol). A vegyészek azonban hozzászoktak a kényelmesebb g/mol mértékegység használatához.
moláris tömeg = g/mol

Elemek és vegyületek moláris tömege
A vegyületek különböző atomokból álló anyagok, amelyek kémiailag kapcsolódnak egymáshoz. Például a következő anyagok, amelyek bármely háziasszony konyhájában megtalálhatók, kémiai vegyületek:
- só (nátrium-klorid) NaCl
- cukor (szacharóz) C₂2H22O1₁
- ecet (ecetsav oldat) CH₃COOH
A kémiai elemek moláris tömege gramm/molban numerikusan megegyezik az elem atomjainak atomtömeg-egységben (vagy daltonban) kifejezett tömegével. A vegyületek moláris tömege megegyezik a vegyületet alkotó elemek moláris tömegének összegével, figyelembe véve a vegyületben lévő atomok számát. Például a víz moláris tömege (H2O) körülbelül 2 × 2 + 16 = 18 g/mol.
Molekulatömeg

A molekulatömeg (a régi név a molekulatömeg) egy molekula tömege, amelyet a molekulát alkotó egyes atomok tömegének összegeként számítanak ki, megszorozva a molekulában lévő atomok számával. A molekulatömeg az mérettelen fizikai mennyiség, számszerűen egyenlő a moláris tömeggel. vagyis molekulatömeg méretben különbözik a moláris tömegtől. Bár a molekulatömeg dimenzió nélküli mennyiség, mégis van egy atomtömeg-egységnek (a.m.u.) vagy daltonnak (Da) nevezett mennyiség, és kb. egyenlő a tömeggel egy proton vagy neutron. Az atomtömeg mértékegysége számszerűen is 1 g/mol.
Hasonló cikkek
-
Angol - óra, idő
Mindenkinek, aki érdeklődik az angol tanulás iránt, furcsa elnevezésekkel kellett megküzdenie p. m. és a. m , és általában, ahol az időt említik, valamiért csak 12 órás formátumot használnak. Valószínűleg nekünk, akik élünk...
-
"Alkímia papíron": receptek
A Doodle Alchemy vagy az Alchemy papíron Androidra egy érdekes kirakós játék gyönyörű grafikával és effektusokkal. Tanuld meg játszani ezt a csodálatos játékot, és találd meg az elemek kombinációit, hogy befejezd az Alkímiát a papíron. A játék...
-
A játék összeomlik a Batman: Arkham Cityben?
Ha szembesül azzal a ténnyel, hogy a Batman: Arkham City lelassul, összeomlik, a Batman: Arkham City nem indul el, a Batman: Arkham City nem települ, nincsenek vezérlők a Batman: Arkham Cityben, nincs hang, felbukkannak a hibák fent, Batmanben:...
-
Hogyan válasszunk le egy személyt a játékgépekről Hogyan válasszunk le egy személyt a szerencsejátékról
A Rating Bookmakers a moszkvai Rehab Family klinika pszichoterapeutájával és a szerencsejáték-függőség kezelésének specialistájával, Roman Gerasimovval együtt nyomon követte a szerencsejátékosok útját a sportfogadásban - a függőség kialakulásától az orvoslátogatásig,...
-
Rebuses Szórakoztató rejtvények rejtvények rejtvények
A „Riddles Charades Rebuses” játék: a válasz a „REJTÁSOK” részre, 1. és 2. szint ● Nem egér, nem madár – az erdőben hancúroz, fákon él és diót rág. ● Három szem – három parancs, piros – a legveszélyesebb. 3. és 4. szint ● Két antenna...
-
A méregpénzek átvételének feltételei
MENNYI PÉNZ KERÜL A SBERBANK KÁRTYASZÁMLÁRA A fizetési tranzakciók fontos paraméterei a jóváírás feltételei és mértéke. Ezek a kritériumok elsősorban a választott fordítási módtól függenek. Milyen feltételekkel lehet pénzt utalni a számlák között
