უწყლო ძმარმჟავას ფორმულა. ქიმია: ძმარმჟავა, რეზიუმე
თემაზე:
« ძმარმჟავა»
შესრულებულია: _____________
______________________
შემოწმებულია:_____________
______________________
ვოლგოგრადი 2004 წ
შესავალი………………………………………………………….3
1. ძმარმჟავას აღმოჩენა………………………..5
2. ძმარმჟავას თვისებები………………………..13
3. ძმარმჟავას მიღება………………………19
4. ძმარმჟავას გამოყენება…………………….22
დასკვნა…………………………………………………………………………………………………………………
გამოყენებული ლიტერატურის სია………………………27
შესავალი
ძმარმჟავა, CH3COOH, უფერო აალებადი სითხე მძაფრი სუნით, წყალში ძალიან ხსნადი. აქვს დამახასიათებელი მომჟავო გემო, ატარებს ელექტროენერგიას.
ძმარმჟავა იყო ერთადერთი ცნობილი ძველი ბერძნებისთვის. აქედან მომდინარეობს მისი სახელი: „ოქსოსი“ - მჟავე, მჟავე გემო. ძმარმჟავა ორგანული მჟავების უმარტივესი სახეობაა, რომელიც მცენარეული და ცხოველური ცხიმების განუყოფელი ნაწილია. მცირე კონცენტრაციით ის იმყოფება საკვებსა და სასმელებში და მონაწილეობს მეტაბოლურ პროცესებში ნაყოფის მომწიფების დროს. ძმარმჟავა ხშირად გვხვდება მცენარეებში, ცხოველურ სეკრეციაში. ძმარმჟავას მარილებს და ეთერებს აცეტატები ეწოდება.
ძმარმჟავა სუსტია (ის მხოლოდ ნაწილობრივ იშლება წყალხსნარში). თუმცა, ვინაიდან მჟავე გარემო თრგუნავს მიკროორგანიზმების სასიცოცხლო აქტივობას, ძმარმჟავა გამოიყენება კონსერვისას. საკვები პროდუქტებიროგორიცაა მარინადები.
ძმარმჟავა მიიღება აცეტალდეჰიდის დაჟანგვით და სხვა მეთოდებით, საკვები ძმარმჟავა მიიღება ეთანოლის ძმარმჟავას დუღილით. იგი გამოიყენება სამკურნალო და არომატული ნივთიერებების მისაღებად, როგორც გამხსნელი (მაგალითად, ცელულოზის აცეტატის წარმოებაში), სუფრის ძმრის სახით სანელებლების, მარინადების და დაკონსერვებული საკვების წარმოებაში. ძმარმჟავა მონაწილეობს ცოცხალ ორგანიზმებში მეტაბოლურ პროცესებში. ეს არის ერთ-ერთი აქროლადი მჟავა, რომელიც გვხვდება თითქმის ყველა საკვებში, გემოთი მჟავე და ძმრის მთავარი ინგრედიენტი.
ამ სამუშაოს მიზანი: ძმარმჟავას თვისებების, წარმოებისა და გამოყენების შესწავლა.
Დავალებები ამ კვლევას:
1. გვიამბეთ ძმარმჟავას აღმოჩენის ისტორიის შესახებ
2. ძმარმჟავას თვისებების შესწავლა
3. აღწერეთ ძმარმჟავას წარმოების მეთოდები
4. გამოავლინეთ ძმარმჟავას გამოყენების თავისებურებები
1. ძმარმჟავას აღმოჩენა
ძმარმჟავას სტრუქტურა ქიმიკოსებისთვის საინტერესო იყო დიუმას მიერ ტრიქლოროძმარმჟავას აღმოჩენის შემდეგ, ვინაიდან ამ აღმოჩენამ დარტყმა მიაყენა ბერცელიუსის მაშინდელ დომინანტურ ელექტროქიმიურ თეორიას. ეს უკანასკნელი, ელემენტების ელექტროდადებითად და ელექტრონეგატიურად გადანაწილებით, არ ცნობდა ორგანულ ნივთიერებებში ჩანაცვლების შესაძლებლობას მათში ღრმა ცვლილების გარეშე. ქიმიური თვისებები წყალბადი (ელექტროდადებითი ელემენტი) ქლორით (ელექტროუარყოფითი ელემენტი), მაგრამ იმავდროულად, დიუმას დაკვირვებით (პარიზის აკადემიის „Comptes rendus“, 1839 წ.), აღმოჩნდა, რომ „ქლორის შეყვანა წყალბადის ნაცვლად არ ხდება. მთლიანად შეცვალოს მოლეკულის გარეგანი თვისებები ...", რატომ დიუმა და სვამს კითხვას "არის ელექტროქიმიური შეხედულებები და იდეები მარტივი სხეულების მოლეკულებს (ატომებს) პოლარობის შესახებ, ეფუძნება ისეთ ნათელ ფაქტებს, რომ ისინი შეიძლება ჩაითვალოს ობიექტებად. უპირობო რწმენის, თუ ისინი უნდა ჩაითვალოს ჰიპოთეზებად, მაშინ შეესაბამება თუ არა ეს ჰიპოთეზები ფაქტებს "... უნდა ვაღიაროთ, განაგრძობს ის, რომ სიტუაცია განსხვავებულია. არაორგანულ ქიმიაში ჩვენ ვხელმძღვანელობთ იზომორფიზმით, ა. ფაქტებზე დაფუძნებული თეორია, რომელიც, როგორც ცნობილია, ნაკლებად ეთანხმება ელექტროქიმიურ თეორიებს. ორგანულ ქიმიაში ჩანაცვლების თეორია ერთნაირ როლს ასრულებს... და შესაძლოა მომავალი გვიჩვენებს, რომ ორივე შეხედულება უფრო მჭიდროდ არის დაკავშირებული ერთმანეთთან. , რომ ისინი გამომდინარეობენ ერთიდაიგივე მიზეზებიდან და შეიძლება განზოგადდეს ერთი და იგივე სახელი. იმავდროულად, U. მჟავის ქლოროძმარმჟავად და ალდეჰიდის ქლორალდეჰიდად (ქლორალად) გადაქცევის საფუძველზე და იმის გათვალისწინებით, რომ ამ შემთხვევებში მთელი წყალბადი შეიძლება შეიცვალოს ქლორის თანაბარი მოცულობით, ძირითადი ქიმიური ბუნების შეცვლის გარეშე. ნივთიერება, შეგვიძლია დავასკვნათ, რომ ორგანულ ქიმიაში არის ტიპები, რომლებიც შენარჩუნებულია მაშინაც კი, როდესაც წყალბადის ნაცვლად ქლორის, ბრომისა და იოდის თანაბარი მოცულობების შეყვანა ხდება. და ეს ნიშნავს, რომ ჩანაცვლების თეორია ემყარება ფაქტებს და, უფრო მეტიც, ყველაზე ბრწყინვალე ორგანულ ქიმიაში. ” ამ ნაწყვეტის ციტირება შვედეთის აკადემიის ყოველწლიურ მოხსენებაში („Jahresbericht etc.“, ტ. 19, 1840, გვ. 370). ბერცელიუსი შენიშნავს: "დიუმამ მოამზადა ნაერთი, რომელსაც იგი აძლევს რაციონალურ ფორმულას C4Cl6O3 + H2O (ატომური წონა თანამედროვეა; ტრიქლოროძმარმჟავა განიხილება, როგორც ანჰიდრიდური ნაერთი წყალთან ერთად.); ამ დაკვირვებას ის ასახელებს faits les plus eclatants de la Chimie organique-ს შორის; ეს არის მისი ჩანაცვლების თეორიის საფუძველი. რაც, მისი აზრით, დაამხობს ელექტროქიმიურ თეორიებს... მაგრამ ამასობაში ირკვევა, რომ ოქსილის მჟავას ნაერთის არსებობისთვის მხოლოდ მისი ფორმულა ცოტა სხვანაირად უნდა დაწეროს. შესაბამისი ქლორიდით, C2Cl6 + C2O4H2, რომელიც რჩება შერწყმული ოქსილის მჟავასთან როგორც მჟავაში, ასევე მარილებში. ამიტომ საქმე გვაქვს ერთგვარ ნაერთთან, რომლის მრავალი მაგალითია ცნობილი; ბევრი ... როგორც მარტივ, ისე რთულ რადიკალებს აქვთ თვისება, რომ მათ ჟანგბადის შემცველ ნაწილს შეუძლია შევიდეს ფუძეებთან კომბინაციაში და დაკარგოს ისინი ქლორის შემცველ ნაწილთან კონტაქტის დაკარგვის გარეშე. ეს შეხედულება დიუმას არ წარმოუდგენია და არ დაუქვემდებარა ექსპერიმენტულ შემოწმებას, მაგრამ იმავდროულად, თუ ეს სიმართლეა, მაშინ ახალ სწავლებას, რომელიც, დიუმას აზრით, შეუთავსებელია აქამდე გაბატონებულ თეორიულ იდეებთან. ნიადაგი ამოაძვრინა მისი ფეხებიდან და უნდა ჩამოვარდეს. შემდეგ ზოგიერთი არაორგანული ნაერთები, მისი აზრით, ქლოროძმარმჟავას მსგავსი (მათ შორის, ბერცელიუსმა ასევე მოიყვანა ქრომის მჟავას ქლორიდი - CrO2Cl2, რომელიც მას თვლიდა პერქლორიუმის ქრომის ნაერთად ( დღემდე უცნობია) ქრომის ანჰიდრიდთან: 3CrO2Cl2 \u003d CrCl6 + 2CrO3), ბერცელიუსი აგრძელებს: „დიუმას ქლოროძმარმჟავა აშკარად მიეკუთვნება ნაერთების ამ კლასს; მასში ნახშირბადის რადიკალი შერწყმულია როგორც ჟანგბადთან, ასევე ქლორთან. ამიტომ ეს შეიძლება იყოს ოქსილის მჟავა, რომელშიც ჟანგბადის ნახევარი ჩანაცვლებულია ქლორით, ან ოქსილის მჟავას 1 ატომის (მოლეკულის) ნაერთი ნახშირბადის სესკიქლორიდის 1 ატომით (მოლეკულა) - C2Cl6. პირველი ვარაუდი არ შეიძლება იქნას მიღებული, რადგან ის აღიარებს ჟანგბადის 11/2 ატომის ქლორით ჩანაცვლების შესაძლებლობას (ბერცელიუსის მიხედვით, ოქსილის მჟავა იყო C2O3.). სამაგიეროდ, დიუმა იცავს მესამე აზრს, რომელიც სრულიად შეუთავსებელია ზემოთ მოცემულ ორთან, რომლის მიხედვითაც ქლორი ცვლის არა ჟანგბადს, არამედ ელექტროდადებით წყალბადს, წარმოქმნის ნახშირწყალბადს C4Cl6, რომელსაც აქვს რთული რადიკალის იგივე თვისებები, როგორც. C4H6 ან აცეტილს, და, სავარაუდოდ, შეუძლია 3 ჟანგბადის ატომით მჟავას მიცემა, თვისებებით იდენტური W.-სთან, მაგრამ, როგორც ჩანს შედარებიდან (მათი ფიზიკური თვისებების), ის სრულიად განსხვავდება მისგან. იმავე წელს ( "Jahresb.", 19, 1840, 558) ჟერარდის სტატიასთან დაკავშირებით ("Journ. f. pr. Ch.", XIV, 17): "ჟერარმა, მისი თქმით, გამოთქვა ახალი შეხედულება ალკოჰოლის, ეთერისა და მათი შემადგენლობის შესახებ. წარმოებულები; ეს ასეა: ქრომის, ჟანგბადისა და ქლორის ცნობილ ნაერთს აქვს ფორმულა = CrO2Cl2, ქლორი ცვლის მასში ჟანგბადის ატომს (ბერზელიუსი ნიშნავს ქრომის ანჰიდრიდის 1 ჟანგბადის ატომს - CrO3). U. მჟავა C4H6 + 3O შეიცავს ოქსილის მჟავას 2 ატომს (მოლეკულას), რომელთაგან ერთში ყველა ჟანგბადი ჩანაცვლებულია წყალბადით \u003d C2O3 + C2H6. და ფორმულების ასეთმა თამაშმა 37 გვერდი შეავსო. მაგრამ მომდევნო წელს დიუმამ, კიდევ უფრო განავითარა ტიპების იდეა, აღნიშნა, რომ U. და ტრიქლოროძმარმჟავას თვისებების იდენტურობაზე საუბრისას, ის გულისხმობდა მათი ქიმიური თვისებების იდენტურობას, ნათლად გამოხატული, მაგალითად, ტუტეების გავლენის ქვეშ მათი დაშლის ანალოგიით: C2H3O2K + KOH \u003d CH4 + K2CO8 და С2Cl3O2K + KOH \u003d CHCl3 + K2CO8, რადგან CH4 და CHCl3 ერთი და იგივე მექანიკური ტიპის წარმომადგენლები არიან. მეორეს მხრივ, ლიბიგმა და გრეჰემმა საჯაროდ ისაუბრეს ჩანაცვლების თეორიის საფუძველზე მიღწეული დიდი სიმარტივის შესახებ, როდესაც განიხილავდნენ ჩვეულებრივი ეთერის ქლორის წარმოებულებს და მალაგუტის და ბერცელიუსის მიერ მიღებულ ფორმულისა და U. მჟავის ეთერებს, რაც იძლევა ახალი ფაქტების ზეწოლაზე, მე-5 გამოცემაში. მის "Lehrbuch der Chemie"-ში (წინასიტყვაობა აღინიშნა 1842 წლის ნოემბერში), დაივიწყა ჟერარდის მკაცრი მიმოხილვა, შესაძლებელი გახდა შემდეგი დაწერა: "თუ გავიხსენებთ ძმარმჟავას ტრანსფორმაციას (დაშლის ტექსტში) ქლორის გავლენით. ქლოროქსალიუმის მჟავაში (ქლოროქსალიუმის მჟავა - ქლოროქსალსაურე - ბერცელიუსი უწოდებს ტრიქლოროძმარმჟავას ("Lehrbuch", მე-5 გამოცემა, გვ. 629), შემდეგ შესაძლებელია ძმარმჟავას შემადგენლობის სხვა შეხედულება (ძმარმჟავას ბერცელიუსის მიერ Acetylsaure ეწოდება), კერძოდ, ეს შეიძლება იყოს კომბინირებული ოქსილის მჟავა, რომელშიც შესატყვისი ჯგუფი (Paarling) არის C2H6, ისევე როგორც ქლოროოქსალიუმის მჟავას შესატყვისი ჯგუფი არის C2Cl6, და შემდეგ ქლორის მოქმედება ძმარმჟავაზე შედგებოდა მხოლოდ C2H6-ის C2Cl6-ად გადაქცევაში. ., თუმცა, სასარგებლოა ყურადღების მიქცევა ამის შესაძლებლობაზე“.
ამრიგად, ბერცელიუსს უნდა ეღიარებინა წყალბადის ქლორით ჩანაცვლების შესაძლებლობა ორიგინალური სხეულის ქიმიური ფუნქციის შეცვლის გარეშე, რომელშიც ჩანაცვლება ხდება. სხვა ნაერთების მიმართ მისი შეხედულებების გამოყენების გარეშე, მივმართავ კოლბის ნაშრომებს, რომელმაც აღმოაჩინა არაერთი ფაქტი ძმარმჟავას და შემდეგ სხვა შეზღუდულ მონოფუძე მჟავებზე, რომლებიც ჰარმონიაში იყო ბერცელიუსის (ჟერარდის) შეხედულებებთან. . კოლბის მუშაობის ამოსავალი წერტილი იყო კრისტალური ნივთიერების, CCl4SO2 შემადგენლობის შესწავლა, რომელიც ადრე მიიღეს ბერცელიუსმა და მარსმა CS2-ზე aqua regia-ს მოქმედებით და წარმოიქმნა კოლბის მიერ CS2-ზე სველი ქლორის მოქმედებით. კოლბის არაერთმა ტრანსფორმაციამ (იხ. Kolbe, "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph.", 54, 1845, 145).) აჩვენა, რომ ეს სხეული, თანამედროვე თვალსაზრისით, არის ტრიქლორმეთილსულფონური ქლორის ანჰიდრიდი. მჟავები, CCl4SO2 = CCl3.SO2Cl (კოლბემ მას უწოდა Schwefligsaures Kohlensuperchlorid), რომელსაც შეუძლია შესაბამისი მჟავის - CCl3.SO2 (OH) მარილების მიცემა ტუტეების ზემოქმედებით [კოლბე HO + C2Cl3S2O5 - Chlorfelmicsalenunterssch] (C2Cl3S2O5 - Chlorfelmicsalenunter) ზემოქმედებით. =2, Cl=71, C \u003d 12 და O \u003d 16; და, შესაბამისად, თანამედროვე ატომური წონის დროს, ეს არის C4Cl6S2O6H2.), რომელიც თუთიის გავლენის ქვეშ, პირველ რიგში ცვლის Cl-ის ერთ ატომს წყალბადით, წარმოქმნის მჟავას. CHCl2.SO2 (OH) [კოლბეს მიხედვით - wasserhaltige Chlorformylunterschwefelsaure (Berzelius (" Jahresb. "25, 1846, 91) შენიშნავს, რომ სწორია მივიჩნიოთ ის დითიონის მჟავის S2O5-ის კომბინაციად ქლოროფორმილთან, რატომ უწოდებს SO2 (OH)3-ს. Kohlensuperchlorur (C2Cl6) - Dithionaure (S2O5). ჰიდრატირებული წყალი, როგორც ყოველთვის, არ არის გათვალისწინებული ბერცელიუსის მიერ), და ჩვენ ვჭამთ და მეორეს, ვქმნით მჟავას CH2Cl.SO2 (OH) [კოლბეს მიხედვით - Chlorelaylunterschwefelsaure], და ბოლოს, რედუქციის დროს მიმდინარე ან კალიუმის ამალგამით (რეაქცია ცოტა ხნის წინ გამოიყენა Melsance-მა ტრიქლოროძმარმჟავას ძმარამდე დასაყვანად. მჟავა.) ცვლის წყალბადით და სამივე Cl ატომით, წარმოქმნის მეთილსულფონის მჟავას. CH3.SO2(OH) [კოლბეს მიხედვით - Methylunterschwefelsaure]. ამ ნაერთების ანალოგია ქლოროძმარმჟავებთან უნებურად გასაოცარი იყო; მართლაც, მაშინდელი ფორმულებით მიიღეს ორი პარალელური სერია, როგორც ჩანს შემდეგი ცხრილიდან: S2O5 H2O + C2H6.C2O3 ამას არ გამორჩენია კოლბე, რომელიც აღნიშნავს (I. გვ. 181): „გოგირდოვანი მჟავების გაერთიანებას. ზემოთ აღწერილი და უშუალოდ ქლოროკარბონის გოგირდმჟავაში (ზემოთ - H2O + C2Cl6. S2O5) უერთდება ქლოროოქსალიუმის მჟავას, რომელიც ასევე ცნობილია როგორც ქლოროძმარმჟავა. თხევადი ქლოროკარბონი - СCl (Сl=71, С=12; ახლა ვწერთ C2Cl4 - ეს არის ქლოროეთილენი). და ჩვენ შეგვიძლია ველოდოთ, რომ თუ იგი ერთდროულად დაექვემდებარა წყლის მოქმედებას, მაშინ, როგორც ბისმუტის ქლორიდი, ქლორის ანტიმონი და ა.შ., ფორმირების მომენტში, ის ჩაანაცვლებს ქლორს ჟანგბადით. გამოცდილებამ დაადასტურა ვარაუდი. ”შუქისა და ქლორის ზემოქმედებით C2Cl4-ზე, რომელიც წყლის ქვეშ იყო, კოლბმა ჰექსაქლორეთანთან ერთად მიიღო ტრიქლოროძმარმჟავა და გამოხატა ტრანსფორმაცია შემდეგნაირად: (რადგან C2Cl4 შეიძლება მიღებულ იქნას CCl4-დან მისი გავლის გზით. თბება) მილი და CCl4 წარმოიქმნება Cl2-ის CS2-ზე გაცხელების მოქმედებით, მაშინ კოლბის რეაქცია იყო ძმარმჟავას პირველი სინთეზი ელემენტებიდან. გადაწყვიტეთ, რადგან ქლორი მაშინვე აჟანგებს მას ძმარმჟავად სინათლეში "... ბერცელიუსის შეხედულება ქლოროძმარმჟავას "გასაოცრად (auf eine tiberraschende Weise) დასტურდება კომბინირებული გოგირდმჟავების თვისებების არსებობით და პარალელურობით და, როგორც ჩანს, me (ამბობს Kolbe I. გვ. 186), სცილდება ჰიპოთეზების სფეროს და იძენს ალბათობის მაღალ ხარისხს. თუ ქლოროძმარმჟავას (ქლორკოჰლენოქსალზაურს, როგორც ახლა კოლბე უწოდებს ქლოროძმარმჟავას) აქვს შემადგენლობა, კომპოზიციის მსგავსიქლოროკარბონის მჟავა, მაშინ მეთილის გოგირდმჟავაზე პასუხისმგებელი ძმარმჟავაც კომბინირებულ მჟავად უნდა მივიჩნიოთ და მივიჩნიოთ მეთილის ოქსილის მჟავად: C2H6.C2O3 (ეს არის ჟერარდის ადრე გამოთქმული შეხედულება). დაუჯერებელი არ არის, რომ მომავალში ჩვენ იძულებულნი ვიქნებით მივიღოთ კომბინირებული მჟავებისთვის იმ ორგანული მჟავების მნიშვნელოვანი რაოდენობა, რომლებშიც ამჟამად, ჩვენი ინფორმაციის შეზღუდვის გამო, ვიღებთ ჰიპოთეტურ რადიკალებს ... "" რაც შეეხება მოვლენებს. ჩანაცვლება ამ კომბინირებულ მჟავებში, შემდეგ ისინი იღებენ მარტივ ახსნას იმით, რომ სხვადასხვა, ალბათ იზომორფულ ნაერთებს შეუძლიათ შეცვალონ ერთმანეთი კომბინირებული ჯგუფების როლში (als Paarlinge, l. p. p. 187), მჟავე თვისებების მნიშვნელოვანი შეცვლის გარეშე. სხეული მათთან ერთად! "შემდეგი ექსპერიმენტული დადასტურება ჩვენ ამ მოსაზრებას ვპოულობთ ფრანკლენდის და კოლბის სტატიაში: "Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen" ("Ann. Chem. . n. Pharm.", 65, 1848, 288) იმ აზრზე დაყრდნობით, რომ სერიის ყველა მჟავა (CH2)2nO4 აგებულია მეთილოქსილის მჟავის მსგავსად (ახლა ვწერთ CnH2nO2 და მეთილოქსილის მჟავას ვუწოდებთ ძმარმჟავას). ისინი ამჩნევენ შემდეგს. ზოგადი: "თუ ფორმულა H2O + H2.C2O3 წარმოადგენს ჭიანჭველა მჟავის რაციონალური შემადგენლობის ნამდვილ გამოხატულებას, ანუ თუ იგი განიხილება როგორც ოქსილის მჟავა წყალბადის ერთ ეკვივალენტთან შერწყმული (გამოხატვა არ არის სწორი; H-ის ნაცვლად. ფრანკლენდი და კოლბი იყენებენ გადახაზულ ასოს, რომელიც უდრის 2 N-ს), შემდეგ ტრანსფორმაციას მაღალი ტემპერატურაამონიუმის ფორმატი წყალწყლიან ჰიდროციან მჟავად, რადგან ცნობილია და აღმოჩენილია დობერაინერის მიერ, რომ ამონიუმის ოქსალატი იშლება წყალში და ციანად გაცხელებისას. ჭიანჭველა მჟავაში შერწყმული წყალბადი რეაქციაში მონაწილეობს მხოლოდ იმით, რომ ციანთან შერწყმისას წარმოქმნის ჰიდროციანმჟავას: საპირისპირო განათლებაჭიანჭველა მჟავა ჰიდროციანმჟავადან ტუტეების გავლენით სხვა არაფერია, თუ არა წყალში გახსნილი ციანიდის ცნობილი ტრანსფორმაციის გამეორება ოქსილის მჟავად და ამიაკად, ერთადერთი განსხვავებით; რომ წარმოქმნის მომენტში ოქსილის მჟავა შერწყმულია ჰიდროციანმჟავას წყალბადთან. ”ის ფაქტი, რომ ბენზოლის ციანიდი (C6H5CN), მაგალითად, ფელინგის მიხედვით, არ გააჩნია მჟავე თვისებები და არ ქმნის პრუსიულ ლურჯს, კოლბის მიხედვით. და Frankland, იყოს პარალელურად ეთილის ქლორიდის უუნარობა AgNO3-თან რეაქციასთან, და Kolbe და Frankland ამტკიცებენ თავიანთ სისწორეს სინთეზით ნიტრილის მეთოდით (მათ მიიღეს ნიტრილები გოგირდმჟავების KCN-ით დისტილაციით (დიუმას და მალაგუტის მეთოდით Leblanc-ით) : R "SO3 (OH) + KCN \u003d R. CN + KHSO4) ძმარმჟავა, პროპიონური (იმდროინდელი მეთ-აცეტონი) და კაპრონის მჟავა. შემდეგ, მომდევნო წელს, კოლბმა დაქვემდებარება მონობაზური გაჯერებული მჟავების ტუტე მარილები. ელექტროლიზამდე და მისი სქემის მიხედვით, ამავე დროს, დაფიქსირდა ძმარმჟავას ელექტროლიზის დროს ეთანის, ნახშირმჟავას და წყალბადის წარმოქმნა: H2O+C2H6.C2O3=H2+, ხოლო ვალერინის მჟავას ელექტროლიზისას - ოქტანი. , ნახშირმჟავა და წყალბადი: H2O+C8H18.C2O3=H2+. თუმცა, შეუძლებელია არ შეამჩნიოთ, რომ კოლბი მოელოდა მეთილის (CH3) მიღებას წყალბადთან, ე.ი. ჭაობის გაზთან, ძმარმჟავას და ბუტილ C4H9-ს ვალერინის მჟავისგან, ასევე წყალბადთან, ანუ C4H10-თან (ის უწოდებს C4H9 ვალილს) მაგრამ ამ მოლოდინში უნდა დაინახოს დათმობა ჟერარდის ფორმულებზე, რომელმაც უკვე მიიღო მნიშვნელოვანი მოქალაქეობის უფლებები, რომელმაც მიატოვა ძმარმჟავას წინა შეხედულება და ჩათვალა არა C4H8O4-ისთვის, რომელიც ფორმულას, კრიოსკოპიული მონაცემებით ვიმსჯელებთ, რეალურად ფლობს. , მაგრამ C2H4O2-სთვის, როგორც ეს წერია ყველა თანამედროვე ქიმიის სახელმძღვანელოში.
კოლბის ნამუშევრებით, ძმარმჟავას და ამავდროულად ყველა სხვა ორგანული მჟავის სტრუქტურა საბოლოოდ გაირკვა და შემდგომი ქიმიკოსების როლი მხოლოდ დაყოფამდე შემცირდა - თეორიული მოსაზრებებისა და ჟერარდის ავტორიტეტის გამო, კოლბის ფორმულები ნახევრად. და სტრუქტურული შეხედულებების ენაზე თარგმნა, რის გამოც ფორმულა C2H6.C2O4H2 გადაიქცა CH3.CO(OH-ად).
2. ძმარმჟავას თვისებები
კარბოქსილის მჟავები- ორგანული ნაერთები, რომლებიც შეიცავს ერთ ან მეტ კარბოქსილის ჯგუფს - COOH, რომელიც დაკავშირებულია ნახშირწყალბადის რადიკალთან.
მჟავა თვისებებიკარბოქსილის მჟავები განპირობებულია ელექტრონის სიმკვრივის კარბონილის ჟანგბადის გადანაცვლებით და შედეგად O–H ბმის დამატებითი (ალკოჰოლებთან შედარებით) პოლარიზაციის გამო.
წყალხსნარში კარბოქსილის მჟავები იშლება იონებად:
მოლეკულური წონის მატებასთან ერთად, წყალში მჟავების ხსნადობა მცირდება.
კარბოქსილის ჯგუფების რაოდენობის მიხედვით მჟავები იყოფა ერთბაზიან (მონოკარბოქსილურ) და პოლიბაზურ (დიკარბოქსილის, ტრიკარბოქსილის და სხვ.).
ნახშირწყალბადის რადიკალის ბუნების მიხედვით განასხვავებენ გაჯერებულ, უჯერი და არომატულ მჟავებს.
მჟავების სისტემატური სახელები მოცემულია შესაბამისი ნახშირწყალბადის სახელით, სუფიქსის დამატებით. -ოვაიადა სიტყვები მჟავა. ხშირად გამოიყენება ტრივიალური სახელებიც.
ზოგიერთი გაჯერებული მონობაზის მჟავა
| ფორმულა | სახელი |
|
| სისტემატური | ტრივიალური |
|
| HCOOH | მეთანი | ფორმული |
| ეთანი | ძმარმჟავა | |
| პროპანი | პროპიონური | |
| ბუტანი | ცხიმიანი | |
| პენტანი | ვალერიანი | |
| ჰექსანი | კაპრონი | |
| პენტადეკანური | პალმიტური | |
| ჰეპტადეკანური | სტეარიული | |
კარბოქსილის მჟავები ძალიან რეაქტიულია. ისინი რეაგირებენ სხვადასხვა ნივთიერებებთან და ქმნიან სხვადასხვა ნაერთებს, რომელთა შორის დიდი მნიშვნელობა აქვს ფუნქციური წარმოებულები, ე.ი. კარბოქსილის ჯგუფში რეაქციების შედეგად მიღებული ნაერთები.
2.1 მარილის წარმოქმნა
ა) ლითონებთან ურთიერთობისას:
2RCOOH + Mg ® (RCOO) 2 მგ + H 2
ბ) ლითონის ჰიდროქსიდებთან რეაქციებში:
2RCOOH + NaOH ® RCOONa + H 2 O
კარბოქსილის მჟავების ნაცვლად, მათი მჟავა ჰალოიდები უფრო ხშირად გამოიყენება:
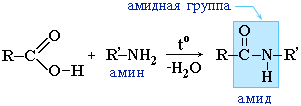 |
ამიდები ასევე წარმოიქმნება კარბოქსილის მჟავების (მათი ჰალოიდები ან ანჰიდრიდები) ურთიერთქმედებით ამიაკის ორგანულ წარმოებულებთან (ამინები):
ამიდები ბუნებაში მნიშვნელოვან როლს ასრულებენ. ბუნებრივი პეპტიდების და ცილების მოლეკულები აგებულია ა-ამინომჟავებისგან ამიდური ჯგუფების - პეპტიდური ბმების მონაწილეობით.
ძმარმჟავა (ეთანოინის მჟავა).
ფორმულა: CH 3 - COOH; გამჭვირვალე უფერო სითხე მძაფრი სუნით; დნობის წერტილის ქვემოთ (mp 16,6 გრადუსი C) ყინულის მსგავსი მასა (ამიტომ, კონცენტრირებულ ძმარმჟავას ასევე უწოდებენ მყინვარ ძმარმჟავას). ხსნადი წყალში, ეთანოლში.
ცხრილი 1. ძმარმჟავას ფიზიკური თვისებები
| სახელი | ფორმულა | ადუღება | გამოსავალი - | კა |
||||
| მჟავები | მისი მარილი |
|||||||
| ძმარმჟავა | ეთანი | აცეტატი | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
სინთეზური კვების კლასის ძმარმჟავა არის უფერო, გამჭვირვალე, აალებადი სითხე, ძლიერი ძმრის სუნით. სინთეზური საკვები კლასის ძმარმჟავა იწარმოება მეთანოლისა და ნახშირბადის მონოქსიდისგან როდიუმის კატალიზატორზე. სინთეზური საკვები ძმარმჟავა გამოიყენება ქიმიურ, ფარმაცევტულ და მსუბუქ მრეწველობაში, ასევე Კვების ინდუსტრიაროგორც კონსერვანტი. ფორმულა CH 3 COOH.
სინთეზური საკვები კლასის ძმარმჟავა ხელმისაწვდომია კონცენტრირებული (99.7%) და წყალხსნარის სახით (80%).
ფიზიკური და ქიმიური მაჩვენებლების მიხედვით, სინთეზური საკვები ძმარმჟავა უნდა შეესაბამებოდეს შემდეგ სტანდარტებს:
ცხრილი 2. ძირითადი ტექნიკური მოთხოვნები
| ინდიკატორის დასახელება | |
| 1. გარეგნობა | უფერო, გამჭვირვალე სითხე მექანიკური მინარევების გარეშე |
| 2. წყალში ხსნადობა | სრული, გამჭვირვალე ხსნარი |
| 3. ძმარმჟავას მასური ფრაქცია, %, არანაკლებ | 99,5 |
| 4. აცეტალდეჰიდის მასური ფრაქცია,%, არა მეტი | 0,004 |
| 5. ჭიანჭველა მჟავას მასური ფრაქცია, %, არა უმეტეს | 0,05 |
| 6. სულფატების მასური ფრაქცია (SO 4),%, არა უმეტეს | 0,0003 |
| 7. ქლორიდების მასური ფრაქცია (Cl),%, არა უმეტეს | 0,0004 |
| 8. წყალბადის სულფიდით (Pb) დალექილი მძიმე ლითონების მასური ფრაქცია, არა უმეტეს | 0,0004 |
| 9. რკინის მასური ფრაქცია (Fe),%, არა მეტი | 0,0004 |
| 10. არამდგრადი ნარჩენების მასური ფრაქცია,%, არა უმეტეს | 0,004 |
| 11. კალიუმის პერმანგანატის ხსნარის შეფერილობის სიმტკიცე, მინ, არანაკლებ | 60 |
| 12. კალიუმის დიქრომატით დაჟანგული ნივთიერებების მასური ფრაქცია, სმ 3 ნატრიუმის თიოსულფატის ხსნარი, კონცენტრაცია c (Na 2 SO 3 * 5H 2 O) \u003d 0.1 მოლი / დმ 3 (0.1H), არა უმეტეს | 5,0 |
სინთეზური საკვები ძმარმჟავა არის აალებადი სითხე, სხეულზე ზემოქმედების ხარისხის მიხედვით მიეკუთვნება მე-3 საშიშროების კლასის ნივთიერებებს. ძმარმჟავასთან მუშაობისას გამოიყენეთ ინდივიდუალური სახსრებიდაცვა (გაფილტრული გაზის ნიღბები). დამწვრობისას პირველადი დახმარება - წყლით უხვად რეცხვა.
სინთეზური საკვები ძმარმჟავა შეედინება სუფთა სარკინიგზო ავზებში, სატვირთო მანქანებით შიდა ზედაპირიუჟანგავი ფოლადიდან, უჟანგავი ფოლადის კონტეინერებში, კონტეინერებში და კასრებში 275 დმ3-მდე ტევადობით, ასევე მინის ბოთლებში და პოლიეთილენის კასრებში 50 დმ3-მდე ტევადობით. პოლიმერული კონტეინერი შესაფერისია ღრძილების და ძმარმჟავას შესანახად ერთი თვის განმავლობაში. სინთეზური საკვები კლასის ძმარმჟავა ინახება ჰერმეტულ უჟანგავი ფოლადის ავზებში. კონტეინერები, კონტეინერები, კასრები, ბოთლები და პოლიეთილენის კოლბები ინახება საწყობებში ან ტილოების ქვეშ. დაუშვებელია ერთობლივი შენახვა ძლიერ ჟანგვის აგენტებთან (აზოტმჟავა, გოგირდმჟავა, კალიუმის პერმანგანატი და სხვ.).
მისი ტრანსპორტირება ხდება უჟანგავი ფოლადის 12X18H10T ან 10X17H13M2T რკინიგზის ავზებით, ზედა გამონადენით.
3. ძმარმჟავას მიღება
ძმარმჟავა არის ყველაზე მნიშვნელოვანი ქიმიური პროდუქტი, რომელიც ფართოდ გამოიყენება მრეწველობაში ეთერების, მონომერების (ვინილის აცეტატი) წარმოებისთვის, კვების მრეწველობაში და ა.შ. მისი მსოფლიო წარმოება წელიწადში 5 მილიონ ტონას აღწევს. ბოლო დრომდე ძმარმჟავას წარმოება ეფუძნებოდა ნავთობქიმიურ ნედლეულს. უოკერის პროცესში, ეთილენი შედის რბილი პირობებიიჟანგება ატმოსფერული ჟანგბადით აცეტალდეჰიდამდე PdCl2 და CuCl2 კატალიზური სისტემის თანდასწრებით. გარდა ამისა, აცეტალდეჰიდი იჟანგება ძმარმჟავად:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
სხვა მეთოდის მიხედვით ძმარმჟავა მიიღება ნ-ბუტანის დაჟანგვით 200 C ტემპერატურაზე და 50 ატმ წნევაზე კობალტის კატალიზატორის თანდასწრებით.
მოხდენილი Walker პროცესი, ნავთობქიმიის განვითარების ერთ-ერთი სიმბოლო, თანდათან იცვლება ახალი მეთოდებით, რომლებიც დაფუძნებულია ქვანახშირის ნედლეულის გამოყენებაზე. შემუშავებულია მეთანოლისგან ძმარმჟავას წარმოების მეთოდები:
CH3OH + COCH3COOH
ეს რეაქცია, რომელსაც დიდი ინდუსტრიული მნიშვნელობა აქვს, ჰომოგენური კატალიზის წარმატების შესანიშნავი მაგალითია. ვინაიდან რეაქციის ორივე კომპონენტი - CH3OH და CO - მიიღება ქვანახშირისგან, კარბონილირების პროცესი უფრო ეკონომიური უნდა გახდეს ნავთობის ფასების მატებასთან ერთად. მეთანოლის კარბონილირების ორი სამრეწველო პროცესი არსებობს. BASF-ის მიერ შემუშავებული უფრო ძველი მეთოდი იყენებდა კობალტის კატალიზატორს, რეაქციის პირობები იყო მძიმე: ტემპერატურა 250°C და წნევა 500-700 ატმ. Monsanto-ს მიერ დაუფლებულმა სხვა პროცესმა გამოიყენა როდიუმის კატალიზატორი, რეაქცია განხორციელდა უფრო მეტზე დაბალი ტემპერატურა(150-200 C) და წნევა (1-40 ატმ). საინტერესოა ამ პროცესის აღმოჩენის ისტორია. კომპანიის მეცნიერებმა გამოიკვლიეს ჰიდროფორმილაცია როდიუმ ფოსფინის კატალიზატორების გამოყენებით. ნავთობქიმიური დეპარტამენტის ტექნიკურმა დირექტორმა შესთავაზა იგივე კატალიზატორის გამოყენება მეთანოლის კარბონილირებისთვის. ექსპერიმენტების შედეგები უარყოფითი იყო და ეს გამოწვეული იყო მეტალ-ნახშირბადის ბმის წარმოქმნის სირთულესთან. თუმცა, გაიხსენეს კომპანიის კონსულტანტის ლექცია ლითონის კომპლექსებში მეთილის იოდიდის ადვილად ჟანგვითი დამატების შესახებ, მკვლევარებმა გადაწყვიტეს დაემატებინათ იოდის პრომოტორი რეაქციის ნარევში და მიიღეს ბრწყინვალე შედეგი, რომელიც თავიდან არ დაიჯერეს. მსგავსი აღმოჩენა ასევე გააკეთეს კონკურენტი კომპანიის Union Carbide-ის მეცნიერებმა, რომლებიც მხოლოდ რამდენიმე თვით ჩამორჩნენ. მეთანოლის კარბონილირების ტექნოლოგიის განვითარების ჯგუფმა, მხოლოდ 5 თვიანი ინტენსიური მუშაობის შემდეგ, შექმნა Monsanto ინდუსტრიული პროცესი, რომლის დახმარებით 1970 წელს მიიღეს 150 ათასი ტონა ძმარმჟავა. ეს პროცესი გახდა მეცნიერების დარგის საწინდარი, რომელსაც ეწოდა C1-ქიმია.
კარბონილირების მექანიზმი ფართოდ იქნა გამოკვლეული. მეთილის იოდიდი, რომელიც აუცილებელია რეაქციისთვის, მიიღება განტოლებით
CH3OH + HI CH3I + H2O
კატალიზური ციკლი შეიძლება წარმოდგენილი იყოს შემდეგნაირად:
მეთილის იოდიდი ოქსიდაციურად ემატება კვადრატულ-გეგმარულ კომპლექსს - (I), რათა წარმოიქმნას ექვსკოორდინაციის კომპლექსი II, შემდეგ მეთილ-როდიუმის ბმის მეშვეობით CO-ს შეყვანის შედეგად წარმოიქმნება აცეტილროდიუმის კომპლექსი (III). ძმარმჟავას იოდიდის რედუქციული ელიმინაცია ახდენს კატალიზატორის რეგენერაციას, ხოლო იოდიდის ჰიდროლიზი იძლევა ძმარმჟავას.
ძმარმჟავას სამრეწველო სინთეზი:
ა) ბუტანის კატალიზური დაჟანგვა
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
ბ) ნახშირბადის მონოქსიდის (II) და მეთანოლის ნარევის გაცხელება კატალიზატორზე წნევის ქვეშ
CH3OH + COCH3COOH
ძმარმჟავას წარმოება დუღილით (ძმარმჟავას დუღილი).
ნედლეული: ეთანოლის შემცველი სითხეები (ღვინო, ფერმენტირებული წვენები), ჟანგბადი.
დამხმარე ნივთიერებები: ძმარმჟავას ბაქტერიების ფერმენტები.
Ქიმიური რეაქცია: ეთანოლი ბიოკატალიტიკურად იჟანგება ძმარმჟავად.
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
ძირითადი პროდუქტი: ძმარმჟავა.
4. ძმარმჟავას გამოყენება
ძმარმჟავა გამოიყენება სამკურნალო და არომატული ნივთიერებების მისაღებად, როგორც გამხსნელი (მაგალითად, ცელულოზის აცეტატის წარმოებაში), სუფრის ძმრის სახით სანელებლების, მარინადების და დაკონსერვებული საკვების წარმოებაში.
ძმარმჟავას წყალხსნარი გამოიყენება როგორც არომატიზატორი და კონსერვანტი (სანელებელი საკვებისთვის, სოკოს, ბოსტნეულის მწნილი).
ძმრის შემადგენლობაში შედის მჟავები, როგორიცაა ვაშლის, რძემჟავა, ასკორბინის, ძმარმჟავა.
ვაშლის სიდრი ძმარი (4% ძმარმჟავა)
ვაშლის სიდრი ძმარი შეიცავს 20 აუცილებელს მინერალებიდა კვალი ელემენტები, ასევე ძმარმჟავა, პროპიონური, ლაქტური და ლიმონმჟავა, რიგი ფერმენტები და ამინომჟავები, ღირებული დიეტური ბოჭკოები, როგორიცაა კალიუმი, პექტინი. ვაშლის სიდრი ძმარი ფართოდ გამოიყენება კულინარიაში და კონსერვაში. კარგად უხდება ყველა სახის სალათს, როგორც ახალი ბოსტნეულისგან, ასევე ხორცისა და თევზისგან. მისი გამოყენება შესაძლებელია ხორცის, კიტრის, კომბოსტოს, კაპერსის, პურსლანისა და ტრიუფელის დასამარინადებლად. თუმცა, დასავლეთში, ვაშლის სიდრი ძმარი ყველაზე ცნობილია თავისით სამკურნალო თვისებები. იგი გამოიყენება მაღალი სისხლის წნევაშაკიკი, ასთმა, თავის ტკივილი, ალკოჰოლიზმი, თავბრუსხვევა, ართრიტი, თირკმელების დაავადება, მაღალი სიცხე, დამწვრობა, წოლითი და ა.შ.
ჯანსაღი ხალხირეკომენდირებულია ყოველდღიურად გამოიყენოთ ჯანსაღი და გამაგრილებელი სასმელი: აურიეთ კოვზი თაფლი ერთ ჭიქა წყალში და დაამატეთ 1 ს/კ ვაშლის ძმარი. თუ გსურთ წონაში დაკლება, გირჩევთ, ყოველი ჭამის დროს დალიოთ ერთი ჭიქა უშაქრო წყალი ორი სუფრის კოვზი ვაშლის სიდრი ძმარით.
ძმარი ფართოდ გამოიყენება სახლის კონსერვაში სხვადასხვა სიმტკიცის მარინადების მოსამზადებლად. AT ხალხური მედიცინაძმარი გამოიყენება როგორც არასპეციფიკური სიცხის დამწევი საშუალება (კანის შეზელვით წყლისა და ძმრის ხსნარით 3: 1 თანაფარდობით), ასევე ლოსიონების გამოყენებით თავის ტკივილისთვის. ხშირია ძმრის გამოყენება მწერების ნაკბენისთვის კომპრესების საშუალებით.
ცნობილია ალკოჰოლური ძმრის გამოყენება კოსმეტოლოგიაში. კერძოდ, პერმისა და მუდმივი შეღებვის შემდეგ თმას მისცეს სირბილეს და ბზინვარებას. ამისათვის რეკომენდებულია თმის ჩამობანა თბილი წყლით ალკოჰოლური ძმრის დამატებით (3-4 სუფრის კოვზი ძმარი 1 ლიტრ წყალზე).
ყურძნის ძმარი (4% ძმარმჟავა)
ყურძნის ძმარს ფართოდ იყენებენ წამყვანი მზარეულები არა მხოლოდ სლოვენიაში, არამედ მთელ მსოფლიოში. სლოვენიაში მას ტრადიციულად იყენებენ სხვადასხვა ბოსტნეულის და სეზონური სალათების მოსამზადებლად (2-3 სუფრის კოვზი თითო სალათის თასში). კერძს უნიკალურ და დახვეწილ გემოს ანიჭებს. ყურძნის ძმარი ასევე კარგად უხდება თევზის სხვადასხვა სალათებს და ზღვის პროდუქტების კერძებს. ქაბაბების მომზადებისას სხვადასხვა სახის ხორცისგან, მაგრამ განსაკუთრებით ღორის ხორცისგან, ყურძნის ძმარი უბრალოდ შეუცვლელია.
ძმარმჟავა ასევე გამოიყენება წარმოებისთვის წამლები.
ასპირინის ტაბლეტები (ES) შეიცავს აქტიურ ინგრედიენტს აცეტილსალიცილის მჟავას, რომელიც წარმოადგენს ძმარმჟავას ეთერს. სალიცილის მჟავა.
აცეტილსალიცილის მჟავაწარმოებული სალიცილის მჟავას უწყლო ძმარმჟავასთან გაცხელებით მცირე რაოდენობით გოგირდმჟავას თანდასწრებით (როგორც კატალიზატორი).
წყალხსნარში ნატრიუმის ჰიდროქსიდით (NaOH) გაცხელებისას აცეტილსალიცილის მჟავა ჰიდროლიზდება ნატრიუმის სალიცილატამდე და ნატრიუმის აცეტატამდე. როდესაც გარემო მჟავდება, სალიცილის მჟავა ნალექი ხდება და მისი დნობის წერტილის მიხედვით (156-1600C) იდენტიფიცირება შესაძლებელია. ჰიდროლიზის დროს წარმოქმნილი სალიცილის მჟავის იდენტიფიცირების კიდევ ერთი მეთოდია მისი ხსნარის შეღებვა მუქი მეწამულ ფერში, როდესაც ემატება რკინის ქლორიდი (FeCl3). ფილტრატში არსებული ძმარმჟავა გარდაიქმნება ეთანოლთან და გოგირდმჟავასთან გაცხელებით ეტოქსიეთანოლად, რომელიც ადვილად ამოიცნობა დამახასიათებელი სუნით. გარდა ამისა, აცეტილსალიცილის მჟავის იდენტიფიცირება შესაძლებელია სხვადასხვა ქრომატოგრაფიული მეთოდების გამოყენებით.
აცეტილსალიცილის მჟავა კრისტალიზდება უფერო მონოკლინიკური პოლიედრების ან ნემსების წარმოქმნით, რომელთა გემო ოდნავ მჟავეა. ისინი მდგრადია მშრალ ჰაერში, მაგრამ თანდათან ჰიდროლიზდება სალიცილის მჟავამდე და ძმარმჟავამდე ტენიან გარემოში (Leeson and Mattocks, 1958; Stempel, 1961). სუფთა ნივთიერება არის თეთრი კრისტალური ფხვნილი, თითქმის უსუნო. ძმარმჟავას სუნი მიუთითებს იმაზე, რომ ნივთიერებამ დაიწყო ჰიდროლიზება. აცეტილსალიცილის მჟავა ექვემდებარება ესტერიფიკაციას ტუტე ჰიდროქსიდების, ტუტე ბიკარბონატების და ასევე მდუღარე წყალში.
აცეტილსალიცილის მჟავას აქვს ანთების საწინააღმდეგო, სიცხის დამწევი და ტკივილგამაყუჩებელი მოქმედება და ფართოდ გამოიყენება ცხელების, თავის ტკივილის, ნევრალგიის და ა.შ. და როგორც ანტირევმატული საშუალება.
ძმარმჟავა ასევე გამოიყენება ქიმიურ მრეწველობაში (ცელულოზის აცეტატის წარმოება, საიდანაც მიიღება აცეტატური ბოჭკოვანი, ორგანული მინა, ფირი; საღებავების, მედიკამენტების და ეთერების სინთეზისთვის), აალებადი ფილმების, პარფიუმერული პროდუქტების წარმოებაში, გამხსნელები, საღებავების სინთეზში, სამკურნალო ნივთიერებებიროგორიცაა ასპირინი. ძმარმჟავას მარილები გამოიყენება მცენარეთა მავნებლების გასაკონტროლებლად.
დასკვნა
ამ ნაშრომში განხილული იყო ძმარმჟავას აღმოჩენის საკითხები, მისი ძირითადი თვისებები, წარმოება და გამოყენება.
ასე რომ, ძმარმჟავა (CH3COOH), უფერო აალებადი სითხე მძაფრი სუნით, წყალში ძალიან ხსნადია. აქვს დამახასიათებელი მომჟავო გემო, ატარებს ელექტროენერგიას. ძმარმჟავას გამოყენება ინდუსტრიაში ძალიან დიდია.
ზერუსეთში წარმოებული ძმარმჟავა არის საუკეთესო მსოფლიო სტანდარტების დონეზე, დიდი მოთხოვნაა მსოფლიო ბაზარზე და ექსპორტირებულია მსოფლიოს მრავალ ქვეყანაში.
ძმარმჟავას წარმოებას აქვს მთელი რიგი საკუთარი სპეციფიკური მოთხოვნები, ამიტომ საჭიროა სპეციალისტები ფართო გამოცდილებით არა მხოლოდ სამრეწველო ავტომატიზაციისა და პროცესის კონტროლის სფეროში, არამედ ამ ინდუსტრიის განსაკუთრებული მოთხოვნების მკაფიო გაგებით.
გამოყენებული ლიტერატურის სია
1. არტემენკო, ალექსანდრე ივანოვიჩი. საცნობარო გზამკვლევი ქიმიაში / A.I. არტემენკო, ი.ვ. ტიკუნოვა, ვ.ა. მოხატული. - მე-2 გამოცემა, შესწორებული. და დამატებითი - მ .: უმაღლესი სკოლა, 2002. - 367გვ.
2. ახმეტოვი, ნაილ სიბგატოვიჩი. ზოგადი და არაორგანული ქიმია: სახელმძღვანელო სტუდენტებისთვის. ქიმიურ-ტექნოლოგიური სპეციალისტი. უნივერსიტეტები / ახმეტოვი N.S. - 4th ed. / Rev. - M .: უმაღლესი სკოლა, 2002.-743 გვ.
3. ბერეზინი, ბორის დიმიტრიევიჩი. თანამედროვე ორგანული ქიმიის კურსი: პროკ. შემწეობა სტუდენტებისთვის. უნივერსიტეტები, განათლება ქიმიურ-ტექნოლოგიურზე სპეციალური / Berezin B.D., Berezin D.B.-M.: უმაღლესი სკოლა, 2001.-768 გვ.
4. ი.გ.ბოლესოვი, გ.ს.ზაიცევა. კარბოქსილის მჟავები და მათი წარმოებულები (სინთეზი, რეაქტიულობა, გამოყენება ორგანულ სინთეზში). მეთოდური მასალებიორგანული ქიმიის ზოგად კურსში. გამოცემა 5. მოსკოვი 1997 წ
5. Sommer K. ცოდნის აკუმულატორი ქიმიაში. პერ. გერმანულთან ერთად, მე-2 გამოცემა. – მ.: მირი, 1985. – 294გვ.
6. კარახანოვი ე.ა. სინთეზური გაზი, როგორც ნავთობის ალტერნატივა. I. ფიშერ-ტროპშის პროცესი და ოქსოსინთეზი // სოროსის საგანმანათლებლო ჟურნალი. 1997. No 3. S. 69-74.
მეტი ქიმიიდან:
- გამოკვლევა: წყლისა და აზოტის ჯამის ამოღების ქიმიური მეთოდები
- რეზიუმე: უწყვეტი მოქმედების დისტილაციის ერთეული აცეტონი-ეთანოლის 4.1 ტ/სთ ორობითი ნარევის გამოყოფისთვის.
კურსის პროექტი OHT-ზე
"ძმარმჟავას წარმოების სამრეწველო მეთოდი"
შესავალი
ძმარმჟავა (ეთანოინის) მჟავა არის ორგანული ნივთიერება მოლეკულური ფორმულით CH 3COOH (შემოკლებით AcOH). ეს არის შემზღუდველი სუსტი მონობაზური მჟავა. ძმარმჟავას მარილებს და მის ეთერებს ე.წ აცეტატები .
ძმარი (ძმარმჟავას ხსნარი) უძველესი დროიდან ცნობილია, როგორც დუღილის პროდუქტი. ანტიკურ ხანაში (ძვ. წ. III ს.) ძმარს იყენებდნენ თეთრი ტყვიის მისაღებად. ამჟამად ძმარმჟავას აქვს სამი ძირითადი გამოყენება: პირველი, როგორც გამხსნელი ზოგიერთი ორგანული სინთეზისთვის, მეორეც, როგორც სუსტად მჟავე რეაგენტი (მიღებული ძირითადი პროდუქტების ჩაქრობისთვის და ა.შ.) და, ბოლოს, მესამე, ისეთი მნიშვნელოვანი წარმოებულების წარმოებისთვის, როგორიცაა მჟავა ქლორიდი ან ძმარმჟავას ანჰიდრიდი , ისევე როგორც მისი ამიდი Და ასე შემდეგ. აცილის ქლორიდი და ძმარმჟავას ანჰიდრიდი მნიშვნელოვანი აცილირების აგენტებია, რომლებიც ხშირად გამოიყენება ორგანულ სინთეზში.
ძმარმჟავას ხსნარებს, რომლებიც გამოიყენება კვების მრეწველობაში (ასევე საყოფაცხოვრებო სამზარეულოსა და მარილის წარმოებაში) აქვს სახელები ძმარი (3-15%) და ძმრის ესენცია (70-80%). აბსოლუტური ძმარმჟავა (დაახლოებით 99,8%) ე.წ ყინული , იმიტომ გაყინვისას ის ყინულის მსგავს მასას ქმნის.
ძმარმჟავას წარმოების მოცულობა არის დაახლოებით 5 მილიონი ტონა/წელიწადში, დაახლოებით 50% წარმოებულია კოლბის მეთოდით (იხ. ქვემოთ).
. ფიზიოქიმიური თვისებები
ნ.ო. ძმარმჟავა არის უფერო სითხე უკიდურესად მძაფრი სუნით. ქვემოთ მოყვანილი ცხრილი აჯამებს ძმარმჟავას ძირითად ფიზიკურ მუდმივებს.
მ რ , გ/მოლპ, გ/სმ 3დნება., შესახებ STkip., შესახებ SKrit. pointRes., J/mol*KDN შესახებ , kJ/molrKan60.051.049216.75118.1321.6 შესახებ C 5.79 MPa123.4-4874.761.372
ძმარმჟავა ამბიდენტურია გამხსნელების თვალსაზრისით, რადგან თავის შემადგენლობაში აქვს პოლარული ჯგუფი (-COOH) და არაპოლარული (-CH 3). ამდენად, ის შესანიშნავად იხსნება წყალში და ზოგიერთ ორგანულ გამხსნელებში. ის ასევე აყალიბებს ორმაგ და სამმაგ აზეოტროპებს „ძმარმჟავა-წყალი-ორგანული გამხსნელის“ ტიპის.
ძმარმჟავა სუსტია ორგანული მჟავა. მას შეუძლია რეაგირება აქტიურ ლითონებთან წყალბადის გამოყოფით:
გარდაიქმნება მჟავა წარმოებულებად შესაბამისი რეაგენტების მოქმედებით (მნიშვნელოვანი რეაქციები ორგანულ სინთეზში):
ა) მჟავა ჰალოიდებში
ბ) ეთერებში
გ) ამიდებად
აღდგენა ეთილის სპირტზე:
და ასევე შედით მეთილის ჯგუფში ჩანაცვლების რეაქციებში, რომელთაგან ყველაზე მნიშვნელოვანია გელ-ვოლჰარდ-ზელინსკის რეაქცია, რომელიც გამოიყენება მნიშვნელოვანი ამინომჟავის - გლიცინის მისაღებად:
უფრო მეტიც, ყოველი შემდგომი ჩანაცვლებით, ჰალოგენის ინდუქციური ეფექტის გამო, მჟავას სიძლიერე იზრდება. მაგალითად, ტრიფტორძმარმჟავა სიძლიერით ახლოს არის მინერალურ მჟავებთან.
. როგორ მივიღოთ
ყველაზე მომგებიანი და აშკარა ქიმიური მეთოდიძმარმჟავას მიღება ნიშნავს შესაბამისი ალდეჰიდის დაჟანგვას ( აცეტალდეჰიდი ან ეთანალი ), რომელიც, თავის მხრივ, მიიღება ორიდან ერთი გზით: დატენიანებით აცეტილენი ვერცხლისწყლის (II) მარილების თანდასწრებით (ჩუგაევის რეაქცია), ან დაჟანგვით (დეჰიდროგენაცია) ეთილის სპირტი ცხელ სპილენძზე:
თავად აცეტალდეჰიდი ადვილად იჟანგება ატმოსფერული ჟანგბადით და ნელ-ნელა იქცევა ძმარმჟავად.
ჩუგაევის რეაქციით ეთანოლის მიღების პირველი მეთოდი არ არის მომგებიანი მრავალი მიზეზის გამო, მათ შორის ასაფეთქებელ აცეტილენთან მუშაობა, პროდუქტის დაბინძურება ტოქსიკური ვერცხლისწყლის მარილებით, რეაქტორების დიდი მოცულობით და ა.შ. ყველაზე გავრცელებულია ეთილის სპირტიდან მიღების მეორე მეთოდი (რომელიც დიდი რაოდენობით იწარმოება და შედარებით იაფია).
შედეგად მიღებული აცეტალდეჰიდი იჟანგება ჟანგბადით კატალიზატორის - მანგანუმის მარილების (II) თანდასწრებით. სწორედ ეს მეთოდი იქნება განხილული შემდგომში.
უფრო თანამედროვეა მეთანოლის კატალიზური კარბონილირების მეთოდი (კოლბის მეთოდი) რეაქციის მიხედვით:
ეს მეთოდი შესაძლებელს ხდის მეთანოლისთვის 99% და CO CO 90%-ის მოსავლიანობის მიღწევას. იგი შედგება ნახშირბადის მონოქსიდის ბუშტუკებისგან 180°C ტემპერატურაზე და ზეწოლაში 200-700 ატმ რეაგენტების ნარევით. კატალიზატორებია კობალტის ან როდიუმის იოდიდები, ასევე, უფრო იშვიათად, ირიდიუმის ნაერთები. Ზე ამ მომენტშიამ მეთოდით მიიღება მსოფლიოში წარმოებული მთელი ძმარმჟავას დაახლოებით 50%.
ასევე არსებობს ბიოქიმიური მეთოდები(ე.ი. შაქრის დუღილით), თუმცა, ისინი იშვიათად გამოიყენება, ძირითადად მათი დაბალი პროდუქტიულობისა და პროდუქტების შედეგად მიღებული ნარევის გამოყოფის სირთულის გამო.
. ტექნოლოგიური პროცესის არჩევის დასაბუთება ეთანოლის დაჟანგვის მეთოდით
ეს მეთოდიაქვს მთელი რიგი დადებითი თვისებები, როგორიცაა:
)იაფი საწყისი რეაგენტები
)Მაღალი დონის შესრულება
)ენერგიის შედარებით დაბალი ხარჯები (50-60 o FROM)
)საწყისი რეაგენტების მაღალი მოსავლიანობა
)მაღალი კონვერტაცია და პროცესის სელექციურობა
)ნარევის შედარებით მარტივი გამოყოფა
რეაქცია ტარდება ბუშტის სვეტში. ამაღლებული ტემპერატურააუცილებელია პეროქსიდების წარმოქმნის გვერდითი რეაქციის თავიდან ასაცილებლად (რის გამოც შეიძლება წარმოიქმნას ფეთქებადი ნარევი). ტემპერატურული ზედა ზღვარი განისაზღვრება აცეტალდეჰიდის არასტაბილურობით. ძმარმჟავა არა მხოლოდ რეაქციის პროდუქტია, არამედ გამხსნელიც, რაც მნიშვნელოვნად ამარტივებს პროცესს.
პროცესის ძირითადი ტექნოლოგიური მაჩვენებლები შეჯამებულია ქვემოთ მოცემულ ცხრილში:
. პროცესის ტექნოლოგიური სქემა
ქვემოთ მოცემულია გამარტივებული ნაკადის დიაგრამა აცეტალდეჰიდის დაჟანგვით ძმარმჟავას წარმოებისთვის. დიაგრამაში მოცემული აღნიშვნები შეჯამებულია ცხრილებში.
საწყისი ნარევი (I) შედის სითბოს გადამცვლელში (1), სადაც თბება რეაქციის ტემპერატურამდე (50-80 °C). გათბობა ხორციელდება გაცხელებული ორთქლით (IX), რომელიც შემდეგ ამოღებულია რგოლოვანი სივრციდან კონდენსატის (X) სახით. ალდეჰიდის მიწოდება იწარმოება ცენტრიდანული ტუმბოებით (5) და რეგულირდება სარქველებით.
გახურებული ალდეჰიდი შედის ბუშტუკების სვეტში (2), რომელიც აღჭურვილია კოჭის გამაგრილებლებით (რეაქცია ეგზოთერმულია). ტექნიკური ჟანგბადი (II) იფეთქება სვეტში, იწყება ალდეჰიდის დაჟანგვა.
მიღებული პროდუქტები ორთქლის-თხევადი ნარევის სახით გამოიყოფა სვეტის ზედა ნაწილში და შედის დისტრიბუტორში (4), რის შემდეგაც რეაქციის მასის ნაწილი შედის დისტილაციის პირველ სვეტში (3), რომელიც შექმნილია აქროლადი მინარევების მოსაშორებლად ( გამონაბოლქვი აირები - VII). გარდა ამისა, დანარჩენი რეაქციის მასა (IV) შედის მეორე სვეტში, სადაც მიღებული ძმარმჟავა (V) იხსნება მომხმარებელს ან საწყობში. სვეტიდან ასევე ამოღებულია ეთილის დიცეტატის შემცველი დღგ-ის ნარჩენი (VI). არარეაგირებულ აცეტალდეჰიდს (VIII) უბრუნდება ბუშტუკების სვეტში, რითაც ამცირებს ალდეჰიდის რაოდენობას, რომელიც თავდაპირველად საჭიროა მოცემული შესრულების უზრუნველსაყოფად (გაზრდილი საკვების კონვერტაცია). .
ძირითადი ნაკადებისა და აღნიშვნების ცხრილები:
დასახლების ნაწილი
. მატერიალური ბალანსის შედგენა
მატერიალური ბალანსის შედგენა ერთ-ერთი მთავარი პუნქტია ტექნოლოგიური პროცესების გაანგარიშებისას. მისი არსი მდგომარეობს მასის შენარჩუნების კანონში (ჩამოსვლა-გამგზავრება=0). განტოლებების ფორმულირების წყალობით mat. ბალანსი, თქვენ შეგიძლიათ იმუშაოთ პროცესის სხვადასხვა ინდიკატორებით (კონცენტრაციები, მასის ნაკადები და ა.შ.) პროცესის ოპტიმიზაციისთვის.
თქვენ უნდა დაიწყოთ ბალანსის შედგენა გამარტივებული სქემით ბლოკების სახით. თითოეული ბლოკი მოიცავს მთავარ ფუნქციას - შერევას, დაჟანგვას ან განაწილებას. ამ პროცესისთვის, დიაგრამა ასე გამოიყურება (ნაკადების შემადგენლობა მითითებულია ზემოთ მოცემულ ცხრილში):
ამრიგად, ჩანს, რომ ტექნოლოგიური სქემა იყოფა ოთხ მთავარ ბლოკად:
1) შერევის ერთეული.
)ჟანგვის ერთეული (პირდაპირ ბუშტის სვეტი).
)გამყოფი ბლოკი (პირველი დისტილაციის სვეტი, საიდანაც ამოღებულია აქროლადი ნივთიერებები, გამონაბოლქვი აირები).
)გამოყოფის ბლოკი და ურეაქციო ნედლეულის პირველ ბლოკში დაბრუნება.
მეორე ბლოკში მასები გადანაწილებულია ქიმიური გარდაქმნების გამო ძირითადი რეაქციის მიხედვით:
CH 3CHO + 0.5O 2 = CH 3UNSD
და ორისთვის არასასურველი რეაქციებიმეთილის აცეტატის და ეთილიდენ დიაცეტატის წარმოქმნა, შესაბამისად:
CH 3CHO + 1.5O 2= CH 3SOOSH 3+ CO2 + H 2ო
CH 3CHO + O 2= CH 3CH(OOCH 3)2+ H 2ო
პროდუქტის მოცემული პროდუქტიულობის და აცეტალდეჰიდის შერჩევითობისა და კონვერტაციის ხარისხის საფუძველზე, ეთანალის საჭირო რაოდენობა შეიძლება გამოითვალოს ძირითადი განტოლების გამოყენებით:
სადაც N არის ორიგინალური აცეტალდეჰიდის მოლების რაოდენობა, რომელიც საჭიროა პირველ რეაქტორში შესასვლელად; M არის პროდუქტის მოლური მასა (ძმარმჟავა); a და c არის რეაქტანტისა და პროდუქტის სტოქიომეტრიული კოეფიციენტები,
ამიტომ, ბლოკმა 1 უნდა მიიღოს 31,6265 კმოლ აცეტალდეჰიდი. უნდა აღინიშნოს, რომ აცეტალდეჰიდი ხვდება როგორც სუფთა (ორიგინალი) ასევე საპირისპირო (მეოთხე ბლოკის შემდეგ) რეცირკულაციის გზით. მასობრივი ნაკადი არის:
ჩვენ ასევე ვიანგარიშებთ წარმოქმნილი ქვეპროდუქტების რაოდენობას:
ა) მეთილის აცეტატი:
ბ) ეთილიდენ დიაცეტატი:
სადაც 0,5 და 0,33 კონვერტაციის ფაქტორები (რეაქციის სტექიომეტრიის გათვალისწინებით). გამოთვალეთ რეაქციისთვის საჭირო ჟანგბადის რაოდენობა (მისი გარდაქმნის, ანუ არასრული გარდაქმნის გათვალისწინებით):
ტექნიკური ჟანგბადი შეიცავს მცირე რაოდენობით აზოტს (2,5%), რაც გასათვალისწინებელია:
ურეაქციო ალდეჰიდი:
წარმოებული ნახშირორჟანგის რაოდენობა:
წყალი ჩამოყალიბდა რეაქციებით:
გასათვალისწინებელია, რომ წყალი ასევე მოყვება საკვებს.
ალდეჰიდი (ატმოსფეროში):
ალდეჰიდი (მე-4 ბლოკში):
ვინაიდან მთელი ალდეჰიდი, რომელიც გადადის ბლოკ 4-ში, შემდეგ ბრუნდება ბლოკ 1-ში, ახლა უკვე შესაძლებელია გამოვთვალოთ ახალი ალდეჰიდის რაოდენობა, რომელიც შედის პირველ ბლოკში შერევისთვის:
ასევე მინარევების რაოდენობა (ძმარმჟავა და წყალი) ახალ ალდეჰიდში:
წყლის საერთო რაოდენობა (რეაქციით და სუფთა ალდეჰიდით) არის:
ძმარმჟავა წარმოიქმნება რეაქციის შედეგად და როდესაც ის შედის ახალ ალდეჰიდთან:
წყლის ნაწილი ამოღებულია ძმარმჟავასთან ერთად (წონის 0,2%):
წყლის ბალანსი შედგენილია შემდეგნაირად: წარმოიქმნება რეაქციით + ახალ ალდეჰიდთან - მჟავასთან - ატმოსფეროში = 0. შემდეგ:
მოხერხებულობისთვის, ყველა გამოთვლილი მნიშვნელობა შეჯამებულია ნაკადის ცხრილში და მატერიალური ბალანსის ცხრილში.
*შენიშვნა #1: მეთილის აცეტატს აქვს დუღილის წერტილი 57°C და არის ძალიან აქროლადი, ამიტომ იგი ამოღებულია გამონაბოლქვი აირებით ე.ი. მესამე ბლოკში (პირველი დისტილაციის სვეტი).
*შენიშვნა #2: გასათვალისწინებელია ისიც, რომ სვეტში არის ძმარმჟავას მუდმივი რაოდენობა (გამხსნელის სახით) და ხდება აცეტალდეჰიდის გადამუშავება.
დასკვნა
მჟავა ალდეჰიდის ეთანალი
დასასრულს, უნდა აღინიშნოს, რომ ეს მეთოდი პრაქტიკულად მთავარია ძმარმჟავას წარმოებაში. ბოლო დროს ის სულ უფრო მეტად შეიცვალა კოლბის მეთოდით (მეთილის სპირტის კარბოქსილაცია), რომელიც იძლევა საწყისი რეაგენტების უფრო მაღალ მოსავალს.
ამ მეთოდს ასევე აქვს უარყოფითი მხარეები, როგორიცაა, მაგალითად, ატმოსფეროში არარეაგირებული აცეტალდეჰიდის და მეთილის აცეტატის გამოყოფა, გამოყენება სისხლის მაღალი წნევაქვეპროდუქტების ფორმირება და სხვ.
მიუხედავად ამისა, მსოფლიოში წარმოებული მთელი ძმარმჟავას დაახლოებით 50% ამ გზით მიიღება მანგანუმის (II) აცეტატების, როგორც კატალიზატორის გამოყენებით. ზოგადად, ეს მეთოდი ერთ-ერთი ყველაზე მოსახერხებელი და ხელსაყრელია ტექნოლოგიისთვის.
ძმარმჟავა ერთ-ერთი ყველაზე პოპულარული და გამოყენებული ნედლეულია, ასევე დიდი მოთხოვნაა კვების და ქიმიურ მრეწველობაში.
გამოყენებული ლიტერატურის სია
1) „გარემოს ფაქტორი ან გარემოროგორც სამრეწველო ქიმიის ევოლუციის სტიმული“. როჯერ ა. შელდონი
) "Ორგანული ქიმია". Morrison R., Boyd R. 1974 წ
) „რეაქციის მექანიზმები ორგანულ ქიმიაში“. საიკს პ., 1991 წ
) „ქიმიური და ტექნოლოგიური მრეწველობის მატერიალური ბალანსის გამოთვლის დავალებებისა და მითითებების კრებული“. MITHT, 2008 წ
დამატებითი ლიტერატურა:
5) „ქიმიური ტექნოლოგიის პროცესებისა და აპარატების ზოგადი მიმდინარეობა“. Einstein V.G., Zakharov M.K., 1999 წ
) „ფიზიკურ და ქიმიურ რაოდენობათა მოკლე საცნობარო წიგნი“. Ravdel A.A., 1999 წ
) „ქიმიურ-ტექნოლოგიური პროცესების სქემები“. Nosov G.A., Vyshnepolsky V.I., Lapshenkov G.I., 2011 წ.
სიგრძე და მანძილი მასა ნაყარი პროდუქტებისა და საკვები პროდუქტების მოცულობის ზომები ფართობი მოცულობა და საზომი ერთეულები რეცეპტებიტემპერატურა წნევა, მექანიკური დატვირთვა, იანგის მოდული ენერგია და სამუშაო სიმძლავრე ძალა დრო ხაზოვანი სიჩქარე ბრტყელი კუთხე თერმული ეფექტურობა და საწვავის ეფექტურობა ნომრები ინფორმაციის მოცულობის საზომი ერთეულები გაცვლითი კურსი ქალის ტანსაცმლისა და ფეხსაცმლის ზომები მამაკაცის ტანსაცმლისა და ფეხსაცმლის ზომები კუთხური სიჩქარე და ბრუნვა სიხშირე აჩქარება კუთხური აჩქარება სიმკვრივე სპეციფიკური მოცულობა ინერციის მომენტი ძალის მომენტი ბრუნი სპეციფიკური კალორიულობა (მასით) ენერგიის სიმკვრივე და საწვავის სპეციფიკური კალორიულობა (მოცულობით) ტემპერატურის სხვაობა თერმული გაფართოების კოეფიციენტი თერმული წინააღმდეგობა თერმული კონდუქტომეტრული სპეციფიკური სითბოს სიმძლავრე ენერგიის ექსპოზიცია, თერმული რადიაციული სიმძლავრე სითბოს ნაკადის სიმკვრივე სითბოს გადაცემის კოეფიციენტი მოცულობითი ნაკადი მასის ნაკადის სიჩქარე მოლური ნაკადის სიჩქარე მასობრივი ნაკადის სიმკვრივე მოლური კონცენტრაცია მასის კონცენტრაცია ხსნარში დინამიური (აბსოლუტური) სიბლანტე კინემატიკური სიბლანტე ზედაპირული დაძაბულობა წყლის ორთქლის გამტარიანობა გამტარიანობა, ორთქლის გადაცემის სიჩქარე ხმის დონე მიკროფონის მგრძნობელობა ხმის წნევის დონე (SPL) სიკაშკაშე მანათობელი ინტენსივობა განათება გარჩევადობა კომპიუტერულ გრაფიკაში სიხშირე და ტალღის სიგრძე ოპტიკური სიმძლავრედიოპტრიებში და ფოკუსურ მანძილებში სიმძლავრე დიოპტრიებში და ლინზების გადიდება (×) ელექტრული მუხტი მუხტის ხაზოვანი სიმკვრივე ზედაპირული დამუხტვის სიმკვრივე მუხტის სიმკვრივე Ელექტროობახაზოვანი დენის სიმკვრივე ზედაპირის დენის სიმკვრივე ელექტრული ველის სიძლიერე ელექტროსტატიკური პოტენციალი და ძაბვა ელექტრული წინააღმდეგობა ელექტრული წინაღობა ელექტრული გამტარობა ელექტრული გამტარობა ელექტრული გამტარობა ელექტრული ტევადობა ინდუქციურობა ამერიკული მავთულის ლიანდაგი დონეები dBm (dBm ან dBmW, Magetic ველები (dBm ან dBmW, Magetic ველები) და ა.შ. სიძლიერე მაგნიტური ნაკადი მაგნიტური ინდუქცია მაიონებელი გამოსხივების შთანთქმის დოზის სიჩქარე რადიოაქტიურობა. რადიოაქტიური დაშლის რადიაცია. ექსპოზიციის დოზა რადიაცია. აბსორბირებული დოზა ათწილადი პრეფიქსები მონაცემთა გადაცემა ტიპოგრაფია და გამოსახულების დამუშავება ხე-ტყის მოცულობის ერთეულები მოლური მასის გამოთვლა დ.ი.მენდელეევის ქიმიური ელემენტების პერიოდული სისტემა
ქიმიური ფორმულა
CH 3 COOH, ძმარმჟავას მოლური მასა 60.05196 გ/მოლ
12.0107+1.00794 3+12.0107+15.9994+15.9994+1.00794
ელემენტების მასური ფრაქციები ნაერთში
მოლური მასის კალკულატორის გამოყენებით
- ქიმიური ფორმულები უნდა იყოს შეტანილი რეგისტრის მგრძნობიარე
- ინდექსები შეყვანილია როგორც ჩვეულებრივი რიცხვები
- წერტილი შუა ხაზზე (გამრავლების ნიშანი), რომელიც გამოიყენება, მაგალითად, კრისტალური ჰიდრატების ფორმულებში, იცვლება ჩვეულებრივი წერტილით.
- მაგალითი: CuSO4 5H2O-ის ნაცვლად, კონვერტორი იყენებს მართლწერას CuSO4.5H2O შეყვანის გასაადვილებლად.
მოლური მასის კალკულატორი
მოლი
ყველა ნივთიერება შედგება ატომებისა და მოლეკულებისგან. ქიმიაში მნიშვნელოვანია ზუსტად გავზომოთ რეაქციაში შემავალი და მისგან წარმოქმნილი ნივთიერებების მასა. განმარტებით, მოლი არის ნივთიერების რაოდენობა, რომელიც შეიცავს იმდენ სტრუქტურულ ელემენტს (ატომს, მოლეკულას, იონს, ელექტრონს და სხვა ნაწილაკებს ან მათ ჯგუფებს), რამდენი ატომია 12 გრამ ნახშირბადის იზოტოპში, რომლის ფარდობითი ატომური მასაა 12. ამ რიცხვს მუდმივი ეწოდება ან რიცხვი ავოგადრო უდრის 6,02214129(27)×10²3 mol-1.
ავოგადროს ნომერი N A = 6,02214129(27)×10²³ mol-1
სხვა სიტყვებით რომ ვთქვათ, მოლი არის ნივთიერების რაოდენობა, რომელიც ტოლია ნივთიერების ატომებისა და მოლეკულების ატომური მასების ჯამის, გამრავლებული ავოგადროს რიცხვზე. მოლი არის SI სისტემის შვიდი ძირითადი ერთეულიდან ერთ-ერთი და აღინიშნება მოლით. იმის გამო, რომ ერთეულის სახელი და მისი სიმბოლო ერთი და იგივეა, უნდა აღინიშნოს, რომ სიმბოლო არ არის დახრილი, განსხვავებით ერთეულის სახელისგან, რომლის უარყოფა შესაძლებელია შესაბამისად. ჩვეულებრივი წესებიᲠუსული ენა. განმარტებით, ერთი მოლი სუფთა ნახშირბად-12 არის ზუსტად 12 გრამი.
Მოლური მასა
მოლური მასა არის ნივთიერების ფიზიკური თვისება, რომელიც განისაზღვრება, როგორც ამ ნივთიერების მასის თანაფარდობა ნივთიერების რაოდენობასთან მოლში. სხვა სიტყვებით რომ ვთქვათ, ეს არის ნივთიერების ერთი მოლის მასა. SI სისტემაში მოლური მასის ერთეულია კილოგრამი/მოლი (კგ/მოლი). თუმცა, ქიმიკოსები მიჩვეულები არიან უფრო მოსახერხებელი ერთეულის გ/მოლი.
მოლური მასა = გ/მოლი

ელემენტებისა და ნაერთების მოლური მასა
ნაერთები არის ნივთიერებები, რომლებიც შედგება სხვადასხვა ატომებისგან, რომლებიც ქიმიურად არის დაკავშირებული ერთმანეთთან. მაგალითად, შემდეგი ნივთიერებები, რომლებიც გვხვდება ნებისმიერი დიასახლისის სამზარეულოში, არის ქიმიური ნაერთები:
- მარილი (ნატრიუმის ქლორიდი) NaCl
- შაქარი (საქაროზა) C12H22O11
- ძმარი (ძმარმჟავას ხსნარი) CH3COOH
ქიმიური ელემენტების მოლური მასა გრამებში თითო მოლზე რიცხობრივად იგივეა, რაც ელემენტის ატომების მასა გამოხატული ატომური მასის ერთეულებში (ან დალტონებში). ნაერთების მოლური მასა ნაერთის შემადგენელი ელემენტების მოლური მასების ჯამის ტოლია ნაერთში ატომების რაოდენობის გათვალისწინებით. მაგალითად, წყლის მოლური მასა (H2O) არის დაახლოებით 2 × 2 + 16 = 18 გ/მოლი.
მოლეკულური მასა

მოლეკულური წონა (ძველი სახელი მოლეკულური წონაა) არის მოლეკულის მასა, გამოითვლება როგორც თითოეული ატომის მასების ჯამი, რომელიც ქმნის მოლეკულას, გამრავლებული ამ მოლეკულის ატომების რაოდენობაზე. მოლეკულური წონა არის განზომილებიანი ფიზიკური რაოდენობარიცხობრივად ტოლია მოლური მასის. ანუ მოლეკულური მასაგანზომილებით განსხვავდება მოლური მასისგან. მიუხედავად იმისა, რომ მოლეკულური წონა არის განზომილებიანი სიდიდე, მას მაინც აქვს რაოდენობა, რომელსაც ეწოდება ატომური მასის ერთეული (a.m.u.) ან დალტონი (Da) და არის დაახლოებით. მასის ტოლიერთი პროტონი ან ნეიტრონი. ატომური მასის ერთეული ასევე რიცხობრივად უდრის 1 გ/მოლს.
მსგავსი სტატიები
-
ინგლისური - საათი, დრო
ყველას, ვისაც აინტერესებს ინგლისური ენის შესწავლა, მოუწია უცნაურ აღნიშვნებს გვ. მ. და ა. მ , და საერთოდ, სადაც დროა ნახსენები, რატომღაც მხოლოდ 12 საათიანი ფორმატი გამოიყენება. ალბათ ჩვენთვის მცხოვრები...
-
"ალქიმია ქაღალდზე": რეცეპტები
Doodle Alchemy ან Alchemy ქაღალდზე Android-ისთვის არის საინტერესო თავსატეხი ლამაზი გრაფიკით და ეფექტებით. ისწავლეთ როგორ ითამაშოთ ეს საოცარი თამაში და იპოვეთ ელემენტების კომბინაციები, რათა დაასრულოთ ალქიმია ქაღალდზე. Თამაში...
-
თამაშის ავარია Batman: Arkham City?
თუ თქვენ წინაშე აღმოჩნდებით, რომ Batman: Arkham City ანელებს, ავარია, Batman: Arkham City არ დაიწყება, Batman: Arkham City არ დაინსტალირდება, არ არის კონტროლი Batman: Arkham City, არ არის ხმა, გამოდის შეცდომები. ზევით, ბეტმენში:...
-
როგორ მოვიშოროთ ადამიანი სათამაშო აპარატებიდან როგორ მოვიშოროთ ადამიანი აზარტული თამაშებისგან
მოსკოვის Rehab Family კლინიკის ფსიქოთერაპევტთან და აზარტულ თამაშებზე დამოკიდებულების მკურნალობის სპეციალისტთან რომან გერასიმოვთან ერთად, რეიტინგის ბუკმეიკერებმა სპორტულ ფსონებში მოთამაშეს გზა გაუკვლიეს - დამოკიდებულების ჩამოყალიბებიდან ექიმთან ვიზიტამდე,...
-
Rebuses გასართობი თავსატეხები თავსატეხები გამოცანები
თამაში "RIDDLES Charades Rebuses": პასუხი განყოფილებაში "RIDDLES" დონე 1 და 2 ● არც თაგვი, არც ჩიტი - ის ხარობს ტყეში, ცხოვრობს ხეებზე და ღრღნის თხილს. ● სამი თვალი - სამი ბრძანება, წითელი - ყველაზე საშიში. დონე 3 და 4 ● ორი ანტენა თითო...
-
შხამისთვის თანხების მიღების პირობები
რამდენი თანხა მიდის SBERBANK-ის ბარათის ანგარიშზე გადახდის ოპერაციების მნიშვნელოვანი პარამეტრებია სახსრების დაკრედიტების პირობები და ტარიფები. ეს კრიტერიუმები, პირველ რიგში, დამოკიდებულია თარგმანის არჩეულ მეთოდზე. რა პირობებია ანგარიშებს შორის თანხის გადარიცხვისთვის
