Agua con ácido acético. Aplicaciones del ácido acético
Nombre:
ácido acético(ácido etanoico) es un ácido carboxílico monobásico de la serie alifática.
Fórmula química:
Historial de descubrimiento:
El ácido acético se conoce desde la antigüedad, ya que se forma durante el amargor de los vinos (vinagre de vino).
Pero los científicos se interesaron por la estructura del ácido acético y la causa de su aparición sólo después de la sensacional publicación de Dumas de la regla empírica para la sustitución del hidrógeno en los compuestos orgánicos por cloro. Hasta entonces, la química había estado dominada por la teoría propuesta por Jens Jakob Berzelius. Clasificó los elementos en electropositivos y electronegativos, y negó por completo las sustituciones de hidrógeno y cloro, respectivamente, sin cambiar estructura química sustancias.
En su obra de 1839, Dumas presentó un informe para la Academia Sueca en el que consagraba los principios iniciales de la regla empírica que formuló para las sustancias orgánicas, y para el ácido acético en particular: “En química inorgánica, nuestro hilo conductor es el isomorfismo, una teoría basado en hechos, como Es bien sabido que pocos están de acuerdo con las teorías electroquímicas. En química orgánica, la teoría de la sustitución desempeña el mismo papel... y tal vez el futuro muestre que ambos puntos de vista están más estrechamente relacionados entre sí, que surgen de las mismas causas y pueden generalizarse bajo el mismo nombre”.
Llevaba varios años llegando a esta conclusión. Dumas inició sus primeros experimentos con el estudio del ácido acético y su transformación en ácido cloroacético. El hidrógeno en esta reacción se reemplaza completamente por cloro, en una proporción de 1:1 y, lo más importante, sin pérdida de compuestos básicos. propiedades quimicas y la relación de sustancia con clase. Otros experimentos con la sustitución del hidrógeno por yodo y bromo finalmente convencieron al científico de esto.
La conclusión sobre la diferencia fundamental en la formación de compuestos orgánicos e inorgánicos resultó revolucionaria.
Sin embargo, Berzelius, defendiendo su teoría, pone el ejemplo del ácido oxálico, y la sal resultante cuando se combina con cloruro, lo que supone la pérdida de propiedades ácidas. Utilizando el ejemplo de compuestos orgánicos e inorgánicos, afirma que su parte que contiene oxígeno puede reaccionar con las bases y verse privada de ellas sin perder contacto con la parte que contiene cloro. Este aspecto, según el químico, es la principal omisión de Dumas en sus experimentos, porque No negó ni confirmó este hecho conocido.
Para explicar de alguna manera los resultados obtenidos por Dumas, Berzelius plantea la hipótesis: “Dumas ácido cloroacético,
obviamente pertenece a esta clase de compuestos; en él el radical de carbono está conectado
con oxígeno y cloro. Por tanto, puede tratarse de ácido oxálico, en
en el que la mitad del oxígeno se reemplaza por cloro, o un compuesto de 1 átomo
(moléculas) de ácido oxálico con 1 átomo (molécula) de sesquicloruro de carbono
C2Cl6. El primer supuesto no puede aceptarse porque permite
posibilidad de sustituir el cloro 11/2, átomos de oxígeno (según Berzelius, oxálico
el ácido era C2O3). Dumas se adhiere completamente a la tercera idea.
incompatible con los dos anteriores, según el cual el cloro no reemplaza al oxígeno, sino
hidrógeno electropositivo, formando el hidrocarburo C4Cl6, que tiene el mismo
propiedades de un radical complejo, como C4H6 o acetilo, y supuestamente capaz de 3
átomos de oxígeno para producir un ácido idéntico en propiedades al uranio, pero, como puede verse
por comparación (de sus propiedades físicas), completamente diferente de ella"
Pero las semillas plantadas por Dumas germinaron. Ahora muchos científicos, alejándose de la teoría de Berzelius, continuaron innovando. Así, Charles Frederic Gerard, por primera vez, contrariamente a la teoría de los radicales (cuyo creador y partidario fue Berzelius), estableció que los radicales no existen de forma independiente, sino que son grupos atómicos, "residuos", cuya combinación forma un molécula. En su ensayo "Sobre la basicidad de los ácidos" de 1851, desarrolló una teoría de tipos, según la cual todos los compuestos químicos pueden clasificarse como derivados de cuatro tipos: hidrógeno, cloruro de hidrógeno, agua y amoníaco. En particular, surgió una idea sobre la similitud de la constitución del ácido tricloroacético y del ácido acético. En su defensa, Berzelius replica: “Gerard expresó una nueva visión sobre la composición del alcohol, el éter y sus
derivados; es el siguiente: un conocido compuesto de cromo, oxígeno y cloro tiene
fórmula = CrO2Cl2, el cloro reemplaza el átomo de oxígeno que contiene (Implica
Berzelius 1 átomo de oxígeno de anhídrido crómico - CrO3). U. ácido C4H6+3O
contiene 2 átomos (moléculas) de ácido oxálico, de los cuales todos en uno
oxígeno reemplazado por hidrógeno = C2O3+C2H6.” Pero tal juego con números no mantuvo la autoridad de la teoría, y un año después, Dumas asestó un golpe demoledor al desarrollar la teoría de los tipos, explorando las propiedades similares del ácido tricloroacético y el ácido acético en la reacción de descomposición bajo la influencia de álcalis. .
Por otro lado, Liebig y Graham se pronunciaron públicamente a favor de
mayor simplicidad lograda sobre la base de la teoría de la sustitución al considerar
Se obtienen cloroderivados de éter ordinario y ésteres de ácido fórmico y de uranio.
Malaguti.
Berzelius, cediendo a la presión de nuevos hechos, en la 5ª ed. su
"Lehrbuch der Chemie" (Prefacio marcado en noviembre de 1842), en la página 709,
Habiendo olvidado mi dura crítica sobre Gerard, me fue posible escribir lo siguiente: “Si
Recordemos la transformación (descomposición en el texto) del ácido U. bajo la influencia del cloro en
ácido clorooxálico (Chloroxalsaure - Berzelius llama
ácido tricloroacético , entonces parece
Es posible otra visión sobre la composición del ácido úrico, es decir, puede ser un ácido oxálico combinado, en el que el grupo combinado (Paarling) es C2H6, al igual que el grupo combinado en el ácido clorooxálico es C2Cl6, y luego el efecto de el cloro sobre el ácido úrico consistiría únicamente en la conversión de C2H6 en C2Cl6. Está claro que es imposible decidir si tal representación es más correcta... sin embargo, es útil prestar atención a la posibilidad de ello”.
Pero todo llegó al regimiento de partidarios de la teoría de tipos. El punto de partida del trabajo de Kolbe fue el estudio de una sustancia cristalina, la composición CCl4SO2, previamente obtenida por Berzelius y Marsay por la acción del agua regia sobre el CS2 y formada por Kolbe por la acción del cloro húmedo sobre el CS2. A través de una serie de transformaciones, Kolbe demostró que esto
el cuerpo es, en términos modernos, anhídrido de cloro
ácido triclorometilsulfónico, CCl4SO2 = CCl3.SO2Cl capaz, bajo la influencia de álcalis, de dar sales del ácido correspondiente - CCl3.SO2(OH), que, bajo la influencia del zinc, reemplaza primero un átomo de Cl por hidrógeno, formando el ácido. CHCl2.SO2(OH) Agua de hidratación, como es habitual, no aceptada por Berzelius
en cuenta.), y luego otro, formando el ácido CH2Cl.SO2(OH) [según Kolbe -
Chloreylunterschwefelsaure] y, finalmente, cuando se restablece mediante corriente eléctrica o potasio.
amalgama (la reacción había sido utilizada recientemente por Melsans para
reducción del ácido tricloroacético a ácido acético.) se reemplaza con hidrógeno y los tres
Átomo de Cl, formando ácido metilsulfónico. CH3.SO2(OH) [según Kolbe -
Metilunterschwefelsaure].
Analogía de estos compuestos con los ácidos cloroacéticos.
involuntariamente me llamó la atención; de hecho, con las fórmulas de esa época obtuvimos dos
filas paralelas, como se puede observar en la siguiente tabla: H2O+C2Cl6.S2O5
H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5
H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Esto no se le escapó a Kolbe,
quien señala (I. p. 181): “a los compuestos sulfurosos combinados descritos anteriormente
ácidos y directamente en clorocarbono-ácido sulfuroso (arriba -
H2O+C2Cl6.S2O5) está adyacente al ácido clorooxálico, también conocido como
ácido cloroacético. Clorocarbono líquido - CCl (Cl = 71, C = 12; ahora escribimos
C2Cl4 es cloroetileno), como se sabe, se transforma en luz bajo la influencia
cloro en - hexacloroetano y se puede esperar que si se expone simultáneamente al agua, entonces, como el cloruro de bismuto, el cloruro de antimonio, etc., en el momento de la formación, reemplazará el cloro con oxígeno. La experiencia confirmó la suposición." Bajo la influencia de la luz y
Kolbe obtuvo cloro en C2Cl4, que estaba bajo agua, junto con hexacloroetano.
y ácido tricloroacético y expresó la transformación con la siguiente ecuación: (Desde C2Cl4
se puede obtener a partir de CCl4 pasándolo a través de un tubo calentado, y CCl4
se forma por la acción, al calentar, de Cl2 sobre CS2, luego se realizó la reacción de Kolbe.
la primera síntesis de ácido U. a partir de elementos). “¿Se forma al mismo tiempo?
y ácido oxálico libre, es difícil decidir, ya que en la luz el cloro inmediatamente
lo oxida en ácido U. "...
La opinión de Berzelius sobre el ácido cloroacético
"Sorprendentemente (auf eine tiberraschende Weise) se confirma
la existencia y el paralelismo de las propiedades de los ácidos sulfurosos combinados y, como dije
parece (dice Kolbe I. p. 186) abandonar el reino de las hipótesis y
adquiere un alto grado de probabilidad.
Su previsión sobre futuros descubrimientos de la naturaleza. ácidos orgánicos lo confirma un artículo en el que, basándose en experimentos, escribe: “No
Es increíble que en el futuro nos veamos obligados a confundirnos con ácidos combinados.
un número significativo de aquellos ácidos orgánicos en los que actualmente, debido a
limitaciones de nuestra información - aceptamos radicales hipotéticos...".
También se caracteriza por la teoría de los radicales, confirmando lo ya dicho anteriormente, y añade: “En cuanto a los fenómenos de sustitución en estos ácidos combinados, reciben una explicación simple en el hecho de que varios compuestos, probablemente isomórficos, son capaces de ¡reemplazándose entre sí en el papel de combinar grupos sin cambiar significativamente las propiedades ácidas del cuerpo combinado con ellos!
Encontramos una confirmación experimental adicional de esta opinión en el artículo de Frankland y Kolbe: “Basado en la idea de que todos los ácidos de la serie
(CH2)2nO4, están construidos como el ácido metil oxálico (ahora escribimos CnH2nO2 y
Al ácido metil oxálico lo llamamos ácido acético. combinado en
En el ácido fórmico, el hidrógeno participa en la reacción solo porque se combina con
cianógeno, forma ácido cianhídrico: Educación inversaácido fórmico de
El cianhídrico bajo la influencia de álcalis no es más que una repetición.
conocida transformación del cianógeno disuelto en agua en ácido oxálico y amoníaco,
con esta única diferencia; que en el momento de la formación el ácido oxálico se combina con
cianuro de hidrógeno."
El hecho de que el cianuro de benceno (C6H5CN), según Fehling, por ejemplo, no tenga propiedades ácidas y no forme azul de Prusia, puede, según Kolbe y Fankland, compararse con la incapacidad del cloruro de etilo para reaccionar con AgNO3. y la exactitud de su inducción Kolbe y
Frankland está probado por síntesis utilizando el método del nitrilo (produjeron nitrilos
por destilación de ácidos sulfúricos con KCN (método de Dumas y Malagutti con Leblanc):
R".SO3(OH)+KCN=R.CN+KHSO4)U., propiónico (en ese momento, meta-acetona) y
ácido caproico.
Luego, al año siguiente, Kolbe electrolizó
sales de ácidos monobásicos saturados y, de acuerdo con su esquema, observado en
En este caso, durante la electrólisis del ácido acético, se produce la formación de etano, ácido carbónico y
hidrógeno:
H2O+C2H6.C2O3=H2+,
y durante la electrólisis del ácido valérico - octano, ácido carbónico e hidrógeno: H2O+C8H18.C2O3=H2+.
El trabajo de Kolbe sobre la estructura del ácido acético y, al mismo tiempo, todos.
Finalmente se aclararon otros ácidos orgánicos y el papel de los químicos posteriores.
reducido sólo a la división - debido a consideraciones teóricas y a la autoridad de Gerard,
Las fórmulas de Kolbe a la mitad y su traducción al lenguaje de las opiniones estructurales,
debido a lo cual la fórmula C2H6.C2O4H2 se convirtió en CH3.CO(OH).
Métodos de obtención:
El principal método técnico para producir ácido acético es la oxidación de acetaldehído con oxígeno atmosférico en presencia de catalizadores de manganeso.
ácido acetaldehído acético
Propiedades químicas:
Interacción con:
Rieles
Ácido acético Acetato de magnesio
Solicitud:
El ácido acético se utiliza ampliamente en la industria para:
- Conservas de productos cárnicos y pesqueros,
- Producción de fibras sintéticas (acetato),
- producción de herbicidas,
- Síntesis de sustancias aromáticas y disolventes.
- En las industrias del cuero, textil y otras,
- Las sales de ácido acético (acetatos) se utilizan ampliamente.
Sin duda, el más universal de los disolventes conocidos relacionados con los ácidos monobásicos alifáticos es el conocido ácido acético. También tiene otros nombres: esencia de vinagre o ácido etanoico. El bajo precio y la disponibilidad en diferentes concentraciones (del 3 al 100%) de esta sustancia, su estabilidad y facilidad de purificación han llevado a que hoy sea el mejor y más conocido producto con propiedades para disolver la mayoría de sustancias orgánicas. origen, que tiene una gran demanda en diversos campos de la actividad humana.
El ácido acético y, en consecuencia, la posibilidad de su uso en industrias individuales pueden variar según el grado de concentración. Se divide en alimentario, es decir, vinagre (3-15%), y técnico: esencia de vinagre (70-80%) y hielo (100%).
Tanto a nivel cotidiano como, en general, en industria alimentaria, tiene una gran demanda una solución poco concentrada, cuyo porcentaje de ácido acético es de aproximadamente el 3-15%. Se utiliza para condimentar platos preparados, para dar sabor a diversos productos, es indispensable para enlatar, encurtir y salar productos cárnicos y pesqueros, etc.
Técnico ácido acético 70, comprar que, a diferencia de los alimentos, no se pueden encontrar en una tienda de comestibles normal, se utilizan activamente en industria química, como excelente disolvente y reactivo químico que sintetiza otras sustancias, por ejemplo, acetona.
La esencia de vinagre técnico se utiliza a menudo en medicina (por ejemplo, aspirina), pulpa y papel (tintura e impresión), pinturas y barnices, perfumería textil, cuero y otros campos industriales. Se utiliza para combinar sustancias aromáticas, producir herbicidas y crear fibra de acetato (sintética).
La importancia del ácido acético en medicina y industria farmaceutica también genial. Esta sustancia es un componente integral de varios medicamentos y medicamentos, como las sales de ácido acético de plomo y aluminio, ácido acetilsalicílico. Juntos se utilizan en el tratamiento de numerosos procesos inflamatorios Y varias enfermedades, principalmente piojos, intoxicaciones por alcohol, líquenes, radiculitis, poliartritis, etc.
esencia de vinagre, así como disolvente 646, precio Por lo que además es pequeño, puedes comprarlo en casi cualquier tienda de artículos para el hogar sin excepción. También puedes pedirlo y comprarlo rápidamente en línea. El costo será más barato. Esto es especialmente beneficioso para quienes trabajan en la industria, donde se requieren volúmenes considerables y donde el ácido acético, como otros disolventes químicos, vendido en botellas y toneles de muchos litros. Por lo tanto, es mejor comprarlo a proveedores que ya hayan demostrado su valía y sus productos en este mercado.
Visto: 11.857 veces
El ácido acético (ácido etanoico, E260) es un ácido carboxílico monobásico saturado, débil.
El ácido acético es un líquido incoloro con un olor acre característico y un sabor amargo. Higroscópico. Ilimitadamente soluble en agua. Fórmula química CH3COOH.
Una solución acuosa de ácido acético al 70-80% se llama esencia de vinagre y al 3-6% se llama vinagre. Las soluciones acuosas de ácido acético se utilizan ampliamente en la industria alimentaria y en la cocina doméstica, así como en la elaboración de conservas.
Producto del amargor natural de los vinos de uva seca y de la fermentación de alcoholes y carbohidratos. Participa en el metabolismo del cuerpo. Muy utilizado en la preparación de conservas, adobos y vinagretas.
El ácido acético se utiliza para obtener sustancias medicinales y aromáticas, como disolvente (por ejemplo, en la producción de acetato de celulosa, acetona). Se utiliza en estampación y teñido.
Las sales y ésteres del ácido acético se denominan acetatos.
El aditivo alimentario E260 es conocido por todos como ácido acético o vinagre. El aditivo E260 se utiliza en la industria alimentaria como regulador de la acidez. El ácido acético se utiliza principalmente en forma de soluciones acuosas en proporciones del 3-9% (vinagre) y del 70-80% (esencia acética). El aditivo E260 tiene un olor acre característico. En soluciones acuosas, el regulador de acidez E260 es un ácido bastante débil. En su forma pura, el ácido acético es un líquido cáustico incoloro que absorbe la humedad de ambiente y congelar ya a una temperatura de 16,5 ° C con formación de cristales sólidos incoloros. Fórmula química del ácido acético: C 2 H 4 O 2.
El vinagre se conocía hace varios miles de años como un producto de fermentación natural de la cerveza o el vino. En 1847, el químico alemán Hermann Kolbe sintetizó por primera vez ácido acético en el laboratorio. Actualmente, sólo el 10% de la producción total de ácido acético se extrae mediante métodos naturales en el mundo. Pero el método de fermentación natural sigue siendo importante, ya que muchos países tienen leyes que exigen que en la industria alimentaria sólo se utilice ácido acético de origen biológico. En la producción bioquímica del aditivo E260 se utiliza la capacidad de algunas bacterias para oxidar el etanol (alcohol). este método conocida como fermentación del ácido acético. Como materia prima para la producción del aditivo E260 se utilizan jugos fermentados, vino o una solución de alcohol en agua. También existen varios métodos para sintetizar ácido acético en la industria. El más popular de ellos, que representa más de la mitad de la síntesis de ácido acético en el mundo, implica la carbonilación de metanol en presencia de catalizadores. Los componentes de partida para esta reacción son metanol (CH 3 OH) y monóxido de carbono (CO).
El ácido acético es esencial para el trabajo. cuerpo humano. Sus derivados ayudan a descomponer los carbohidratos y las grasas del organismo que ingresan al organismo con los alimentos. El ácido acético se libera durante la actividad de ciertos tipos de bacterias, en particular Clostridium acetobutylicum y bacterias del género acetobacteria. Estas bacterias se encuentran ubicuamente en el agua, el suelo, los alimentos y naturalmente entrar en el cuerpo humano.
El efecto tóxico del aditivo E260 en el cuerpo humano depende del grado de dilución del ácido acético con agua. Las soluciones en las que la concentración de ácido acético es superior al 30% se consideran peligrosas para la salud y la vida. El ácido acético altamente concentrado en contacto con la piel y las membranas mucosas puede provocar quemaduras químicas graves.
En la industria alimentaria, el aditivo E260 se utiliza para hornear productos de confitería, enlatar verduras, producir mayonesa y otros productos alimenticios.
El regulador de acidez E260 está aprobado para su uso en productos alimenticios en todos los países, como complemento seguro para la salud humana.
También se utiliza ácido acético:
- en la vida cotidiana (eliminar las incrustaciones de las teteras, cuidar las superficies);
- en la industria química (como disolvente y reactivo químico);
- en medicina (obtención de medicamentos);
- en otras industrias.
El conservante alimentario E260 El ácido acético es bien conocido por todas las personas interesadas en el arte de la gastronomía. Este producto es el resultado del amargor de los vinos de uva en condiciones naturales, en las que se produce la fermentación del alcohol y los carbohidratos. Además, se sabe que el ácido acético participa directamente en los procesos metabólicos del cuerpo humano.
El ácido acético tiene un olor acre, pero forma pura es un líquido completamente incoloro capaz de absorber la humedad del ambiente. Esta sustancia puede congelarse a una temperatura de menos 16 grados, lo que da como resultado la formación de cristales transparentes.
Cabe destacar que una solución de ácido acético al 3-6% se llama vinagre, mientras que una solución al 70-80 por ciento produce esencia de vinagre. Las soluciones a base de agua E260 se utilizan ampliamente no solo en la industria alimentaria, sino también en la cocina doméstica. El principal uso del conservante alimentario E260 ácido acético es la producción de adobos y conservas.
Además, esta sustancia se añade activamente cuando producción industrial una serie de productos de confitería, así como mayonesa y verduras enlatadas. A menudo, si existe una necesidad especial, el conservante alimentario E260 ácido acético se puede utilizar como desinfectante y desinfectante.
Sin embargo, la producción de alimentos no es el único ámbito donde se utiliza el conservante alimentario E260. Por tanto, se utiliza ampliamente en la producción química, en la producción de vidrio orgánico, fibra de acetato, así como en la producción de éteres y medicamentos.
Por cierto, en farmacología se utiliza ampliamente el llamado éster acético, que la gente conoce mejor con el nombre de ácido acetilsalicílico o aspirina. Como disolvente, el ácido acético también ayuda a las personas en varios casos, y las sales aisladas de su composición se utilizan con éxito en la lucha contra las plagas de las plantas.
Conservante alimentario nocivo E260 Ácido acético
El daño al ser humano por el conservante alimentario E260 ácido acético es especialmente evidente cuando esta sustancia se consume en altas concentraciones, ya que en esta forma es muy tóxica. Por cierto, el grado de toxicidad ácida depende directamente de cuánto se diluyó con agua. Las soluciones cuya concentración supera el 30 por ciento se consideran las más peligrosas para la salud. Cuando las membranas mucosas o la piel entran en contacto con ácido acético concentrado, se producen graves quemaduras químicas.
El conservante alimentario E260 El ácido acético está aprobado para su uso en la industria alimentaria en todos los países del mundo, ya que no se considera peligroso para la salud. Lo único que recomiendan los expertos para evitar posibles daños del conservante alimentario E260 ácido acético es limitar el consumo de productos que contengan esta sustancia a personas con enfermedades hepáticas y gastrointestinales. Estos productos no se recomiendan para niños menores de 6 a 7 años.
ácido acético
Los ácidos volátiles del vino son los ácidos grasos monobásicos de fórmula general incluidos en su composición.
Se trata de ácidos fórmico, acético, propiónico, butírico, valérico, caprílico y otros ácidos grasos superiores. El principal entre los ácidos volátiles en términos de cantidad e importancia es ácido acético. Todas las determinaciones analíticas de la acidez volátil de los vinos se realizan en términos de ácido acético.
Ácidos volátiles del vino.– subproductos de la fermentación alcohólica. Durante la fermentación, la menor cantidad de ácidos volátiles se forma en el rango de temperatura de 15 ºС a 25 ºС. Más alto y más bajas temperaturas la fermentación contribuye a la formación de una mayor masa de ácidos volátiles. En condiciones de fermentación aeróbica, se producen menos volátiles.
Los ácidos volátiles se destilan con vapor. Esta propiedad es la base de todos los métodos para su determinación cuantitativa.
Las sales de ácidos volátiles son fácilmente solubles en agua y alcohol. Son deseables ésteres de ácidos volátiles en pequeñas cantidades. parte integrante ramos de vinos y coñacs.
ácido acético(CH3COOH) se conoce desde la antigüedad. Su radical ácido se llama " Acetilo"de la designación latina para ácido - « ácido acetico» . En su forma pura, el ácido acético anhidro es un líquido incoloro con un olor acre, que se endurece formando una masa cristalina a temperaturas inferiores a 16 ºC. El punto de ebullición del ácido acético es + 118,5 ºС.
En tecnología se utilizan tanto el ácido acético como sus sales. Las sales se utilizan en las industrias textil, química, del cuero y del caucho. El propio ácido acético se utiliza para la preparación de acetona, acetatos de celulosa, sustancias aromáticas, se utiliza en medicina, industria alimentaria y se utiliza para la preparación de adobos.
vinagre de plomo (CH3 COOH)2·Pb· Pb(OH)2 Utilizado en la producción de cal y análisis químico para la precipitación de sustancias fenólicas.
El llamado vinagre de mesa se prepara a partir de ácido acético, que se utiliza mucho en pequeñas cantidades para dar sabor a diversos platos. El vinagre de vino natural, obtenido del vino, tiene una gran demanda en la cocina.
Para preparar vinagre de vino de mesa, el vino diluido con agua se acidifica ligeramente con vinagre y se coloca en tinas planas o barricas abiertas. Se aplica una película de bacterias acéticas a la superficie del líquido. Amplio acceso de aire (aireación), temperatura elevada y la ausencia total de sulfitación contribuyen al rápido desarrollo de bacterias del ácido acético y a la rápida conversión del alcohol etílico en ácido acético.
El ácido acético es un subproducto obligatorio de la fermentación alcohólica y constituye la proporción principal de los ácidos volátiles.
El aumento del contenido de ácidos volátiles en los vinos se explica por su aparición en muchas enfermedades del vino y como consecuencia de la actividad de diversos bacterias patógenas. La enfermedad del vino más peligrosa y al mismo tiempo más común es Amargo de vinagre. con esta enfermedad etanol el género se oxida a ácido acético por acción de bacterias acéticas (Bact. aceti, etc.):
El llenado oportuno, el almacenamiento de los materiales del vino a temperaturas de 10-12 ºС y la sulfitación moderada previenen la aparición de acidez acética en el vino. Las bacterias acéticas son aerobias y muy sensibles al ácido sulfuroso, que limita el acceso de oxígeno al vino.
Para corregir los vinos que sufren acidez por vinagre, se puede cultivar una película de jerez en la superficie del vino. La levadura de jerez, que se desarrolla en el vino, reduce significativamente el contenido de ácidos volátiles. Los vinos de mesa con un alto contenido (más de 4 g/dm3) de ácidos volátiles, después de eliminar la película de vinagre, se pasteurizan para matar las bacterias acéticas, se alcoholizan y se utilizan en mezclas de vinos fuertes comunes. Las bacterias acéticas también pueden destruirse mediante sulfitación a una dosis de al menos 100 mg/dm3 con tratamiento inmediato con bentonita y filtración de vino.
Ácidos volátiles del vino. - 3.0 de 5 basado en 3 votos
Gracias al trabajo de Kolbe, finalmente se esclareció la estructura del ácido acético y, al mismo tiempo, de todos los demás ácidos orgánicos, y el papel de los químicos posteriores se redujo sólo a la división: debido a consideraciones teóricas y a la autoridad de Gerard, las fórmulas de Kolbe se dividieron por la mitad y a traducirlos al lenguaje de las opiniones estructurales, por lo que la fórmula C2H6.C2O4H2 se convirtió en CH3.CO(OH).
2. Propiedades del ácido acético
Los ácidos carboxílicos son compuestos orgánicos que contienen uno o más grupos carboxilo –COOH unidos a un radical hidrocarbonado.
Propiedades ácidas ácidos carboxílicos son causados por un cambio en la densidad electrónica al oxígeno del carbonilo y la polarización adicional resultante (en comparación con los alcoholes) del enlace O-H. En una solución acuosa, los ácidos carboxílicos se disocian en iones:Con aumento peso molecular la solubilidad de los ácidos en agua disminuye. Según el número de grupos carboxílicos, los ácidos se dividen en monobásicos (monocarboxílicos) y polibásicos (dicarboxílicos, tricarboxílicos, etc.).
Según la naturaleza del radical hidrocarbonado, se distinguen ácidos saturados, insaturados y aromáticos.
Los nombres sistemáticos de los ácidos vienen dados por el nombre del hidrocarburo correspondiente con la adición de un sufijo -nuevo y palabras ácido. También se suelen utilizar nombres triviales.
Algunos ácidos monobásicos saturados.
|
Fórmula |
Nombre |
|
|
sistemático |
trivial |
|
|
metano |
hormiga |
|
|
etano |
vinagre |
|
|
propano |
propiónico |
|
|
butano |
aceite |
|
|
pentano |
valeriana |
|
|
hexano |
nylon |
|
|
pentadecano |
palmítico |
|
|
heptadecanova |
esteárico |
|
Los ácidos carboxílicos exhiben una alta reactividad. Reaccionan con diversas sustancias y forman una variedad de compuestos, entre los que se encuentran los de gran importancia. derivados funcionales, es decir. compuestos obtenidos como resultado de reacciones en el grupo carboxilo.
2.1 Formación de sales a) por interacción con metales:
2RCOOH + Mg ® (RCOO)2Mg + H2
b) en reacciones con hidróxidos metálicos:
2RCOOH + NaOH ® RCOONa + H2O
En lugar de ácidos carboxílicos, se utilizan con mayor frecuencia sus haluros de ácido: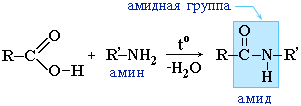 |
Las amidas juegan un papel importante en la naturaleza. Las moléculas de péptidos y proteínas naturales se construyen a partir de a-aminoácidos con la participación de grupos amida: enlaces peptídicos.
Acético (ácido etanoico).
Fórmula: CH 3 – COOH; líquido transparente e incoloro con olor acre; por debajo del punto de fusión (pf 16,6 grados C) hay una masa parecida al hielo (por lo tanto, el ácido acético concentrado también se llama ácido acético glacial). Soluble en agua, etanol.
Tabla 1. Propiedades físicas del ácido acético.
| Nombre | Fórmula ácida |
Solubilidad (g/100ml H2O;25°C) | Ka (a 25°C) |
|||||
|
sus sales (ésteres) |
||||||||
|
vinagre |
etano | |||||||
Artículos relacionados
-
Inglés - reloj, hora
Cualquiera interesado en aprender inglés se ha topado con notaciones p extrañas. metro. y a. m, y en general, en todos los lugares donde se menciona la hora, por alguna razón solo se usa el formato de 12 horas. Probablemente para nosotros viviendo...
-
"Alquimia sobre papel": recetas
Doodle Alchemy o Alchemy on paper para Android es un interesante juego de rompecabezas con hermosos gráficos y efectos. Aprende a jugar a este increíble juego y también encuentra combinaciones de elementos para completar el juego de Alquimia en papel. Juego...
-
Batman: Arkham City ¿no arranca?
Si se enfrenta al hecho de que Batman: Arkham City se ralentiza, se bloquea, Batman: Arkham City no se inicia, Batman: Arkham City no se instala, los controles no funcionan en Batman: Arkham City, no hay sonido, aparecen errores arriba en Batman:...
-
Cómo hacer que alguien deje de jugar a las máquinas tragamonedas Cómo hacer que alguien deje de jugar
Junto con el psicoterapeuta de la clínica Rehab Family de Moscú y el especialista en el tratamiento de la adicción al juego, Roman Gerasimov, Rating Bookmakers trazó el camino de un adicto al juego en las apuestas deportivas, desde la formación de la adicción hasta la consulta con un médico,...
-
Rebuses Entretenidos acertijos acertijos
Juego "Acertijos, Charadas y Rebuses": respuesta a la sección "Acertijos" Nivel 1 y 2 ● Ni un ratón ni un pájaro: retoza en el bosque, vive en los árboles y roe nueces. ● Tres ojos: tres órdenes, el rojo es el más peligroso.
-
Nivel 3 y 4 ● Dos antenas por...
Plazos para la recepción de fondos por intoxicación.
