Fórmula de ácido acético anhidro. Química: Ácido acético, Resumen
en el tema:
Realizado por:_____________
______________________
Comprobado:_____________
______________________
Volgogrado 2004
Introducción………………………………………………………….3
1. Descubrimiento del ácido acético……………………..5
2. Propiedades del ácido acético……………………..13
3. Obtención de ácido acético……………………19
4. El uso de ácido acético…………………….22
Conclusión………………………………………………....26
Lista de literatura utilizada………………..…27
Introducción
ÁCIDO ACÉTICO, CH3COOH, líquido inflamable incoloro de olor acre, muy soluble en agua. Tiene un sabor agrio característico, conduce la electricidad.
El ácido acético era el único conocido por los antiguos griegos. De ahí su nombre: "oksos" - sabor agrio, agrio. El ácido acético es el tipo más simple de ácidos orgánicos que son una parte integral de las grasas vegetales y animales. En pequeñas concentraciones, está presente en alimentos y bebidas e interviene en procesos metabólicos durante la maduración de los frutos. El ácido acético se encuentra a menudo en plantas, en secreciones animales. Las sales y ésteres del ácido acético se denominan acetatos.
El ácido acético es débil (solo se disocia parcialmente en solución acuosa). Sin embargo, dado que el ambiente ácido inhibe la actividad vital de los microorganismos, el ácido acético se usa en conservas. productos alimenticios como en adobos.
El ácido acético se obtiene por oxidación de acetaldehído y otros métodos, el ácido acético alimentario se obtiene por fermentación de ácido acético de etanol. Se utiliza para obtener sustancias medicinales y aromáticas, como disolvente (por ejemplo, en la producción de acetato de celulosa), en forma de vinagre de mesa en la elaboración de condimentos, adobos y conservas. El ácido acético está involucrado en muchos procesos metabólicos en los organismos vivos. Es uno de los ácidos volátiles presentes en casi todos los alimentos, de sabor ácido y el principal ingrediente del vinagre.
El propósito de este trabajo: estudiar las propiedades, producción y uso del ácido acético.
Tareas este estudio:
1. Cuente la historia del descubrimiento del ácido acético.
2. Estudia las propiedades del ácido acético
3. Describir métodos para producir ácido acético.
4. Revelar las características del uso de ácido acético.
1. Descubrimiento del ácido acético
La estructura del ácido acético ha sido de interés para los químicos desde el descubrimiento del ácido tricloroacético por Dumas, ya que este descubrimiento asestó un duro golpe a la entonces dominante teoría electroquímica de Berzelius. Este último, al distribuir los elementos en electropositivos y electronegativos, no reconoció la posibilidad de sustitución en las sustancias orgánicas, sin un cambio profundo en ellas. propiedades químicas , hidrógeno (un elemento electropositivo) por cloro (un elemento electronegativo), pero mientras tanto, según las observaciones de Dumas ("Comptes rendus" de la Academia de París, 1839), resultó que "la introducción de cloro en lugar de hidrógeno no cambiar por completo las propiedades externas de la molécula...", razón por la cual Dumas y hace la pregunta "son los puntos de vista electroquímicos y las ideas sobre la polaridad atribuidas a las moléculas (átomos) de los cuerpos simples basados en hechos tan claros que pueden ser considerados objetos de fe incondicional; si han de ser consideradas como hipótesis, entonces si estas hipótesis son adecuadas para los hechos "... Debemos admitir, continúa, que la situación es diferente. En química inorgánica, nos guiamos por el isomorfismo, un teoría basada en hechos, que, como es bien sabido, tiene poca concordancia con las teorías electroquímicas.En química orgánica, la teoría de la sustitución juega el mismo papel... y quizás el futuro muestre que ambas visiones están más estrechamente relacionadas entre sí. , que se siguen de las mismas causas y pueden generalizarse uno y el mismo nombre. Mientras tanto, sobre la base de la conversión del ácido U. en ácido cloroacético y del aldehído en cloraldehído (cloral) y del hecho de que en estos casos todo el hidrógeno puede ser reemplazado por un volumen igual de cloro sin cambiar la naturaleza química básica de la sustancia, podemos concluir que en química orgánica hay tipos que se conservan incluso cuando introducimos volúmenes iguales de cloro, bromo y yodo en lugar de hidrógeno. Y esto significa que la teoría de la sustitución se basa en hechos y, además, es la más brillante de la química orgánica ". Citando este extracto en su informe anual de la Academia Sueca ("Jahresbericht etc.", vol. 19, 1840, p. . 370). Berzelius comenta: "Dumas preparó un compuesto al que le da la fórmula racional C4Cl6O3 + H2O (los pesos atómicos son modernos; el ácido tricloroacético se considera como un compuesto anhídrido con agua); clasifica esta observación entre faits les plus eclatants de la Chimie organique; esta es la base de su teoría de la sustitución. lo cual, en su opinión, derribará las teorías electroquímicas... pero mientras tanto resulta que uno solo tiene que escribir su fórmula un poco diferente para tener un compuesto de ácido oxálico. con el cloruro correspondiente, C2Cl6 + C2O4H2, que queda combinado con el ácido oxálico tanto en ácido como en sales. Estamos pues ante una especie de compuesto, del que se conocen muchos ejemplos; muchos ... tanto los radicales simples como los complejos tienen la propiedad de que su parte que contiene oxígeno puede combinarse con las bases y perderlas sin perder el contacto con la parte que contiene cloro. Este punto de vista no ha sido presentado por Dumas y no ha sido objeto de verificación experimental, pero mientras tanto, si es cierto, entonces la nueva enseñanza, que, según Dumas, es incompatible con las ideas teóricas que han prevalecido hasta ahora, tiene el tierra arrancada de debajo de sus pies y debe caer.luego algunos compuestos inorgánicos, similares, en su opinión, al ácido cloroacético (entre ellos, Berzelius también citó el cloruro de ácido crómico - CrO2Cl2, que consideró un compuesto de cromo perclórico ( desconocido hasta el día de hoy) con anhídrido crómico: 3CrO2Cl2 \u003d CrCl6 + 2CrO3), Berzelius continúa: "El ácido cloroacético de Dumas obviamente pertenece a esta clase de compuestos; en él, el radical de carbono se combina con oxígeno y cloro. Por lo tanto, puede ser ácido oxálico, en el que la mitad del oxígeno se reemplaza por cloro, o un compuesto de 1 átomo (molécula) de ácido oxálico con 1 átomo (molécula) de sesquicloruro de carbono - C2Cl6. El primer supuesto no puede aceptarse, porque admite la posibilidad de sustitución de 11/2 átomos de oxígeno por cloro (Según Berzelius, el ácido oxálico era C2O3.). Dumas, en cambio, se adhiere a la tercera idea, completamente incompatible con las dos anteriores, según la cual el cloro no sustituye al oxígeno, sino al hidrógeno electropositivo, formando el hidrocarburo C4Cl6, que tiene las mismas propiedades de radical complejo que C4H6 o acetilo, y supuestamente es capaz de dar ácido con 3 átomos de oxígeno, idéntico en propiedades al W., pero, como se puede ver en la comparación (de sus propiedades físicas), es completamente diferente al mismo año ( "Jahresb.", 19, 1840, 558) en relación con el artículo de Gerard ("Journ. f. pr. Ch.", XIV, 17): "Gerard, dice, expresó un nuevo punto de vista sobre la composición del alcohol, el éter y su derivados; es el siguiente: el conocido compuesto de cromo, oxígeno y cloro tiene la fórmula = CrO2Cl2, el cloro reemplaza el átomo de oxígeno en él (Berzelius significa 1 átomo de oxígeno de anhídrido crómico - CrO3). U. ácido C4H6 + 3O contiene 2 átomos (moléculas) de ácido oxálico, de los cuales en uno todo el oxígeno se reemplaza por hidrógeno \u003d C2O3 + C2H6. Y tal juego de fórmulas llenó 37 páginas. Pero al año siguiente, Dumas, desarrollando aún más la idea de los tipos, señaló que, al hablar de la identidad de las propiedades de U. y el ácido tricloroacético, se refería a la identidad de sus propiedades químicas, claramente expresadas, por ejemplo, en la analogía de su descomposición bajo la influencia de los álcalis: C2H3O2K + KOH \u003d CH4 + K2CO8 y С2Cl3O2K + KOH \u003d CHCl3 + K2CO8, ya que CH4 y CHCl3 son representantes del mismo tipo mecánico. Por otra parte, Liebig y Graham se pronunciaron públicamente por la gran sencillez lograda sobre la base de la teoría de sustitución, al considerar los derivados clorados del éter ordinario y los ésteres de ácido fórmico y U. obtenidos por Malagutti, y Berzelius, obteniéndose a la presión de los hechos nuevos, en la 5ª ed. de su "Lehrbuch der Chemie" (Prefacio marcado noviembre de 1842), olvidando su dura reseña de Gerard, encontró posible escribir lo siguiente: "Si recordamos la transformación (en el texto de descomposición) del ácido acético bajo la influencia del cloro en ácido clorooxálico (ácido cloroxálico - Chloroxalsaure - Berzelius llama ácido tricloroacético ("Lehrbuch", 5th ed., p. 629), entonces es posible otra visión de la composición del ácido acético (el ácido acético es llamado Acetylsaure por Berzelius), a saber, puede ser ácido oxálico combinado, en el que el grupo coincidente (Paarling) es C2H6, así como el grupo coincidente en el ácido clorooxálico es C2Cl6, y entonces la acción del cloro sobre el ácido acético consistiría únicamente en la conversión de C2H6 en C2Cl6. ., sin embargo, es útil prestar atención a la posibilidad de ello".
Así, Berzelius tuvo que admitir la posibilidad de reemplazar el hidrógeno por cloro sin cambiar la función química del cuerpo original en el que se produce la sustitución. Sin detenerme en la aplicación de sus puntos de vista a otros compuestos, me dirijo a los trabajos de Kolbe, quien encontró una serie de hechos para el ácido acético, y luego para otros ácidos monobásicos limitantes, que estaban en armonía con los puntos de vista de Berzelius (Gerard) . El punto de partida del trabajo de Kolbe fue el estudio de una sustancia cristalina, la composición CCl4SO2, obtenida anteriormente por Berzelius y Marse por la acción del agua regia sobre CS2 y formada por Kolbe por la acción del cloro húmedo sobre CS2. Una serie de transformaciones de Kolbe (Ver Kolbe, "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Chu u. Ph.", 54, 1845, 145).) mostró que este cuerpo es, en términos modernos, anhídrido de cloro triclorometilsulfónico ácidos, CCl4SO2 = CCl3.SO2Cl (Kolbe lo llamó Schwefligsaures Kohlensuperchlorid), capaz de dar sales del ácido correspondiente - CCl3.SO2 (OH) bajo la influencia de los álcalis [según Kolbe HO + C2Cl3S2O5 - Chlorkohlenunterschwefelsaure] (Pesos atómicos: H =2, Cl=71 , C \u003d 12 y O \u003d 16; y por lo tanto, en los pesos atómicos modernos, es C4Cl6S2O6H2.), que, bajo la influencia del zinc, primero reemplaza un átomo de Cl con hidrógeno, formando el ácido CHCl2.SO2 (OH) [según Kolbe - wasserhaltige Chlorformylunterschwefelsaure (Berzelius (" Jahresb. "25, 1846, 91) señala que es correcto considerarlo una combinación de ácido ditiónico S2O5 con cloroformilo, por lo que llama CCl3SO2 (OH) Kohlensuperchlorur (C2Cl6) - Ditionauro (S2O5).El agua hidratada, como de costumbre, no es tenida en cuenta por Berzelius.), y comemos y el otro, formando el ácido CH2Cl.SO2 (OH) [según Kolbe - Chlorelaylunterschwefelsaure], y, finalmente, durante la reducción con corriente o amalgama de potasio (La reacción poco antes fue utilizada por Melsance para reducir el ácido tricloroacético a acético ácido.) se reemplaza con hidrógeno y los tres átomos de Cl, formando ácido metilsulfónico. CH3.SO2(OH) [según Kolbe - Methylunterschwefelsaure]. La analogía de estos compuestos con los ácidos cloroacéticos fue involuntariamente llamativa; en efecto, con las fórmulas de entonces se obtuvieron dos series paralelas, como puede verse en la siguiente tabla: S2O5 H2O + C2H6.C2O3 Esto no se le escapó a Kolbe, quien remarca (I. p. 181): “a los ácidos sulfurosos combinados descrito anteriormente y directamente en ácido sulfuroso clorocarbonado (arriba - H2O + C2Cl6. S2O5) se une al ácido clorooxálico, también conocido como ácido cloroacético. Clorocarbono líquido - СCl (Сl=71, С=12; ahora escribimos C2Cl4 - esto es cloroetileno.), Como se sabe, se convierte en luz bajo la influencia del cloro - hexacloroetano (según la nomenclatura de esa época - Kohlensuperchlorurur), y podemos esperar que si se sometiera simultáneamente a la acción del agua, entonces, como el cloruro de bismuto, el cloro antimonio, etc., en el momento de su formación, reemplazará al cloro por oxígeno. La experiencia confirmó la suposición: "Bajo la acción de la luz y el cloro sobre C2Cl4, que estaba bajo el agua, Kolbe recibió, junto con hexacloroetano, ácido tricloroacético y expresó la transformación de la siguiente manera: (Dado que C2Cl4 se puede obtener a partir de CCl4 pasándolo por un calentado) y CCl4 se forma por la acción, al calentarse, de Cl2 sobre CS2, entonces la reacción de Kolbe fue la primera síntesis de ácido acético a partir de los elementos). decidir, ya que el cloro lo oxida inmediatamente a ácido acético a la luz "... La opinión de Berzelius sobre el ácido cloroacético "sorprendentemente (auf eine tiberraschende Weise) se confirma por la existencia y el paralelismo de las propiedades de los ácidos sulfurosos combinados, y, parece mí (dice Kolbe I. p. 186), va más allá del campo de las hipótesis y adquiere un alto grado de probabilidad. Porque si el ácido cloroacético (Chlorkohlenoxalsaure, como ahora Kolbe llama ácido cloroacético) tiene una composición, similar a una composiciónácido clorocarbónico, entonces también debemos considerar el ácido acético, que es responsable del ácido metilsulfuroso, como ácido combinado y considerarlo como ácido metiloxálico: C2H6.C2O3 (Esta es la opinión expresada anteriormente por Gerard). No es de extrañar que en el futuro nos veamos obligados a tomar por ácidos combinados un número importante de esos ácidos orgánicos en los que en la actualidad, por las limitaciones de nuestra información, aceptamos radicales hipotéticos..."" En cuanto a los fenómenos de sustitución en estos ácidos combinados, entonces reciben una explicación simple en el hecho de que varios compuestos, probablemente isomórficos, pueden reemplazarse entre sí en el papel de grupos combinados (als Paarlinge, l. p. p. 187), sin cambiar significativamente las propiedades ácidas de los cuerpo combinado con ellos! "Más confirmación experimental Encontramos este punto de vista en el artículo de Frankland y Kolbe: "Ueber die chemische Constitution der Sauren der Reihe (CH2) 2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen" ("Ann. Chem n. Pharm.", 65, 1848, 288) Basados en la idea de que todos los ácidos de la serie (CH2)2nO4 están construidos como ácido metiloxálico (ahora escribimos CnH2nO2 y llamamos ácido metiloxálico - acético.), ellos notan lo siguiente general: "si la fórmula H2O + H2.C2O3 representa la expresión verdadera de la composición racional del ácido fórmico, es decir, si se considera como ácido oxálico combinado con un equivalente de hidrógeno (La expresión no es correcta; en lugar de h Frankland y Kolbe utilizan la letra tachada, que equivale a 2 N.), luego la transformación con alta temperatura formiato de amonio en ácido cianhídrico acuoso, porque Dobereiner sabe y descubrió que el oxalato de amonio se descompone cuando se calienta en agua y cian. Combinado en ácido fórmico, el hidrógeno participa en la reacción solo por el hecho de que, cuando se combina con cian, forma ácido cianhídrico: educación inversa el ácido fórmico del ácido cianhídrico bajo la influencia de los álcalis no es más que una repetición de la conocida transformación del cianuro disuelto en agua en ácido oxálico y amoníaco, con la única diferencia; que en el momento de la formación el ácido oxálico se combina con el hidrógeno del ácido cianhídrico". El hecho de que el cianuro de benceno (C6H5CN), por ejemplo, según Fehling, no tenga propiedades ácidas y no forme azul de Prusia puede, según Kolbe y Frankland, se compara con la incapacidad del cloruro de etilo para la reacción con AgNO3, y Kolbe y Frankland prueban su corrección por síntesis usando el método del nitrilo (Obtuvieron nitrilos por destilación de ácidos sulfúricos con KCN (por el método de Dumas y Malagutti con Leblanc) : R "SO3 (OH) + KCN \u003d R. CN + KHSO4) acético, propiónico (según el entonces, metacetona) y ácido caproico. Luego, al año siguiente, Kolbe sometió las sales alcalinas de ácidos monobásicos saturados a la electrólisis y, de acuerdo con su esquema, observó al mismo tiempo, durante la electrólisis del ácido acético, la formación de etano, ácido carbónico e hidrógeno: H2O+C2H6.C2O3=H2+, y en la electrólisis del ácido valérico - octano , ácido carbónico e hidrógeno: H2O+C8H18.C2O3=H2+. Sin embargo, es imposible no darse cuenta de que Kolbe esperaba obtener metilo (CH3) "combinado con hidrógeno, es decir, gas de pantano, del ácido acético, y butilo C4H9 del ácido valérico, también combinado con hidrógeno, es decir, C4H10 (él llama C4H9 valilo) , pero en esta expectativa hay que ver una concesión a las fórmulas de Gerard, que ya había recibido importantes derechos de ciudadanía, que abandonó su visión anterior del ácido acético y no lo consideró para C4H8O4, cuya fórmula, a juzgar por los datos crioscópicos, en realidad posee , pero para C2H4O2, como está escrito en todos los libros de texto de química modernos.
Por las obras de Kolbe, la estructura del ácido acético y, al mismo tiempo, todos los demás ácidos orgánicos, finalmente se dilucidaron, y el papel de los químicos posteriores se redujo solo a la división, debido a consideraciones teóricas y la autoridad de Gerard, las fórmulas de Kolbe a la mitad. ya traducirlos al lenguaje de las vistas estructurales, por lo que la fórmula C2H6.C2O4H2 se transformó en CH3.CO(OH).
2. propiedades del ácido acético
ácidos carboxílicos- Compuestos orgánicos que contienen uno o más grupos carboxilo -COOH asociados a un radical hidrocarbonado.
Propiedades ácidas Los ácidos carboxílicos se deben a un cambio en la densidad de electrones al oxígeno del carbonilo y la polarización adicional resultante (en comparación con los alcoholes) del enlace O-H.
En una solución acuosa, los ácidos carboxílicos se disocian en iones:
A medida que aumenta el peso molecular, disminuye la solubilidad de los ácidos en agua.
Según el número de grupos carboxilo, los ácidos se dividen en monobásicos (monocarboxílicos) y polibásicos (dicarboxílicos, tricarboxílicos, etc.).
Según la naturaleza del radical hidrocarbonado se distinguen ácidos saturados, insaturados y aromáticos.
Los nombres sistemáticos de los ácidos vienen dados por el nombre del hidrocarburo correspondiente con la adición del sufijo -ovaya y palabras ácido. También se utilizan a menudo nombres triviales.
Algunos ácidos monobásicos saturados
| Fórmula | Nombre |
|
| sistemático | trivial |
|
| HCOOH | metano | fórmico |
| etano | acético | |
| propano | propiónico | |
| butano | aceitoso | |
| pentano | valeriana | |
| hexano | caprón | |
| pentadecanoico | palmítico | |
| heptadecanoico | esteárico | |
Los ácidos carboxílicos son altamente reactivos. Reaccionan con diversas sustancias y forman una variedad de compuestos, entre los cuales son de gran importancia derivados funcionales, es decir. compuestos resultantes de reacciones en el grupo carboxilo.
2.1 Formación de sal
a) al interactuar con metales:
2RCOOH + Mg ® (RCOO) 2 Mg + H 2
b) en reacciones con hidróxidos metálicos:
2RCOOH + NaOH ® RCOONa + H 2 O
En lugar de ácidos carboxílicos, sus haluros de ácido se usan con más frecuencia:
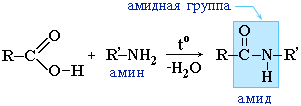 |
Las amidas también se forman por la interacción de ácidos carboxílicos (sus haluros o anhídridos) con derivados orgánicos del amoníaco (aminas):
Las amidas juegan un papel importante en la naturaleza. Las moléculas de péptidos y proteínas naturales se construyen a partir de a-aminoácidos con la participación de grupos amida: enlaces peptídicos.
Acético (ácido etanoico).
Fórmula: CH 3 - COOH; Líquido incoloro claro con un olor acre; por debajo del punto de fusión (pf 16,6 grados C) una masa parecida al hielo (por lo tanto, el ácido acético concentrado también se llama ácido acético glacial). Soluble en agua, etanol.
Tabla 1. Propiedades físicas del ácido acético
| Nombre | Fórmula | hirviendo | Solución- | Ka |
||||
| ácidos | su sal |
|||||||
| acético | etano | acetato | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
El ácido acético sintético de calidad alimentaria es un líquido incoloro, transparente e inflamable con un fuerte olor a vinagre. El ácido acético sintético de calidad alimentaria se produce a partir de metanol y monóxido de carbono en un catalizador de rodio. El ácido acético alimentario sintético se utiliza en las industrias química, farmacéutica y ligera, así como en Industria de alimentos como conservante. Fórmula CH3COOH.
El ácido acético sintético de calidad alimentaria está disponible concentrado (99,7 %) y en forma de solución acuosa (80 %).
Según indicadores físicos y químicos, el ácido acético alimentario sintético debe cumplir con las siguientes normas:
Tabla 2. Principales requisitos técnicos
| Nombre del indicador | |
| 1. Apariencia | Líquido incoloro, transparente y sin impurezas mecánicas. |
| 2. Solubilidad en agua | Solución clara y completa |
| 3. Fracción de masa de ácido acético, %, no menos de | 99,5 |
| 4. fracción de masa de acetaldehído,%, no más | 0,004 |
| 5. Fracción de masa de ácido fórmico, %, no más | 0,05 |
| 6. Fracción de masa de sulfatos (SO 4),%, no más | 0,0003 |
| 7. Fracción de masa de cloruros (Cl),%, no más | 0,0004 |
| 8. Fracción de masa de metales pesados precipitados por sulfuro de hidrógeno (Pb),%, no más | 0,0004 |
| 9. Fracción de masa de hierro (Fe),%, no más | 0,0004 |
| 10. Fracción de masa de residuo no volátil,%, no más | 0,004 |
| 11. Solidez del color de la solución de permanganato de potasio, min, no menos | 60 |
| 12. Fracción de masa de sustancias oxidadas por dicromato de potasio, solución de tiosulfato de sodio cm 3, concentración c (Na 2 SO 3 * 5H 2 O) \u003d 0.1 mol / dm 3 (0.1H), no más | 5,0 |
El ácido acético alimentario sintético es un líquido inflamable que, según el grado de impacto en el cuerpo, pertenece a las sustancias de la tercera clase de peligro. Cuando trabaje con ácido acético, utilice medios individuales protección (máscaras antigás filtrantes). Primeros auxilios para quemaduras - lavado abundante con agua.
El ácido acético alimentario sintético se vierte en vagones cisterna limpios, camiones cisterna con superficie interior desde acero inoxidable, a envases, contenedores y barriles de acero inoxidable con capacidad de hasta 275 dm3, así como a botellas de vidrio y barriles de polietileno con capacidad de hasta 50 dm3. El contenedor polimérico se acerca para el golfo y el almacenaje del ácido acético durante un mes. El ácido acético sintético de calidad alimentaria se almacena en tanques herméticos de acero inoxidable. Los contenedores, contenedores, barriles, botellas y frascos de polietileno se almacenan en almacenes o bajo un dosel. No se permite el almacenamiento conjunto con agentes oxidantes fuertes (ácido nítrico, ácido sulfúrico, permanganato de potasio, etc.).
Se transporta en tanques ferroviarios de acero inoxidable grado 12X18H10T o 10X17H13M2T, con descarga superior.
3. Obtención de ácido acético
El ácido acético es el producto químico más importante, ampliamente utilizado en la industria para la producción de ésteres, monómeros (acetato de vinilo), en la industria alimentaria, etc. Su producción mundial alcanza los 5 millones de toneladas al año. Hasta hace poco, la producción de ácido acético se basaba en materias primas petroquímicas. En el proceso de Walker, el etileno en condiciones leves oxidar con oxígeno atmosférico a acetaldehído en presencia de un sistema catalítico de PdCl2 y CuCl2. Además, el acetaldehído se oxida a ácido acético:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
Según otro método, el ácido acético se obtiene oxidando n-butano a una temperatura de 200 C y una presión de 50 atm en presencia de un catalizador de cobalto.
El elegante proceso de Walker, uno de los símbolos del desarrollo de la petroquímica, está siendo reemplazado gradualmente por nuevos métodos basados en el uso de materias primas de carbón. Se han desarrollado métodos para producir ácido acético a partir de metanol:
CH3OH + COCH3COOH
Esta reacción, de gran importancia industrial, es un excelente ejemplo del éxito de la catálisis homogénea. Dado que ambos componentes de la reacción, CH3OH y CO, se pueden obtener del carbón, el proceso de carbonilación debería volverse más económico a medida que aumentan los precios del petróleo. Existen dos procesos industriales para la carbonilación del metanol. El método más antiguo desarrollado por BASF usaba un catalizador de cobalto, las condiciones de reacción eran severas: temperatura 250°C y presión 500-700 atm. Otro proceso dominado por Monsanto utilizó un catalizador de rodio, la reacción se llevó a cabo a más temperaturas bajas(150-200 C) y presión (1-40 atm). La historia del descubrimiento de este proceso es interesante. Los científicos de la empresa investigaron la hidroformilación utilizando catalizadores de fosfina de rodio. El director técnico del departamento petroquímico sugirió utilizar el mismo catalizador para la carbonilación del metanol. Los resultados de los experimentos fueron negativos, y esto se debió a la dificultad de formar un enlace metal-carbono. Sin embargo, recordando una conferencia de un consultor de la empresa sobre la fácil adición oxidativa de yoduro de metilo a complejos metálicos, los investigadores decidieron agregar un promotor de yodo a la mezcla de reacción y obtuvieron un resultado brillante, que al principio no se creía. Los científicos de la compañía rival Union Carbide también hicieron un descubrimiento similar, que solo estaban unos meses atrás. El equipo de desarrollo de la tecnología de carbonilación del metanol, después de solo 5 meses de intenso trabajo, creó el proceso industrial Monsanto, con cuya ayuda se obtuvieron 150 mil toneladas de ácido acético en 1970. Este proceso se convirtió en el precursor del campo de la ciencia, que se denominó química C1.
El mecanismo de carbonilación ha sido ampliamente investigado. El yoduro de metilo, necesario para la reacción, se obtiene mediante la ecuación
CH3OH + ALTO CH3I + H2O
El ciclo catalítico se puede representar de la siguiente manera:
El yoduro de metilo se agrega oxidativamente al complejo planar-cuadrado - (I) para formar un complejo de seis coordinaciones II, luego, como resultado de la introducción de CO a través del enlace metil-rodio, se forma un complejo de acetilrodio (III). La eliminación reductora del yoduro de ácido acético regenera el catalizador, y la hidrólisis del yoduro da ácido acético.
Síntesis industrial de ácido acético:
a) oxidación catalítica de butano
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
b) calentar una mezcla de monóxido de carbono (II) y metanol en un catalizador bajo presión
CH3OH + COCH3COOH
Producción de ácido acético por fermentación (fermentación de ácido acético).
Materias primas: líquidos que contienen etanol (vino, jugos fermentados), oxígeno.
Excipientes: enzimas de bacterias del ácido acético.
Reacción química: El etanol se oxida biocatalíticamente a ácido acético.
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
Producto principal: ácido acético.
4. Aplicación de ácido acético
El ácido acético se utiliza para obtener sustancias medicinales y aromáticas, como disolvente (por ejemplo, en la producción de acetato de celulosa), en forma de vinagre de mesa en la fabricación de condimentos, adobos y conservas.
Una solución acuosa de ácido acético se usa como saborizante y conservante (condimento para alimentos, encurtido de champiñones, verduras).
La composición del vinagre incluye ácidos como málico, láctico, ascórbico, acético.
Vinagre de sidra de manzana (4% de ácido acético)
El vinagre de sidra de manzana contiene 20 esenciales minerales y oligoelementos, así como acético, propiónico, láctico y ácido cítrico, una serie de enzimas y aminoácidos, valiosa fibra dietética, como la potasa, la pectina. El vinagre de sidra de manzana se usa ampliamente para cocinar y enlatar. Acompaña bien todo tipo de ensaladas, tanto de verduras frescas, como de carnes y pescados. Se puede utilizar para marinar carne, pepinos, repollo, alcaparras, verdolaga y trufas. Sin embargo, en Occidente, el vinagre de sidra de manzana es más conocido por su propiedades medicinales. Se utiliza para alta presión arterial, migrañas, asma, dolores de cabeza, alcoholismo, mareos, artritis, enfermedad renal, fiebre alta, quemaduras, escaras, etc.
gente sana se recomienda utilizar una bebida sana y refrescante todos los días: remover una cucharada de miel en un vaso de agua y añadir 1 cucharada de vinagre de sidra de manzana. Si quieres adelgazar, te recomendamos beber un vaso de agua sin azúcar con dos cucharadas de vinagre de sidra de manzana cada vez que comas.
El vinagre se usa ampliamente en conservas caseras para la preparación de adobos de varias concentraciones. A la medicina popular el vinagre se usa como antipirético no específico (al frotar la piel con una solución de agua y vinagre en una proporción de 3: 1), así como para los dolores de cabeza usando lociones. Es habitual el uso de vinagre para las picaduras de insectos a través de compresas.
Se conoce el uso de vinagre de alcohol en cosmetología. Es decir, para dar suavidad y brillo al cabello después de la permanente y la coloración permanente. Para hacer esto, se recomienda enjuagar el cabello con agua tibia agregando vinagre de alcohol (3-4 cucharadas de vinagre por 1 litro de agua).
Vinagre de uva (4% de ácido acético)
El vinagre de uva es ampliamente utilizado por los principales chefs no solo en Eslovenia, sino en todo el mundo. En Eslovenia, se utiliza tradicionalmente en la preparación de diversas ensaladas de verduras y de temporada (2-3 cucharadas por ensaladera). le da un sabor único y refinado al plato. El vinagre de uva también combina bien con varias ensaladas de pescado y platos de mariscos. Al preparar kebabs de varios tipos de carne, pero especialmente de cerdo, el vinagre de uva es simplemente insustituible.
El ácido acético también se utiliza para la producción medicamentos.
Las tabletas de aspirina (ES) contienen el ingrediente activo ácido acetilsalicílico, que es un éster acético ácido salicílico.
Ácido acetilsalicílico producido al calentar ácido salicílico con ácido acético anhidro en presencia de una pequeña cantidad de ácido sulfúrico (como catalizador).
Cuando se calienta con hidróxido de sodio (NaOH) en una solución acuosa, el ácido acetilsalicílico se hidroliza a salicilato de sodio y acetato de sodio. Cuando el medio se acidifica, el ácido salicílico precipita y se puede identificar por su punto de fusión (156-1600C). Otro método para identificar el ácido salicílico formado durante la hidrólisis es la coloración de su solución en un color púrpura oscuro cuando se agrega cloruro de hierro (FeCl3). El ácido acético presente en el filtrado se convierte por calentamiento con etanol y ácido sulfúrico en etoxietanol, que puede reconocerse fácilmente por su olor característico. Además, el ácido acetilsalicílico se puede identificar mediante varios métodos cromatográficos.
El ácido acetilsalicílico cristaliza para formar poliedros monoclínicos incoloros o agujas que tienen un sabor ligeramente agrio. Son estables en aire seco pero se hidrolizan gradualmente a ácido salicílico y ácido acético en ambientes húmedos (Leeson y Mattocks, 1958; Stempel, 1961). La sustancia pura es un polvo cristalino blanco, casi inodoro. El olor a ácido acético indica que la sustancia ha comenzado a hidrolizarse. El ácido acetilsalicílico sufre esterificación bajo la acción de hidróxidos alcalinos, bicarbonatos alcalinos y también en agua hirviendo.
El ácido acetilsalicílico tiene un efecto antiinflamatorio, antipirético y analgésico, y es muy utilizado para la fiebre, dolor de cabeza, neuralgia, etc., y como agente antirreumático.
El ácido acético también se utiliza en la industria química (producción de acetato de celulosa, del que se obtiene fibra de acetato, vidrio orgánico, película; para la síntesis de colorantes, medicamentos y ésteres), en la producción de películas no combustibles, productos de perfumería, disolventes, en la síntesis de colorantes, sustancias medicinales como la aspirina. Las sales de ácido acético se utilizan para controlar las plagas de las plantas.
Conclusión
En este trabajo se consideraron los temas del descubrimiento del ácido acético, sus principales propiedades, producción y aplicación.
Entonces, el ácido acético (CH3COOH), un líquido inflamable incoloro con un olor acre, es altamente soluble en agua. Tiene un sabor agrio característico, conduce la electricidad. El uso de ácido acético en la industria es muy grande.
A El ácido acético producido en Rusia está al nivel de los mejores estándares mundiales, tiene una gran demanda en el mercado mundial y se exporta a muchos países del mundo.
La producción de ácido acético tiene una serie de requisitos específicos propios, por lo que se necesitan especialistas con una amplia experiencia no solo en el campo de la automatización industrial y el control de procesos, sino también con un claro conocimiento de los requisitos especiales de esta industria.
Lista de literatura usada
1. Artemenko, Alexander Ivánovich. Guía de referencia de química / A.I. Artemenko, IV. Tikunova, V. A. Pintado. - 2ª ed., revisada. y adicional - M.: Escuela superior, 2002. - 367 p.
2. Akhmetov, Nail Sibgatovich. Química general e inorgánica: un libro de texto para estudiantes. químico-tecnológico especialista. universidades / Akhmetov N.S. - 4th ed. / Rev. - M .: Higher School, 2002.-743 p.
3. Berezin, Boris Dmítrievich. Curso de química orgánica moderna: Proc. subsidio para estudiantes. universidades, educación en químico-tecnológico especial / Berezin B.D., Berezin D.B.-M.: Higher School, 2001.-768 p.
4. I. G. Bolesov, G. S. Zaitseva. Ácidos carboxílicos y sus derivados (síntesis, reactividad, aplicación en síntesis orgánica). Materiales metódicos en el curso general de química orgánica. Número 5. Moscú 1997
5. Sommer K. Acumulador de conocimientos en química. Por. con alemán, 2ª ed. – M.: Mir, 1985. – 294 p.
6. Karajánov E.A. El gas de síntesis como alternativa al petróleo. I. Proceso de Fischer-Tropsch y oxosíntesis // Soros Educational Journal. 1997. Nº 3. S. 69-74.
Más de Química:
- Examen: Métodos químicos para la extracción de agua y suma de nitrógeno.
- Resumen: Unidad de destilación de operación continua para la separación de 4,1 t/h de mezcla binaria de acetona - etanol
Proyecto de curso sobre OHT
"Método industrial para la producción de ácido acético"
Introducción
Ácido acético (etanoico) es una sustancia orgánica con la fórmula molecular CH 3COOH (abreviado como AcOH). Es un ácido monobásico débil limitante. Las sales de ácido acético y sus ésteres se denominan acetatos .
Vinagre (solución de ácido acético) se conoce desde la antigüedad como un producto de fermentación. En la antigüedad (c. Siglo III a. C.), el vinagre se usaba para producir albayalde. Actualmente, el ácido acético tiene tres usos principales: en primer lugar, como disolvente para algunas síntesis orgánicas, en segundo lugar, como reactivo débilmente ácido (para apagar los productos principales resultantes, etc.) y, finalmente, en tercer lugar, para producir derivados importantes como cloruro de ácido o anhídrido acético , así como ella amida Y así. El cloruro de acilo y el anhídrido acético son agentes acilantes importantes que se utilizan a menudo en la síntesis orgánica.
Las soluciones de ácido acético utilizadas en la industria alimentaria (así como en la cocina y la salazón domésticas) tienen nombres vinagre (3-15%) y esencia de vinagre (70-80%). El ácido acético absoluto (aprox. 99,8 %) se llama hielo , porque cuando se congela, forma una masa parecida al hielo.
El volumen de producción de ácido acético es de alrededor de 5 millones de toneladas/año, con alrededor del 50% producido por el método Kolbe (ver más abajo).
. Propiedades fisicoquímicas
en n.o. El ácido acético es un líquido incoloro con un olor extremadamente acre. La siguiente tabla resume las principales constantes físicas del ácido acético.
METRO r , g/molp, g/cm 3Tmelt., sobre STkip., sobre ESCRITURA puntoRes., J/mol*KDN sobre , kJ/molrKan60.051.049216.75118.1321.6 sobre C5.79 MPa123.4-4874.761.372
El ácido acético es ambivalente en términos de solventes, porque tiene en su composición un grupo polar (-COOH) y uno no polar (-CH 3). Por tanto, es perfectamente soluble en agua y en algunos disolventes orgánicos. También forma azeótropos dobles y triples del tipo "ácido acético-agua-disolvente orgánico".
El ácido acético es débil. ácido orgánico. Es capaz de reaccionar con metales activos con liberación de hidrógeno:
Transformar en derivados ácidos bajo la acción de reactivos apropiados (reacciones importantes en síntesis orgánica):
a) en haluros de ácido
b) en ésteres
c) en amidas
Recuperar a alcohol etílico:
Y también entran en reacciones de sustitución en el grupo metilo, de las cuales la más importante es la reacción de Gel-Volhard-Zelinsky, que se utiliza para obtener un aminoácido importante: la glicina:
Además, con cada sustitución posterior, debido al efecto inductivo del halógeno, aumenta la fuerza del ácido. Entonces, por ejemplo, el ácido trifluoroacético tiene una fuerza cercana a los ácidos minerales.
. Cómo llegar
El más rentable y obvio. metodo quimicoobtener ácido acético es oxidar el aldehído correspondiente ( acetaldehído o etanal ), que, a su vez, se obtiene de dos maneras: hidratación acetileno en presencia de sales de mercurio (II) (reacción de Chugaev), o por oxidación (deshidrogenación) alcohol etílico sobre cobre caliente:
El propio acetaldehído se oxida fácilmente con el oxígeno atmosférico y se convierte lentamente en ácido acético.
El primer método para obtener etanol por la reacción de Chugaev no es rentable por muchas razones, incluido el trabajo con acetileno explosivo, la contaminación del producto con sales de mercurio tóxicas, los grandes volúmenes de reactores, etc. El más común es el segundo método de obtención a partir de alcohol etílico (que se produce en grandes cantidades y es relativamente barato).
El acetaldehído resultante se oxida con oxígeno en presencia de un catalizador: sales de manganeso (II). Este es el método que será considerado en lo que sigue.
Más moderno es el método de carbonilación catalítica de metanol (método de Kolbe) según la reacción:
Este método permite alcanzar rendimientos del orden del 99% para metanol y del 90% para CO. Consiste en burbujear monóxido de carbono a una temperatura de 180°C y presiones de 200-700 atm a través de una mezcla de reactivos. Los catalizadores son yoduros de cobalto o rodio, así como, más raramente, compuestos de iridio. Sobre el este momento alrededor del 50% de todo el ácido acético producido en el mundo se obtiene por este método.
también hay métodos bioquímicos(es decir, por fermentación de azúcares), sin embargo, rara vez se utilizan, principalmente debido a su baja productividad y la dificultad de separar la mezcla de productos resultante.
. Justificación de la elección del proceso tecnológico por el método de oxidación del etanol
Este método tiene una serie de cualidades positivas, tales como:
)Reactivos de partida baratos
)Alto rendimiento
)Costos de energía relativamente bajos (50-60 o DE)
)Altos rendimientos de reactivos iniciales
)Alta conversión y selectividad de proceso
)Separación de mezclas relativamente fácil
La reacción se lleva a cabo en una columna de burbujeo. Temperatura elevada necesario para evitar la reacción secundaria de formación de peróxidos (por lo que se puede formar una mezcla explosiva). El límite superior de temperatura está determinado por la volatilidad del acetaldehído. El ácido acético no es solo un producto de reacción, sino también un solvente, lo que simplifica enormemente el proceso.
Los principales indicadores tecnológicos del proceso se resumen en el siguiente cuadro:
. Esquema tecnológico del proceso.
A continuación se muestra un diagrama de flujo simplificado para la producción de ácido acético por oxidación de acetaldehído. Las designaciones dadas en el diagrama se resumen en tablas.
La mezcla inicial (I) ingresa al intercambiador de calor (1), donde se calienta a la temperatura de reacción (50-80 °C). El calentamiento se realiza calentando vapor (IX), que luego se elimina del espacio anular en forma de condensado (X). El suministro de aldehído se produce mediante bombas centrífugas (5) y se regula mediante válvulas.
El aldehído calentado entra en la columna de burbujeo (2) equipada con serpentines enfriadores (la reacción es exotérmica). Se inyecta oxígeno técnico (II) en la columna, comienza la oxidación del aldehído.
Los productos resultantes en forma de mezcla líquido-vapor se descargan por la parte superior de la columna y entran al distribuidor (4), luego de lo cual parte de la masa de reacción ingresa a la primera columna de destilación (3), diseñada para eliminar las impurezas volátiles ( gases de escape - VII). Además, el resto de la masa de reacción (IV) ingresa a la segunda columna, donde el ácido acético resultante (V) se descarga al consumidor o al almacén. El residuo de VAT (VI) que contiene diacetato de etilideno también se elimina de la columna. El acetaldehído (VIII) sin reaccionar se devuelve a la columna de burbujeo, lo que reduce la cantidad de aldehído requerida inicialmente para garantizar un rendimiento determinado (mayor conversión de materia prima). .
Tablas de corrientes principales y designaciones:
parte de liquidación
. Elaboración de un balance de materia
Elaborar un balance de materia es uno de los puntos principales en el cálculo de procesos tecnológicos. Su esencia radica en la ley de conservación de la masa (Llegada-Salida=0). Gracias a la formulación de ecuaciones mat. balance, puede operar con varios indicadores de proceso (concentraciones, flujos másicos, etc.) para optimizar el proceso.
Debe comenzar a compilar un balance con un diagrama simplificado en forma de bloques. Cada uno de los bloques incluirá la función principal: mezcla, oxidación o distribución. Para este proceso, el diagrama de flujo se verá así (la composición de los flujos se indica en la tabla anterior):
Así, se puede apreciar que el esquema tecnológico se divide en cuatro bloques principales:
1) Unidad de mezcla.
)Unidad de oxidación (directamente la propia columna de burbujeo).
)Bloque de separación (la primera columna de destilación, de la cual se eliminan las sustancias volátiles, los gases de escape).
)Bloque de separación y retorno de materias primas sin reaccionar al primer bloque.
En el segundo bloque, las masas se redistribuyen por transformaciones químicas según la reacción principal:
CH 3CHO + 0.5O 2 = CH 3DENU
y por dos Reacciones adversas formación de acetato de metilo y diacetato de etilideno, respectivamente:
CH 3CHO + 1.5O 2= CH 3CALMA 3+ CO2 + H 2O
CH 3CHO + O 2= CH 3CH(OOCH 3)2+ H 2O
Con base en la productividad dada para el producto y la selectividad y el grado de conversión del acetaldehído, la cantidad requerida de etanal se puede calcular usando la ecuación básica:
donde N es el número de moles del acetaldehído original necesarios para entrar en el primer reactor; M es la masa molar del producto (ácido acético); a y c son los coeficientes estequiométricos del reactivo y el producto,
Por lo tanto, el bloque 1 debería recibir 31,6265 kmol de acetaldehído. Cabe señalar que el acetaldehído ingresa tanto puro (original) como inverso (después del cuarto bloque) a través de la recirculación. El caudal másico es:
También calculamos la cantidad de subproductos formados:
a) acetato de metilo:
b) diacetato de etilideno:
Donde 0,5 y 0,33 factores de conversión (teniendo en cuenta la estequiometría de la reacción). Calcule la cantidad de oxígeno necesaria para la reacción (teniendo en cuenta su conversión, es decir, conversión no completa):
El oxígeno técnico contiene una pequeña cantidad de nitrógeno (2,5%), que debe tenerse en cuenta:
Aldehído sin reaccionar:
La cantidad de dióxido de carbono producido:
El agua formada por reacciones:
Hay que tener en cuenta que el agua también viene con la materia prima.
Aldehído (a la atmósfera):
Aldehído (en el bloque 4):
Dado que todo el aldehído que pasa al bloque 4 vuelve al bloque 1, ahora es posible calcular la cantidad de aldehído fresco que ingresa al primer bloque para mezclar:
Además de la cantidad de impurezas (ácido acético y agua) en el aldehído fresco:
La cantidad total de agua (por reacción y con aldehído fresco) es:
El ácido acético se forma como resultado de la reacción y cuando entra con aldehído fresco:
Se elimina parte del agua junto con ácido acético (0,2% en peso):
El balance de agua se compila de la siguiente manera: formado por la reacción + con aldehído fresco - con ácido - en la atmósfera = 0. Entonces:
Para mayor comodidad, todos los valores calculados se resumen en una tabla de flujo y una tabla de balance de materiales.
*Nota #1: El acetato de metilo tiene un punto de ebullición de 57°C y es altamente volátil, por lo que se elimina con los gases de escape, es decir, en el tercer bloque (la primera columna de destilación).
*Nota #2: También se debe tener en cuenta que hay una cantidad constante de ácido acético (como solvente) en la columna, y el acetaldehído se recicla.
Conclusión
aldehído ácido etanal
En conclusión, cabe señalar que este método es prácticamente el principal en la producción de ácido acético. Recientemente, ha sido reemplazado cada vez más por el método de Kolbe (carboxilación de alcohol metílico), que proporciona mayores rendimientos de reactivos de partida.
Este método también tiene desventajas, como, por ejemplo, la liberación de acetaldehído y acetato de metilo sin reaccionar a la atmósfera, el uso Alta presión sanguínea formación de subproductos, etc.
Sin embargo, alrededor del 50% de todo el ácido acético que se produce en el mundo se obtiene de esta forma, utilizando acetatos de manganeso (II) como catalizador. En general, este método es uno de los más convenientes y ventajosos para la tecnología.
El ácido acético es una de las materias primas más populares y utilizadas, y también tiene una gran demanda en las industrias alimentaria y química.
Lista de literatura usada
1) "Factor ambiental o ambiente como estímulo para la evolución de la química industrial". Roger A. Sheldon
) "Química Orgánica". Morrison R., Boyd R. 1974
) "Mecanismos de reacción en Química Orgánica". Sykes P., 1991
) "Colección de asignaciones y pautas para el cálculo del balance de materia de las industrias químicas y tecnológicas". MITO, 2008
Literatura adicional:
5) “Curso general de procesos y aparatos de tecnología química”. Einstein V.G., Zakharov M.K., 1999
) "Un breve libro de referencia de cantidades físicas y químicas". Ravdel AA, 1999
) "Esquemas de procesos químico-tecnológicos". Nosov G.A., Vyshnepolsky VI, Lapshenkov G.I., 2011
Longitud y distancia Masa Medidas de volumen de productos a granel y alimentos Área Volumen y unidades de medida en recetas Temperatura Presión, tensión mecánica, módulo de Young Energía y trabajo Potencia Fuerza Tiempo Velocidad lineal Ángulo plano Eficiencia térmica y eficiencia de combustible Números Unidades de medida de la cantidad de información Tasas de cambio Tallas de ropa y zapatos de mujer Tallas de ropa y zapatos de hombre Velocidad angular y rotación frecuencia Aceleración Aceleración angular Densidad Volumen específico Momento de inercia Momento de fuerza Torque Valor calorífico específico (en masa) Densidad de energía y poder calorífico específico del combustible (en volumen) Diferencia de temperatura Coeficiente de expansión térmica Resistencia térmica Conductividad térmica Capacidad calorífica específica Exposición energética, térmica potencia de radiación Densidad de flujo de calor Coeficiente de transferencia de calor Caudal volumétrico Caudal másico Caudal molar Densidad de caudal másico Concentración molar Concentración másica en solución Viscosidad dinámica (absoluta) Viscosidad cinemática Tensión superficial Permeabilidad al vapor permeabilidad, tasa de transferencia de vapor Nivel de sonido Sensibilidad del micrófono Nivel de presión de sonido (SPL) Brillo Intensidad luminosa Iluminación Resolución en gráficos de computadora Frecuencia y longitud de onda poder óptico en dioptrías y distancia focal Potencia en dioptrías y aumento de la lente (×) Carga eléctrica Densidad de carga lineal Densidad de carga superficial Densidad de carga global Electricidad Densidad de corriente lineal Densidad de corriente superficial Intensidad del campo eléctrico Tensión y potencial electrostático Resistencia eléctrica Resistividad eléctrica Conductividad eléctrica Conductividad eléctrica Capacitancia eléctrica Inductancia Calibre de cable americano Niveles en dBm (dBm o dBmW), dBV (dBV), vatios, etc. Unidades Fuerza magnetomotriz Campo magnético fuerza Flujo magnético Inducción magnética Tasa de dosis absorbida de radiación ionizante Radiactividad. Decaimiento radiactivo Radiación. Dosis de exposición Radiación. Dosis absorbida Prefijos decimales Transmisión de datos Tipografía y procesamiento de imágenes Unidades de volumen de madera Cálculo de masa molar Sistema periódico de elementos químicos de D. I. Mendeleev
Fórmula química
Masa molar of CH 3 COOH, ácido acético 60.05196 g/mol
12,0107+1,00794 3+12,0107+15,9994+15,9994+1,00794
Fracciones de masa de elementos en el compuesto.
Usando la calculadora de masa molar
- Las fórmulas químicas deben ingresarse con distinción entre mayúsculas y minúsculas
- Los índices se ingresan como números regulares
- El punto de la línea media (signo de multiplicación), utilizado, por ejemplo, en las fórmulas de hidratos cristalinos, se sustituye por un punto normal.
- Ejemplo: en lugar de CuSO₄ 5H₂O, el convertidor usa la ortografía CuSO4.5H2O para facilitar la entrada.
calculadora de masa molar
Topo
Todas las sustancias están formadas por átomos y moléculas. En química, es importante medir con precisión la masa de sustancias que entran en una reacción y resultan de ella. Por definición, un mol es la cantidad de una sustancia que contiene tantos elementos estructurales (átomos, moléculas, iones, electrones y otras partículas o sus grupos) como átomos hay en 12 gramos de un isótopo de carbono con una masa atómica relativa de 12 Este número se llama constante o número de Avogadro y es igual a 6,02214129(27)×10²³ mol⁻¹.
Número de Avogadro N A = 6,02214129(27)×10²³ mol⁻¹
En otras palabras, un mol es la cantidad de una sustancia igual en masa a la suma de las masas atómicas de los átomos y moléculas de la sustancia, multiplicada por el número de Avogadro. El mol es una de las siete unidades básicas del sistema SI y se denota por el mol. Dado que el nombre de la unidad y su símbolo son los mismos, cabe señalar que el símbolo no se declina, a diferencia del nombre de la unidad, que se puede declinar según reglas usuales Idioma ruso. Por definición, un mol de carbono-12 puro es exactamente 12 gramos.
Masa molar
La masa molar es una propiedad física de una sustancia, definida como la relación entre la masa de esa sustancia y la cantidad de la sustancia en moles. En otras palabras, es la masa de un mol de una sustancia. En el sistema SI, la unidad de masa molar es kilogramo/mol (kg/mol). Sin embargo, los químicos están acostumbrados a usar la unidad más conveniente g/mol.
masa molar = g/mol

Masa molar de elementos y compuestos.
Los compuestos son sustancias formadas por diferentes átomos que están químicamente unidos entre sí. Por ejemplo, las siguientes sustancias, que se pueden encontrar en la cocina de cualquier ama de casa, son compuestos químicos:
- sal (cloruro de sodio) NaCl
- azúcar (sacarosa) C₁₂H₂₂O₁₁
- vinagre (solución de ácido acético) CH₃COOH
La masa molar de los elementos químicos en gramos por mol es numéricamente igual a la masa de los átomos del elemento expresada en unidades de masa atómica (o daltons). La masa molar de los compuestos es igual a la suma de las masas molares de los elementos que componen el compuesto, teniendo en cuenta el número de átomos del compuesto. Por ejemplo, la masa molar del agua (H₂O) es aproximadamente 2 × 2 + 16 = 18 g/mol.
Masa molecular

El peso molecular (el antiguo nombre es peso molecular) es la masa de una molécula, calculada como la suma de las masas de cada átomo que forma la molécula, multiplicada por el número de átomos en esta molécula. El peso molecular es adimensional cantidad física, numéricamente igual a la masa molar. Eso es, masa molecular difiere de la masa molar en dimensión. Aunque el peso molecular es una cantidad adimensional, todavía tiene una cantidad llamada unidad de masa atómica (a.m.u.) o dalton (Da), y es aproximadamente igual a la masa un protón o un neutrón. La unidad de masa atómica también es numéricamente igual a 1 g/mol.
Artículos similares
-
Inglés - reloj, tiempo
Todos los que están interesados en aprender inglés han tenido que lidiar con designaciones extrañas p. metro. y un m , y en general, dondequiera que se mencione la hora, por alguna razón solo se usa el formato de 12 horas. Probablemente para nosotros viviendo...
-
"Alquimia en papel": recetas
Doodle Alchemy o Alchemy on paper para Android es un interesante juego de rompecabezas con hermosos gráficos y efectos. Aprende a jugar este increíble juego y encuentra combinaciones de elementos para completar Alchemy on Paper. El juego...
-
¿El juego falla en Batman: Arkham City?
Si se enfrenta al hecho de que Batman: Arkham City se ralentiza, se bloquea, Batman: Arkham City no se inicia, Batman: Arkham City no se instala, no hay controles en Batman: Arkham City, no hay sonido, aparecen errores arriba, en Batman:...
-
Cómo destetar a una persona de las máquinas tragamonedas Cómo destetar a una persona de los juegos de azar
Junto con un psicoterapeuta en la clínica Rehab Family en Moscú y un especialista en el tratamiento de la adicción al juego, Roman Gerasimov, Rating Bookmakers trazó el camino de un jugador en las apuestas deportivas, desde la formación de la adicción hasta la visita a un médico,...
-
Rebuses Entretenido rompecabezas rompecabezas adivinanzas
El juego "Acertijos Charadas Rebuses": la respuesta a la sección "Acertijos" Nivel 1 y 2 ● Ni un ratón, ni un pájaro: retoza en el bosque, vive en los árboles y roe nueces. ● Tres ojos - tres órdenes, rojo - el más peligroso. Nivel 3 y 4 ● Dos antenas por...
-
Condiciones de recepción de fondos por veneno.
CUÁNTO DINERO VA A LA CUENTA DE LA TARJETA SBERBANK Los parámetros importantes de las transacciones de pago son los términos y tasas para acreditar fondos. Estos criterios dependen principalmente del método de traducción elegido. ¿Cuáles son las condiciones para transferir dinero entre cuentas?
