Καρβοξυλικό οξύ. Ακόρεστα καρβοξυλικά οξέα
Διάλεξη Νο 10
Καρβοξυλικά οξέα
Το μόριο καρβοξυλικού οξέος περιέχει καρβοξυλική ομάδα
(καρβοξυλ). Το καρβοξυλ στην ένωση μπορεί να συσχετιστεί με μια ομάδα αλκυλίου (μέγιστο καρβοξυλικά οξέα) ή ένα υπόλειμμα αλκενίου (ακόρεστα καρβοξυλικά οξέα). Επιπλέον, ένα καρβοξυλικό οξύ μπορεί να περιέχει πολλά καρβοξυλικά. Εξαρτάται από τον αριθμό τους βασικότηταοξέα.
Περιορίστε τα μονοβασικά οξέα.
Τα ασήμαντα ονόματα των οξέων αντικατοπτρίζουν τη φυσική τους πηγή. Για παράδειγμα, τρία οξέα Από 6,8,10άτομα άνθρακα απομονώθηκαν από προϊόντα υδρόλυσης βουτύρου από κατσικίσιο λίποςκαι ονομάζονται αντίστοιχα καπροϊκό, καπρυλικό και καπρικό οξύ (από το λατινικό κάππαρη– κατσίκα).
Οξέα και τα ονόματά τους σύμφωνα με ασήμαντες και συστηματικές ονοματολογίες
Σύμφωνα με τη συστηματική ονοματολογία, ένα καρβοξυλικό οξύ παίρνει το όνομά του από το όνομα του αντίστοιχου υδρογονάνθρακα με τη μεγαλύτερη αλυσίδα ατόμων άνθρακα. Η αλυσίδα είναι αριθμημένη, ξεκινώντας από τον καρβοξυλικό άνθρακα. Το όνομα υποδεικνύει τις υποκαταστάτες ρίζες και τη θέση τους.
Θα πρέπει να σημειωθεί ότι ορισμένα οξέα με μεγάλο αριθμό ανθράκων στο μόριο ταξινομούνται ως ανώτερα λιπαρά οξέα (για παράδειγμα, παλμιτικό και στεατικό). Αυτό το όνομα καλύπτει φυσικά οξέα ευθείας αλυσίδας που βρίσκονται με τη μορφή εστέρων στα λίπη, τα κεριά και τα έλαια φυτών και ζώων.
Όταν μια ομάδα υδροξυλίου αφαιρείται από ένα καρβοξυλικό, λαμβάνονται μονοσθενή υπολείμματα οξέος. ή ακύλια,και πότε άντληση υδρογόνου - το λεγόμενο ακυλικόομάδες
H-CO-φορμυλ H-COO-μυρμηκικός
CH 3 CO-ακετυλ CH 3 COO-οξικό
CH 3 CH 2 CO-προπιονυλ CH 3 CH 2 COO-προπιονικό
CH 3 CH 2 CH 2 CO-βουτυρυλ CH 3 CH 2 CH 2 COO - βουτυρικό
CH 3 CH 2 CH 2 CH 2 CO-valeryl CH 3 CH 2 CH 2 CH 2 CO-valeric
Τα ονόματα των παραγώγων καρβοξυλικού οξέος σχετίζονται με τα ονόματα των ίδιων των οξέων. Ο τρόπος σύνθεσης των ονομάτων των παραγώγων οξέος φαίνεται από τα παρακάτω παραδείγματα.
CH 3 COOH CH 3 COONa CH 3 COCl
οξικό οξύοξικό νάτριο ακετυλοχλωρίδιο
αιθάνιο νέος όξινο αιθάνιο βρόμη αιθάνιο νατρίου έλαιο χλωριούχο
(CH 3 CO) 2 O CH 3 CH 2 OCOCH 3 CH 3 CONN 2
οξικός ανυδρίτης οξικός αιθυλεστέρας ακεταμίδιο
αιθανοανυδρίτης αιθυλαιθάνιο βρόμη αιθαναμίδιο
CH 3 CONCHN 3 CH 3 CN
Ν-μεθυλακεταμίδιο ακετονιτρίλιο
Ν-μεθυλαιθαναμίδιο αιθανιτρίλιο
1.2. Μέθοδοι παραλαβής.
Αυτές είναι αντιδράσεις οξείδωσηαλκάνια, αλκένια και αλκίνια, πρωτοταγείς αλκοόλες και αλδεΰδες, υδρόλυση παράγωγα αλογόνου με τρία αλογόνα σε ένα άνθρακας και παράγωγα καρβοξυλικών οξέων: νιτρίλια, σύμπλοκο εστέρες, ορθοεστέρες, ανυδρίτες, αλογονίδια οξέων και αμίδια. και τα λοιπά.
1.2. Φυσικές ιδιότητες.
Μία από τις εκπληκτικές ιδιότητες των καρβοξυλικών οξέων είναι υψηλή θερμοκρασίαβρασμός. Για σύγκριση, παρακάτω είναι τα σημεία βρασμού ορισμένων ενώσεων (0 C)
ακεταλδεΰδη 21
οξικός αιθυλεστέρας 77
οξικό οξύ 118
Τα οξέα έχουν ακόμη υψηλότερα σημεία βρασμού από τις αλκοόλες. Αυτό είναι ήδη δύσκολο να εξηγηθεί μόνο από την εμφάνιση δεσμών υδρογόνου μεταξύ μορίων οξέος. Τα μόρια των καρβοξυλικών οξέων μπορούν να συνδεθούν μεταξύ τους όχι με έναν, αλλά με δύο δεσμούς υδρογόνου
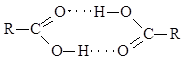
Ως αποτέλεσμα, δύο μόρια οξέος συνδέονται τόσο σφιχτά που υπάρχουν με τη μορφή διμερούς όχι μόνο στην υγρή ή στερεή φάση, αλλά ακόμη και στον ατμό.
Η υψηλή διαλυτότητα των κατώτερων οξέων στο νερό εξηγείται επίσης από το σχηματισμό δεσμών υδρογόνου που περιλαμβάνουν μόρια οξέος και διαλύτη. Σε αυτή την περίπτωση, τα μόρια του νερού σφηνώνονται μεταξύ των μορίων του καρβοξυλικού οξέος
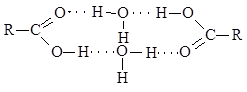
Χημικές ιδιότητες.
Οι χημικές ιδιότητες των καρβοξυλικών οξέων καθορίζονται από την παρουσία τους στο μόριό τους καρβοξυλική ομάδα, που είναι ένας συνδυασμός ομάδες καρβονυλίου και υδροξυλίου. Ταυτόχρονα, οι χημικές ιδιότητες των καρβοξυλικών οξέων δεν είναι απλώς ένας συνδυασμός ιδιοτήτων που είναι εγγενείς σε αλκοόλες και καρβονυλικές ενώσεις, είναι επίσης μια νέα ποιότητα.
1.3.1. Οξύτητα. Σχηματισμός αλάτων.
Τα μονοβασικά κορεσμένα καρβοξυλικά οξέα είναι, αν και αδύναμα, αλλά «πραγματικά» οξέα - μπορούν να ανιχνευθούν χρησιμοποιώντας χαρτί λακκούβας.
Όντας οξέα, τα καρβοξυλικά οξέα χρησιμεύουν ως πηγή πρωτονίων, επομένως, είναι ικανά να ιονίζονται. Σε ένα υδατικό διάλυμα, ένα οξύ ιονίζεται σύμφωνα με την εξίσωση
Αποκαθίσταται ισορροπία μεταξύ του οξέος και του καρβοξυλικού ανιόντος και του πρωτονίου. Σταθερά ισορροπίας Κ α(σταθερά οξύτητας, οξύ) συγκέντρωση δέσμευσης, υπολογισμένη με βάση την εξίσωση
Είμαι στην οξύτητα;
Ο ιονισμός της αιθανόλης και του οξικού οξέος συμβαίνει με το σχηματισμό αλκοολικών και καρβοξυλικών ανιόντων, αντίστοιχα.
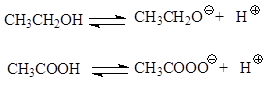
Το ισχυρότερο μεταξύ των καρβοξυλικών οξέων είναι το μυρμηκικό οξύ. Η εμφάνιση μιας μεθυλικής ρίζας που δίνει ηλεκτρόνια στην καρβοξυλική ομάδα αντί για υδρογόνο οδηγεί σε εξασθένηση της οξύτητας κατά σχεδόν δέκα φορές. Όταν τα άτομα υδρογόνου στην ομάδα του μεθυλίου αντικαθίστανται από αλογόνα, εμφανίζεται ένας υποκαταστάτης που αποσπά ηλεκτρόνια, ο οποίος αυξάνει την οξύτητα. Η σειρά της οξύτητας αλλάζει (10 5 Κ α) ενός αριθμού οξέων επιβεβαιώνει αυτό που ειπώθηκε
CH 3 COOH 1,75
ClCH 2 COOH 136
Cl 2 CHCOOH 5530
Cl 3 ССООН 23200
CH 3 CH 2 CH 2 COOH 1,52
CH 3 CH 2 CHClCOOH 139
CH 3 CHClCH 2 COOH 8.9
CH 2 ClCH 2 CH 2 COOH 2,96
Έτσι, τα καρβοξυλικά οξέα είναι αδύναμα οξέα και αντιδρούν με αλκάλια για να δώσουν άλατα
Κατά την πυρόλυση αλάτων αλκαλιμετάλλων με τη συμμετοχή καυστικών αλκαλίων συμβαίνει αποκαρβοξυλίωση και σχηματισμός αλκανίων. Η πυρόλυση αλάτων ασβεστίου ή βαρίου απουσία αλκαλίων οδηγεί σε αλδεΰδες και κετόνες (αντίδραση Piria). Η ηλεκτρόλυση των αλάτων νατρίου των καρβοξυλικών οξέων καθιστά δυνατή τη λήψη ενώσεων, για παράδειγμα, αλκανίων, που περιέχουν διπλάσιο αριθμό υποκαταστατών στο καρβοξυλικό οξύ (αντίδραση Kolbe). Όταν συζητάμε τα άλατα των καρβοξυλικών οξέων, δεν μπορούμε να παραλείψουμε να σημειώσουμε τη διαρκή σημασία των αλάτων αλκαλιμετάλλων ανώτερων λιπαρών οξέων (στεατικό νάτριο) όπως απορρυπαντικά.
1.3.2. Σχηματισμός ακυλαλογονιδίων.
Αλογονίδια καρβοξυλικών οξέων.
Τα αλογονίδια καρβοξυλικών οξέων, συνήθως χλωριούχα οξέος, λαμβάνονται εύκολα με αντίδραση οξέων με τρι- ή πενταχλωριούχο φώσφορο, θειονυλοχλωρίδιο και φωσγένιο
Από όλα τα παράγωγα καρβοξυλικού οξέος, τα ακυλαλογονίδια παρουσιάζουν τη μεγαλύτερη αντιδραστικότητα. Αυτό οφείλεται στην υψηλή κινητικότητα του αλογόνου σε αυτές τις ενώσεις.
Οι αντιδράσεις των αλογονιδίων οξέων προχωρούν ως αντιδράσεις πυρηνόφιλης υποκατάστασης αλογόνου και οδηγούν στην παραγωγή άλλων παραγώγων οξέος

Σε όλες αυτές τις αντιδράσεις ένα όξινο υπόλειμμα εισάγεται στο μόριο - ακύλιο, άρα το κοινό τους όνομα είναι αντιδράσεις ακυλίωσης. Τα αλογονίδια καρβοξυλικού οξέος είναι οι καλύτεροι παράγοντες ακυλίωσης.
αντίδραση αρχίζει με την πυρηνόφιλη προσθήκη στην καρβονυλική ομάδα στο αλογονίδιο του οξέος, όπως στην περίπτωση των αλδεΰδων και των κετονών
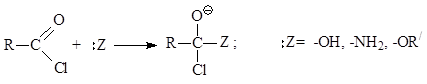
Το ενδιάμεσο της προσθήκης ενός πυρηνόφιλου σε ένα αλοακύλιο εξαλείφει ένα άτομο αλογόνου, δημιουργεί μια ομάδα καρβονυλίου και δίνει το προϊόν υποκατάστασης

Η πυρηνόφιλη υποκατάσταση στα αλογονοκύλια είναι εμφανής. Στην πραγματικότητα, η αντίδραση εμφανίζεται ως «προσθήκη-εξάλειψη». Το άτομο αλογόνου στα αλογονίδια οξέος αντικαθίσταται όχι επειδή είναι κινητό, αλλά επειδή είναι μέρος μιας λειτουργικής ομάδας ικανής για αντίδραση προσθήκης.
1.3.3. Σχηματισμός ανυδριδίων.
Μια κοινή μέθοδος για την παρασκευή ανυδριδίων είναι η αντίδραση αλάτων οξέος με αλογονίδια οξέος
Η αντίδραση των καρβοξυλικών οξέων με αλογονοκύλια παρουσία πυριδίνης οδηγεί επίσης σε ανυδρίτες
Τέλος, σημειώνουμε ότι οι ανυδρίτες λαμβάνονται τόσο από καρβοξυλικά οξέα όσο και από κετένιο
Οι ανυδρίτες οξέων, όπως και τα αλογονοκύλια, χρησιμοποιούνται σε αντιδράσεις ακυλίωσης. Οι ανυδρίτες οξέων είναι ήπια αντιδραστήρια.
Η ακυλίωση με ανυδρίτες οξέων, η οποία προχωρά παρόμοια με την αντίδραση που μόλις συζητήθηκε σχετικά με αλογονοκύλια, παράγει άλλα παράγωγα καρβοξυλικού οξέος
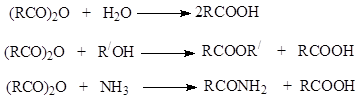
1.3.4. Εστεροποίηση. Εστέρες.
Οι εστέρες σχηματίζονται από μια αντίδραση μεταξύ καρβοξυλικών οξέων και αλκοολών παρουσία ενός όξινου καταλύτη, ο οποίος ονομάζεται αντίδραση εστεροποίησης
Αυτή η επιλογή αντίδρασης συνήθως ονομάζεται εστεροποίηση σύμφωνα με Φίσερ(Fisher, 1895).
Η εστεροποίηση επηρεάζεται από χωρικούς παράγοντες. Εάν υπάρχουν ογκώδεις ομάδες συμμετεχόντων στην αντίδραση κοντά στο κέντρο αντίδρασης, τότε ο ρυθμός εστεροποίησης επιβραδύνεται.
Η εστεροποίηση Fischer προχωρά ως πυρηνόφιλη ακυλική υποκατάσταση χρησιμοποιώντας τον μηχανισμό "προσθήκη-εξάλειψης"
Κατά την ακυλίωση των αλκοολών, χρησιμοποιούνται συχνά πιο δραστικά αλογονοκύλια και ανυδρίτες οξέων αντί των καρβοξυλικών οξέων.
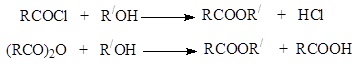
Σε περιπτώσεις όπου, για τον ένα ή τον άλλο λόγο, η σύνθεση εστέρων με ακυλίωση είναι δύσκολη, χρησιμοποιούνται άλλες μέθοδοι: αντικατάσταση του αλογόνου σε αλογονοαλκύλια με καρβοξυλικό ανιόν χρησιμοποιώντας άλατα αργύρου καρβοξυλικών οξέων ή άμεση προσθήκη οξέων σε ενεργά αλκένια:
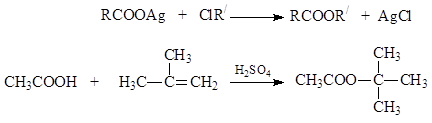
Υπάρχει επίσης μια γνωστή μέθοδος για την παρασκευή μεθυλεστέρων με αντίδραση καρβοξυλικών οξέων με διαζωμεθάνιο σε αιθέριο διάλυμα
Οι εστέρες είναι ικανοί για πολλούς μετασχηματισμούς.
1.3.4.1. Υδρόλυση.
Όταν αλληλεπιδρούν με το νερό, οι εστέρες υδρολύονται.
Ο μηχανισμός της υδρόλυσης περιλαμβάνει μια αντίδραση που περιλαμβάνει τη διάσπαση του δεσμού ακυλίου-οξυγόνου. Αυτό καθορίστηκε με βάση τα αποτελέσματα πειραμάτων για την υδρόλυση του εστέρα με νερό που περιέχει το ισότοπο οξυγόνου O18
Αποδείχθηκε ότι κατά την υδρόλυση το ισότοπο οξυγόνου περιλαμβάνεται στη σύνθεση του καρβοξυλικού οξέος. Αυτό δείχνει ξεκάθαρα την εμφάνιση μιας αντίδρασης υδρόλυσης με τη διάσπαση του δεσμού οξυγόνου-ακυλίου.
Σε αντίθεση με την εστεροποίηση, η υδρόλυση των εστέρων καταλύεται επίσης από βάσεις (σαπωνοποίηση). Με βάση στερεοχημικές μελέτες και τα αποτελέσματα πειραμάτων με χρήση O 18, διαπιστώθηκε ότι σε αυτή την περίπτωση πραγματοποιείται ο μηχανισμός «προσθήκη-εξάλειψης», ο οποίος συμβαίνει με τη ρήξη του δεσμού ακυλίου-οξυγόνου.

Ένας όξινος καταλύτης καταλύει τόσο την εστεροποίηση όσο και την αντίστροφη αντίδραση, την υδρόλυση. Ο κύριος καταλύτης είναι μόνο η υδρόλυση. Τίθεται το ερώτημα, γιατί ο κύριος καταλύτης δεν καταλύει την εστεροποίηση;
1.3.4.2. Μετεστεροποίηση. Όταν ένας εστέρας αντιδρά με περίσσεια αλκοόλης παρουσία οξέων ή βάσεων, ένα αλκύλιο στον αιθέρα αντικαθίσταται από ένα άλλο. Από τον έναν αιθέρα προέρχεται ο άλλος, συμβαίνει μετεστεροποίηση
Ως άλλο παράδειγμα, επισημαίνουμε τη χρήση μετεστεροποίησης για την παραγωγή πολυβινυλικής αλκοόλης, η οποία δεν μπορεί να ληφθεί απευθείας με πολυμερισμό βινυλικής αλκοόλης. Όταν μετεστεροποιείται με μεθανόλη, το πολυμερές παράγει σταθερή πολυβινυλική αλκοόλη και οξικό μεθυλεστέρα
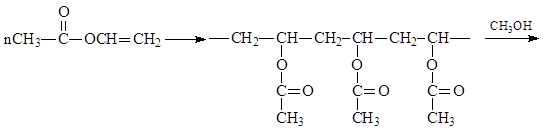
1.3.4.3. Αντίδραση με αντιδραστήριο Grignard. Αυτή η αντίδραση έχει ήδη αναφερθεί ως μέθοδος παρασκευής τριτοταγών αλκοολών. Προχωρά σύμφωνα με το γενικό σχήμα ως πυρηνόφιλη υποκατάσταση μέσω της πυρηνόφιλης προσθήκης της αλκυλικής ομάδας του αντιδραστηρίου Grignard στον άνθρακα με ανεπάρκεια ηλεκτρονίων της καρβονυλικής ομάδας του αιθέρα. Το προκύπτον ανιόν Ι μπορεί να αντιδράσει με Mg + Br για να σχηματίσει το αλκοξείδιο II ή να εξαλείψει την αλκοξυ ομάδα για να σχηματίσει μια κετόνη.

Διακριτικό χαρακτηριστικόΗ μέθοδος που εξετάζεται για τη σύνθεση τριτοταγών αλκοολών είναι ότι αυτή παράγει αλκοόλες με δύο πανομοιότυπα υπολείμματα υδρογονάνθρακα στον άνθρακα της ομάδας υδροξυλίου.
Η χρήση μυρμηκικών σε αντιδράσεις με αντιδραστήρια Grignard καθιστά δυνατή τη λήψη δευτεροταγών αλκοολών.
1.3.4.4. Αμμωνόλυση. Αντίδραση εστέρων με αμμωνία Σε αυτή την περίπτωση, η αποχωρούσα αλκοξυ ομάδα αντικαθίσταται από μια αμινομάδα και σχηματίζεται ένα αμίδιο καρβοξυλικού οξέος
1.3.4.5. Ανάκτηση. Ως αποτέλεσμα της αναγωγής των εστέρων, που συνοδεύεται από τη ρήξη του δεσμού μεταξύ του οξυγόνου και του υπολείμματος οξέος, λαμβάνονται δύο αλκοόλες.
Η αναγωγή μπορεί να πραγματοποιηθεί με ατομικό υδρογόνο χρησιμοποιώντας μέταλλο νατρίου και αλκοόλη χαμηλού βρασμού (μέθοδος Bouveau and Blanc)
Πρόσφατα, η αναγωγή προτιμήθηκε με υδρίδιο λιθίου αργιλίου.
Στη βιομηχανία, η υδρογονόλυση πραγματοποιείται συχνότερα σε καταλυτική έκδοση με μοριακό υδρογόνο υπό πίεση. Έχει αποδειχθεί καλά ως καταλύτης χρωμίτης χαλκού(μίγμα οξειδίων με κατά προσέγγιση σύνθεση CuO. CuCr 2 O 4).
1.3.4.6. Συμπύκνωση εστέρα. Οι εστέρες, οι οποίοι έχουν άτομα υδρογόνου στον άνθρακα δίπλα στην καρβοξυλομάδα, είναι ικανοί να υποστούν μια αντίδραση συμπύκνωσης παρουσία αλκοολικών ( Claisen)
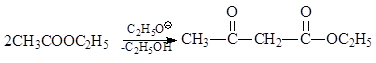
Σε αυτόν τον αιθέρα, τα άτομα υδρογόνου της ομάδας μεθυλενίου που βρίσκεται μεταξύ των δύο καρβονυλίων γίνονται τόσο όξινα που καθίσταται δυνατό για τον ακετοξικό εστέρα να εκτοπίσει την αιθανόλη από το άλας του για να σχηματίσει ακετοξικό εστέρα.
1.3.4.7. Οι εστέρες αποτελούν τη βάση τόσο σημαντικών φυσικών προϊόντων όπως τα λίπη και τα έλαια - αυτοί είναι εστέρες γλυκερόλης και κορεσμένα και ακόρεστα μη διακλαδισμένα καρβοξυλικά οξέα με αριθμό ατόμων άνθρακα από 3 έως 18. Αυτά τα οξέα αποτελούνται κυρίως από ζυγό αριθμό ατόμων άνθρακα, οι περιττοί μόνο οξέα με τρία βρίσκονται και πέντε άνθρακες. Τα λίπη και τα έλαια είναι ένα πολύπλοκο μείγμα γλυκεριδίων, για παράδειγμα, αυτό που ονομάζεται βούτυρο είναι ένα γλυκερίδιο 14 καρβοξυλικών οξέων (σύνθεση λιπών και ελαίων - Πίνακας 1.3.4). Τα γλυκερίδια που είναι στερεά σε θερμοκρασία δωματίου ταξινομούνται ως λίπη, ενώ τα υγρά γλυκερίδια ταξινομούνται ως έλαια.
Τα λίπη έχουν χρησιμοποιηθεί από καιρό ως προϊόν έναρξης για την παραγωγή αλάτων καρβοξυλικών οξέων και αλκαλικών μετάλλων (σαπούνι). Δεδομένου ότι η διαδικασία παράγει σαπούνια, ονομάζεται σαπωνοποίηση.
 1.3.5. Αμίδια καρβοξυλικών οξέων.
1.3.5. Αμίδια καρβοξυλικών οξέων.
Οι ενώσεις στις οποίες το υδροξύλιο της καρβοξυλικής ομάδας αντικαθίσταται από ένα υπόλειμμα αμμωνίας - μια αμινομάδα - ή από μια υποκατεστημένη αμινομάδα ονομάζονται αμίδια.
Τα αμίδια πρέπει να λαμβάνονται με αντίδραση ενός καρβοξυλικού οξέος με αμμωνία. Ωστόσο, ως αποτέλεσμα αυτής της αντίδρασης, δεν λαμβάνεται το αμίδιο, αλλά το άλας αμμωνίου του οξέος
Η παρασκευή των αμιδίων επιτυγχάνεται με θέρμανση του αλατιού και απομάκρυνση του νερού με απόσταξη
Η αντίδραση των αλογονοακυλίων με την αμμωνία και τα παράγωγά της προχωρά χωρίς επιπλοκές, γρήγορα και με υψηλή απόδοση.
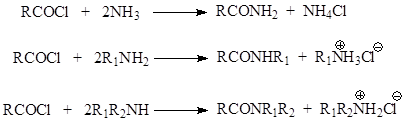
Οι ανυδρίτες και οι εστέρες οξέων μπορούν να χρησιμοποιηθούν με επιτυχία για τη σύνθεση αμιδίων.
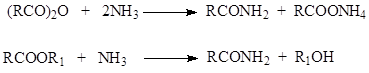
Όπως και άλλα παράγωγα καρβοξυλικών οξέων, τα αμίδια υδρολύονται υπό την καταλυτική δράση τόσο των οξέων όσο και των βάσεων

Και αυτή η αντίδραση προχωρά ως πυρηνόφιλη υποκατάσταση «μέσω της προσθήκης». Τα ορυκτά οξέα το καταλύουν πρωτονίζοντας το καρβονυλικό οξυγόνο και δημιουργώντας ένα θετικό φορτίο στον άνθρακα. Αυτό προάγει την πυρηνόφιλη επίθεση σε αυτόν τον άνθρακα

Η βασική κατάλυση της υδρόλυσης αμιδίων καρβοξυλικού οξέος προχωρά σύμφωνα με το ακόλουθο σχήμα
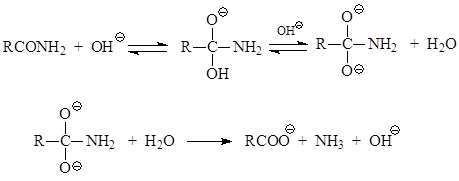
Σημαντική θέση κατέχει η διάσπασή τους σε Χόφμαν, η οποία εμφανίζεται υπό την επίδραση υποχλωριωδών ή υποβρωμιτών. Αυτό παράγει πρωτοταγείς αμίνες με τον αριθμό των ατόμων άνθρακα κατά 1 άνθρακα μικρότερο από το αρχικό αμίδιο
Τα αμίδια των καρβοξυλικών οξέων, όταν θερμαίνονται με παράγοντες αφαίρεσης νερού, για παράδειγμα, πεντοξείδιο του φωσφόρου, χάνουν ένα μόριο νερού και μετατρέπονται σε όξινα νιτρίλια
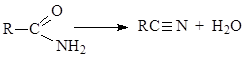
1.3.6. Νιτρίλια καρβοξυλικών οξέων.
Τα νιτρίλια είναι ίσως τα μόνα παράγωγα καρβοξυλικών οξέων που δεν περιέχουν καρβονυλική ομάδα στο μόριό τους
λήψη νιτριλίων - η αντίδραση αλκυλαλογονιδίων με ιόν κυανιδίου, η προσθήκη υδροκυανιδίου σε αλκύνια και καρβονυλικές ενώσεις, η αφυδάτωση αμιδίων καρβοξυλικού οξέος που μόλις συζητήθηκε.
Η υδρόλυση των νιτριλίων έχει μεγάλη σημασία ως μέθοδος παραγωγής καρβοξυλικών οξέων. Αυτή η αντίδραση συμβαίνει τόσο σε αλκαλικό όσο και σε όξινο περιβάλλον

Σε ένα όξινο περιβάλλον, τα νιτρίλια υδρολύονται σε δύο στάδια: πρώτα σε αμίδια και μετά αμίδια σε καρβοξυλικά οξέα
Η υδρόλυση αμιδίου συζητήθηκε στην Ενότητα 1.3.5.
Μεταξύ άλλων αντιδράσεων νιτριλίων, η υδρογόνωση σε αμίνες και οι αντιδράσεις που περιλαμβάνουν άτομα α-υδρογόνου, για παράδειγμα, αλκυλίωση, παρουσιάζουν ενδιαφέρον.
ρε καρβοξυλίωση - χωρίζονταςαπό ένα μόριο καρβοξυλικού οξέος διοξείδιο του άνθρακακαι ο σχηματισμός υδρογονάνθρακα που περιέχει έναν άνθρακα λιγότερο από το αρχικό οξύ
Ηλεκτρόλυσηάλατα καρβοξυλικών οξέων σύμφωνα με τον Kolbe– συμβαίνει σχηματισμός υδρογονάνθρακα με μεγάλο αριθμό ατόμων άνθρακα
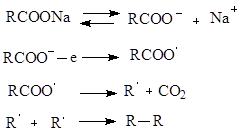
Οι αντιδράσεις αποκαρβοξυλίωσης περιλαμβάνουν επίσης πυρόλυση αλάτων ασβεστίου ή βαρίου των καρβοξυλικών οξέων με Πειριάμε το σχηματισμό καρβονυλικών ενώσεων.
1.3.8. Αλογόνωση καρβοξυλικών οξέων στη θέση α.
Αντίδραση Gehl–Volhard–Zelinskyεμφανίζεται κατά την αλογόνωση των οξέων παρουσία μικρών ποσοτήτων φωσφόρου
Άλλα άτομα α-υδρογόνου, εάν υπάρχουν, μπορούν επίσης να αντικατασταθούν από αλογόνο. Ένα παράδειγμα είναι η παραγωγή τριχλωροξικού οξέος.
Η αντίδραση Gel–Volhard–Zelinsky προχωρά με υψηλή απόδοση αλογονωμένων οξέων. Μέσω οξέων υποκατεστημένων με α-αλογόνο, μπορούν να ληφθούν πολλά παράγωγα καρβοξυλικών οξέων: υδροξυ και αμινοξέα, ακόρεστα οξέα κ.λπ.
Διάλεξη Νο 11
2. Ακόρεστα καρβοξυλικά οξέα.
Τα ακόρεστα καρβοξυλικά οξέα περιέχουν διπλούς ή τριπλούς δεσμούς και καρβοξυλικές ομάδες στο μόριό τους. Εδώ είναι τα πιο κοινά ακόρεστα οξέα και τα ονόματά τους:
CH 2 = CHCOOH ακρυλικό οξύ, προπενοϊκό οξύ
CH 3 CH=CHCOOH κροτονικό οξύ, 2-βουτενοϊκό οξύ
cis-CH 3 (CH 2) 7 CH=CH (CH 2) 7 COOH ελαϊκό οξύ
έκσταση-CH 3 (CH 2) 7 CH=CH(CH 2) 7 COOH ελαϊδικό οξύ
CH 3 (CH 2) 4 CH=CHCH 2 CH=CH(CH 2) 7 COOH λινολεϊκό οξύ
CH 3 CH 2 CH=CHCH 2 CH=CHCH 2 CH=CH(CH 2) 7 COOH λινολενικό οξύ
cis-HOOCCH=CHCOOH μηλεϊνικό οξύ, cis-βουτενοδιοϊκό οξύ
έκσταση-HOOCCH=CHCOOH φουμαρικό οξύ, trans-βουτενοδιοϊκό οξύ
Τα ακόρεστα καρβοξυλικά οξέα, στα οποία ο διπλός δεσμός και η καρβοξυλική ομάδα απομακρύνονται μεταξύ τους, εμφανίζουν τις συνήθεις ιδιότητες που είναι εγγενείς στα αλκένια και τα καρβοξυλικά οξέα. Επομένως σε αυτή την ενότητα Θα ληφθούν υπόψη μόνο τέτοια ακόρεστα καρβοξυλικά οξέα στα οποία οι λειτουργικές ομάδες είναι συζευγμένες και επηρεάζουν η μία την άλλη
Ο σημαντικότερος εκπρόσωπος των ακόρεστων καρβοξυλικών οξέων είναι ακρυλικόοξύ. Ένας αριθμός μεθόδων για τη σύνθεση αυτού του οξέος έχει προταθεί. Σύμφωνα με έναν από αυτούς από αιθυλενοχλωροϋδρίνη ή αιθυλενοξείδιοΛαμβάνεται το νιτρίλιο υδροξυπροπιονικού οξέος, το οποίο, κατά την όξινη υδρόλυση που συνοδεύεται από αφυδάτωση, μετατρέπεται σε ακρυλικό οξύ
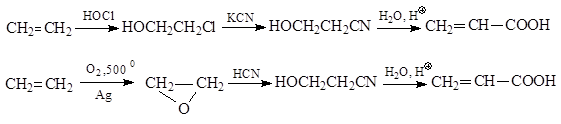
Βασίζονται άλλες μέθοδοι για τη σύνθεση ακρυλικού οξέος για τους μετασχηματισμούς της ακετυλίνης.Στην περίπτωση αυτή, είτε με προσθήκη υδροκυανικού οξέος, λαμβάνεται ακρυλονιτρίλιο και υδρολύεται, είτε χρησιμοποιείται η αντίδραση οξοσύνθεσης
Ο συνήθης τρόπος λήψης μεθακρυλικού οξέος είναι η προσθήκη υδροκυανικού οξέος στην ακετόνη, ακολουθούμενη από υδρόλυση και αφυδάτωση της κυανοϋδρίνης που προκύπτει
Ένας άλλος εκπρόσωπος των ακόρεστων οξέων, το κροτονικό οξύ, μπορεί να ληφθεί με οξείδωση κροτοναλδεΰδη, που είναι προϊόν συμπύκνωση κρότωνα ακεταλδεΰδης. Αυτό το οξύ μπορεί επίσης να ληφθεί από Αντιδράσεις Knoevenagelσυμπύκνωση ακεταλδεΰδης με μηλονικό οξύ παρουσία πυριδίνης, ακολουθούμενη από αποκαρβοξυλίωση του υποκατεστημένου μηλονικού οξέος
Μια χαρακτηριστική ιδιότητα των ενώσεων που περιέχουν διπλό δεσμό άνθρακα-άνθρακα είναι η ικανότητα να εισχωρούν επιπλέον αντίδραση. Συγχρόνως ανοίγει ο ασθενής π δεσμός καιαντί για αυτήν προκύπτουν δύο ισχυροί δεσμοί σ., Τα ακόρεστα καρβοξυλικά οξέα υφίστανται ηλεκτροφιλικές αντιδράσεις προσθήκης, αλλά χειρότερες από τα αλκένια. Επίσης υφίστανται πυρηνόφιλες αντιδράσεις προσθήκης.
Ηλεκτροφιλική σύνδεση. Εξετάστε την αντίδραση του ακρυλικού οξέος με το υδροχλώριο. Αν πρώτο στάδιοΑυτή η αντίδραση - η πρωτονίωση - μπορεί απλά να φανταστεί ως προσθήκη πρωτονίου στον άνθρακα ενός διπλού δεσμού, τότε ως αποτέλεσμα είναι δυνατός ο σχηματισμός ιόντων I και II. Είναι αρκετά δύσκολο να κρίνουμε τη σταθερότητα αυτών των ιόντων. Εάν το I είναι πρωτογενές, τότε το II, αν και δευτερογενές, αποσταθεροποιείται από τη γειτονική καρβοξυλική ομάδα
Το ακρυλικό οξύ είναι συζευγμένο σύστημα διπλών δεσμών όπως στο μόριο βουταδιενίου. Σύμφωνα με τη δομή του, το ακρυλικό οξύ μπορεί πρωτονίου στα τερματικά άτομασυζευγμένο σύστημα με το σχηματισμό του II ξανά και ένα συντονισμένα σταθεροποιημένο καρβοκατιόν, που αντιπροσωπεύεται από τις δομές III και IV
Η επακόλουθη προσθήκη ενός ανιόντος χλωρίου στο IV θα δώσει την ενολική μορφή του προϊόντος της αντίδρασης, η οποία εισέρχεται σε ταυτομερή σχέση με την κετομορφή του
Σύμφωνα με τις σύγχρονες έννοιες, ο κανόνας του Markovnikov ερμηνεύεται ως μια ιοντική προσθήκη σε έναν δεσμό C=C, ο οποίος συμβαίνει με το σχηματισμό ενός πιο σταθερού καρβοκατιόντος. Αυτό ακριβώς συμβαίνει κατά την ηλεκτρόφιλη προσθήκη σε α, β-ακόρεστα καρβοξυλικά οξέα. Συμβαίνουν επίσης και άλλες αντιδράσεις του υπό εξέταση τύπου, για παράδειγμα, ενυδάτωση
Ετσι, η καρβοξυλική ομάδα σε διπλό δεσμό όχι μόνο μειώνει την αντιδραστικότητά της σε σχέση με τα ηλεκτρόφιλα αντιδραστήρια, αλλά επηρεάζει επίσης την κατεύθυνση της προσθήκης.
Πυρηνόφιλη προσθήκη. Λόγω της ενεργοποίησης της καρβοξυλικής ομάδας, τα α, β - ακόρεστα καρβοξυλικά οξέα εισέρχονται πολύ εύκολα σε πυρηνόφιλες αντιδράσεις προσθήκης. Παραδείγματα θα μπορούσαν να είναι προσθήκη σε ακρυλικό οξύ αμμωνία , υδροξυλαμίνη και υδροκυανικό οξύ

Ο προτεινόμενος μηχανισμός πυρηνόφιλης προσθήκης σε ακόρεστα καρβοξυλικά οξέα είναι ο ακόλουθος
Το πυρηνόφιλο αντιδραστήριο προσκολλάται στο τερματικό άτομο του συζευγμένου συστήματοςμε το σχηματισμό ενός συντονισμένα σταθεροποιημένου καρβανιόν, που στο επόμενο στάδιο της αντίδρασης αφαιρεί ένα πρωτόνιοαπό μόριο διαλύτη και μετατρέπεται σε προϊόν.
Οι αντιδράσεις της πυρηνόφιλης προσθήκης σε ακόρεστα καρβοξυλικά οξέα περιλαμβάνουν επίσης Η αντίδραση του Μιχάλη, που είναι η προσθήκη καρβανιόν σε α, β - ακόρεστες ενώσεις. Ως παράδειγμα Παρουσιάζουμε την αντίδραση του κροτονικού αιθυλεστέρα με τον μηλονικό μεθυλεστέρακαι αντίδραση μεθακρυλικός αιθυλεστέρας με κυανοοξικό αιθυλεστέραπαρουσία αιθοξειδίου του νατρίου
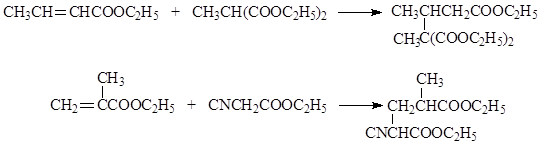
Μια ειδική περίπτωση της αντίδρασης Μιχαήλ είναι η χρήση ακρυλονιτριλίου ως ακόρεστου συστατικού, το οποίο σε αλκαλικό περιβάλλον είναι ικανό να συνδέσει έναν αριθμό ενώσεων με ένα κινητό άτομο υδρογόνου. Αυτό μας επιτρέπει να επεκτείνουμε τις δυνατότητες της συνθετικής οργανικής χημείας. Ακολουθούν μερικά παραδείγματα αντιδράσεων με ακρυλονιτρίλιο
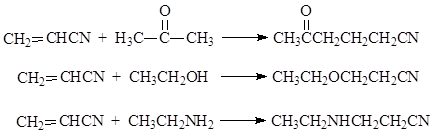
Σε όλες αυτές τις αντιδράσεις, η προσθήκη πηγαίνει στο άτομο β-άνθρακα του ακρυλονιτριλίου και στο μόριο αντί για ενεργό υδρογόνο, εισάγεται μια ομάδα ατόμων -CH2CH2CN.Για το λόγο αυτό, συχνά ονομάζεται η εν λόγω αντίδραση αντίδραση κυανοαιθυλίωσης.
Ιδιαίτερη σημασία ακόρεστα καρβοξυλικά οξέακαι τα παράγωγά τους βρίσκονται σε τους ικανότητα πολυμερισμού σε πολύτιμα προϊόντα.
Το ακρυλονιτρίλιο, όταν πολυμερίζεται, παράγει ένα πολυμερές από το οποίο κατασκευάζονται χημικές ίνες - υποκατάστατα μαλλιού. Με συμπολυμερισμό ακρυλονιτριλίου με βουταδιένιο, λαμβάνονται συνθετικά ελαστικά ανθεκτικά στο λάδι και τη βενζίνη.
Επίσης ευρέως γνωστό πολυμερή μεθυλεστέρων ακρυλικών και μεθακρυλικών οξέων,αντιπροσωπεύοντας είναι άχρωμα, διαφανή υλικά που μπορούν να καλουπωθούν. Ονομάζονται και βιολογικά ποτήρια
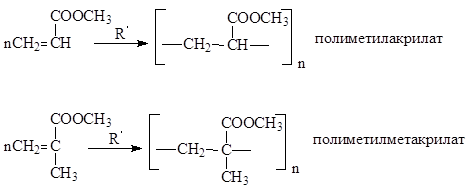
Διάλεξη Νο 12
3. Δικαρβοξυλικά οξέα.
Τα κορεσμένα δικαρβοξυλικά οξέα περιέχουν δύο καρβοξυλικές ομάδες στο μόριό τους. Τις περισσότερες φορές παίρνουν το όνομά τους από μια ασήμαντη ονοματολογία. Σύμφωνα με τη συστηματική ονοματολογία, η παρουσία δύο καρβοξυλίων σε ένα οξύ υποδεικνύεται με την προσθήκη της κατάληξης διοϊκό οξύστο όνομα του υδρογονάνθρακα που σε μια δεδομένη ένωση αντιστοιχεί στη μεγαλύτερη αλυσίδα ατόμων άνθρακα. Παρακάτω είναι τα πιο συχνά απαντώμενα δικαρβοξυλικά οξέα και τα ονόματά τους.
HOOS-COOH οξαλικό οξύ, αιθάνιο διάοξύ
NOOS-CH 2 -COOH μηλονικό οξύ, προπάνιο διάοξύ
HOOS-(CH 2) 2 -COOH ηλεκτρικό οξύ, βουτάνιο διάοξύ
HOOS-(CH 2) 3 -COOH γλουταρικό οξύ, πεντάνιο διάοξύ
HOOC-(CH2)4-COOH αδιπικό οξύ, εξανοδιοϊκό οξύ
HOOC-(CH2)5-COOH πιμελικό οξύ, επτανοδιοϊκό οξύ
HOOC-(CH 2) 6 -COOH σουβερικό οξύ, οκτανοδιοϊκό οξύ
HOOC-(CH 2) 7 -COOH αζελαϊκό οξύ, εννεοδιοϊκό οξύ
HOOS-(CH 2) 8 -COOH σεβακικό οξύ, δεκανοδιοϊκό οξύ
Για τη λήψη διβασικών οξέων, χρησιμοποιούνται οι ίδιες μέθοδοι όπως για τη σύνθεση μονοβασικών οξέων: οξείδωση πρωτοταγών αλκοολών και αλδεϋδών, υδρόλυση νιτριλίων και παραγώγων οξέος κ.λπ. Για να αποφύγουμε την επανάληψη, δεν θα τις εξετάσουμε. Πολύ πιο ενδιαφέρουσα εφαρμογή κοινές μεθόδουςστη σύνθεση συγκεκριμένων οξέων, καθώς και στη χρήση ειδικών μεθόδων παραγωγής.
Οξαλικό οξύ. Βρίσκεται με τη μορφή αλάτων σε πολλά φυτά (ξινόριζα, οξαλίδα). Στην τεχνολογία που λαμβάνεται με θέρμανση του άλατος νατρίου ή καλίου του μυρμηκικού οξέος στους 400 0
Είναι ενδιαφέρον να σημειωθεί ότι προτάθηκε η πρώτη σύνθεση οξαλικού οξέος με υδρόλυση κυανογόνου Wehlerπίσω στο 1824
Μηλονικό οξύ. Η συνήθης οδός για τη σύνθεση αυτού του οξέος, που παίζει ιδιαίτερο ρόλο οργανική σύνθεση, συνίσταται στην υδρόλυση του μονονιτριλίου του
Μπορούν να χρησιμοποιηθούν και άλλες μέθοδοι, για παράδειγμα, η μετατροπή του χλωριούχου μεθυλενίου σε δινιτριλίου και η υδρόλυση του, η χρήση της σύνθεσης οργανομαγνησίου.
Ηλεκτρικό οξύΣυνήθως λαμβάνεται με υδρογόνωση του μηλεϊνικού ανυδρίτη, ενός προϊόντος οξείδωσης του βενζολίου. Όπως και στη σύνθεση του μηλονικού οξέος, μπορεί επίσης να χρησιμοποιηθεί υδρόλυση δινιτριλίου. Το ίδιο το δινιτρίλιο λαμβάνεται με πυρηνόφιλη υποκατάσταση του 1,2-διχλωροαιθανίου
Αδιπικό οξύστην τεχνολογία σε μεγάλες ποσότητεςαποδεικνύεται οξείδωση κυκλοεξανίου με νιτρικό οξύσε ένα στάδιο ή μέσω προϊόντων ενδιάμεσης οξείδωσης - κυκλοεξανόλη και κυκλοεξανόνη, τα οποία οξειδώνονται ακόμα πιο εύκολα
Σύμφωνα με τους δικούς τους χημικές ιδιότητεςΤα διβασικά οξέα είναι κοντά στα μονοβασικά οξέα. Σχηματίζουν όλα τα γνωστά παράγωγα οξέων με τη συμμετοχή μιας (παράγωγα οξέος) ή και των δύο καρβοξυλομάδων (πλήρης παράγωγα). Ωστόσο, η αμοιβαία επίδραση δύο καρβοξυλίων, ειδικά όταν βρίσκονται το ένα κοντά στο άλλο, οδηγεί στην εμφάνιση συγκεκριμένων χαρακτηριστικών στη συμπεριφορά τους στις χημικές αντιδράσεις. Ας δούμε αυτά τα χαρακτηριστικά.
3.1. Οξύτητα. Είναι σαφές ότι τα διβασικά οξέα έχουν δύο σταθερές οξύτητας που σχετίζονται με τη διάσταση της μιας ή της άλλης καρβοξυλικής ομάδας
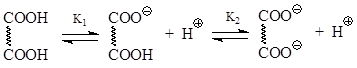
Όταν ένα από τα καρβοξυλικά διασπάται, το άλλο δρα απλώς ως ομάδα που αποσπά ηλεκτρόνια. Στη συζήτηση της οξύτητας των μονοκαρβοξυλικών οξέων (Ενότητα 1.3.1), βρέθηκε ότι τέτοιοι υποκαταστάτες ενισχύουν τις όξινες ιδιότητες. Για το λόγο αυτό, η πρώτη σταθερά οξύτητας (K 1) για τα διβασικά οξέα είναι πολύ υψηλότερη από ότι για τα μονοβασικά οξέα. Ταυτόχρονα, η δεύτερη σταθερά οξύτητας (Κ2) είναι σημαντικά χαμηλότερη, επειδή κατά τον ιονισμό του δεύτερου καρβοξυλίου, πρέπει να αφαιρεθεί ένα πρωτόνιο από το διπλά φορτισμένο ανιόν. Τα παρακάτω δεδομένα μας επιτρέπουν να συζητήσουμε την οξύτητα των διβασικών οξέων σε ποσοτικό επίπεδο
Οξύ 10 5 Κ 1 10 5 Κ 2
Μυρμήγκι 17.7 -
Οξικό 1,75 -
Sorrel 5400 5.2
Malonovaya 140 0,20
Κεχριμπάρι 6,4 0,23
Γλουταρικό 4,5 0,38
Adipic 3,7 0,39
3.2. Π ολιγοπύκνωση. Οι συνήθεις χημικές αντιδράσεις στην περίπτωση της συμμετοχής διβασικών οξέων μπορούν οδηγούν στην παραγωγή μορίων πολυμερούς . Είναι αλήθεια ότι για να συμβεί αυτό, ο συνεργάτης της χημικής αντίδρασης του οξέος πρέπει επίσης να είναι διλειτουργικός. Για παράδειγμα, η αντίδραση οξικού οξέος με αιθυλαμίνη θα παράγει απλώς αιθυλοακεταμίδιο
Σε περίπτωση διβασικό οξύ και διαμίνη καθίσταται δυνατήη αντίδραση πολλών μορίων οξέος και αμίνης με σχηματισμός πολυμερούς πολυαμιδίου. Με τη συμμετοχή του αδιπικού οξέος και της εξαμεθυλενοδιαμίνης στην αντίδραση, σχηματίζεται πολυαμίδιο ( νάιλον), συμπεριλαμβανομένων των υπολειμμάτων οξέος και αμίνης που συνδέονται με έναν αποκαλούμενο δεσμό αμιδίου
Σε αντίθεση με τον πολυμερισμό, η παραγωγή πολυμερών βασίζεται σε συμβατικά χημικές αντιδράσεις, ονομάζεται πολυσυμπύκνωση. Η πολυσυμπύκνωση συνοδεύεται πάντα από την απελευθέρωση απλούστερων μορίων, στην εξεταζόμενη περίπτωση, του νερού.
3.3. Στάση στη θέρμανση. Το αποτέλεσμα της θέρμανσης των δικαρβοξυλικών οξέων καθορίζεται από τη δομή τους. Γενικά, όταν εκτίθεται σε θερμότητα, το μόριο του οξέος αποικοδομείται. Σε αυτή την περίπτωση, απελευθερώνονται μόρια ή διοξείδιο του άνθρακα και σχηματίζονται μονοβασικά οξέα, κυκλικοί ανυδρίτες και κυκλικές κετόνες.
Όταν θερμαίνονται, το γλουταρικό και το ηλεκτρικό οξύ υφίστανται ενδομοριακή αφυδάτωση για να σχηματίσουν κυκλικούς ανυδρίτες
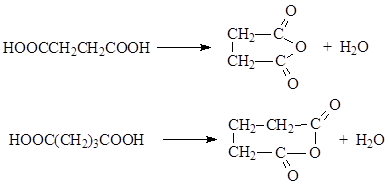
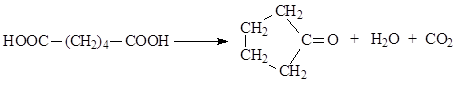
4. Οξοξέα.
Τα οξοξέα περιέχουν καρβοξυλικές και καρβονυλικές ομάδες στο μόριό τους. Η καρβονυλική ομάδα μπορεί να αντιπροσωπεύεται από ομάδες αλδεΰδης ή κετο . Σύμφωνα με το περιεχόμενο ορισμένων λειτουργικών ομάδων και τη σχετική θέση τους στο μόριο, ορισμένα οξοξέα διαφέρουν από άλλα. Εδώ είναι μερικά από τα πιο κοινά οξοξέα και τα ονόματά τους.
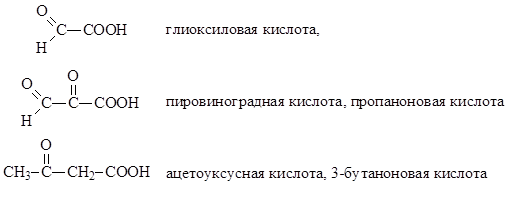 Τα οξοξέα είναι διλειτουργικές ενώσεις. Όταν συζητάμε μεθόδους για τη σύνθεσή τους, είναι αρκετά λογικό να βασιστούμε σε ήδη γνωστές πληροφορίες για τη δημιουργία καρβονυλικών και καρβοξυλικών ομάδων. Το ίδιο μπορεί να ειπωθεί σχετικά με τις ιδιότητες των οξοξέων. Αυτό μας επιτρέπει να εξετάσουμε τα οξοξέα χρησιμοποιώντας το παράδειγμα μόνο ενός από αυτά, ωστόσο, το πιο διάσημο - το ακετοξικό οξύ και ο αιθυλεστέρας του.
Τα οξοξέα είναι διλειτουργικές ενώσεις. Όταν συζητάμε μεθόδους για τη σύνθεσή τους, είναι αρκετά λογικό να βασιστούμε σε ήδη γνωστές πληροφορίες για τη δημιουργία καρβονυλικών και καρβοξυλικών ομάδων. Το ίδιο μπορεί να ειπωθεί σχετικά με τις ιδιότητες των οξοξέων. Αυτό μας επιτρέπει να εξετάσουμε τα οξοξέα χρησιμοποιώντας το παράδειγμα μόνο ενός από αυτά, ωστόσο, το πιο διάσημο - το ακετοξικό οξύ και ο αιθυλεστέρας του.
Το ακετοξικό οξύ είναι ένα β-οξο οξύ. Η κύρια μέθοδος για τη λήψη αυτού του οξέος είναι η συμπύκνωση των εστέρων παρουσία αλκοολικών αλάτων. Αυτή η αντίδραση, που ονομάζεται αντίδραση Claisen, έχει ήδη συζητηθεί στην ενότητα για τη λήψη ακετοξικού οξέος με τη μορφή εστέρα χρησιμοποιώντας την αντίδραση μεταξύ δικετένη και αιθυλικό οινόπνευμα
Όσον αφορά τις χημικές τους ιδιότητες, το ακετοξικό οξύ μοιάζει με κετόνες και οξέα. Στην καρβοξυλική ομάδα, δίνει τα συνήθη παράγωγα οξέων: άλατα, αμίδια, εστέρες κ.λπ.
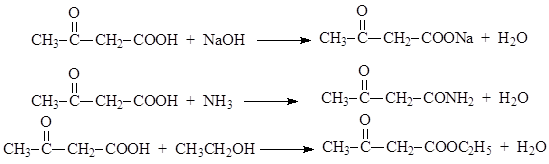
Πιο σταθερός από το ίδιο το οξύ, ο εστέρας του ακετοξικού οξέος στην καρβονυλομάδα προσθέτει υδροκυανικό οξύ, όξινο θειώδες νάτριο, υδρογόνο τη στιγμή της απελευθέρωσης, φαινυλυδραζίνη κ.λπ.

ακετοξικός εστέρας και είναι μια ακόρεστη αλκοόλη που βρίσκεται σε ισορροπία με την κετομορφή της

Σε όλες τις αντιδράσεις που αναφέρθηκαν παραπάνω, ο ακετοξικός εστέρας εισέρχεται σε μορφή ενόλης

Η σύνθεση του μείγματος κετο-ενόλης του ακετοξικού εστέρα έγινε γνωστή χάρη στην εργασία ενός Γερμανού ερευνητή Knorr(1911).
Όταν ψύχθηκε ο ακετοξικός αιθέρας στους -78 0 σε ένα μίγμα αιθέρα - εξανίου, ο Knorr απομόνωσε μια στερεή ουσία με σ.τ. -39 0 . Αυτή η ουσία δεν αποχρωματίζει το βρωμιούχο νερό και δεν αντέδρασε με το χλωριούχο σίδηρο. Από τα στοιχεία αυτά προέκυψε ότι μια ουσία με σ.τ. -39 0 είναι μια μορφή κετοεστέρα.
Με την αντίδραση ακετοξικού εστέρα με μεταλλικό νάτριο, ο Knorr έλαβε ακετοξικό εστέρα νατρίου. Ξηρό HCl διήλθε μέσω ενός εναιωρήματος αυτής της ουσίας σε πετρελαϊκό αιθέρα. Αυτό διαχώρισε ένα λάδι, το οποίο αντέδρασε αμέσως με βρώμιο και χλωριούχο σίδηρο. Αυτή ήταν η μορφή ενόλης του ακετοξικού εστέρα. Έτσι, ο Knorr κατάφερε να διαχωρίσει ταυτομερή για πρώτη φορά
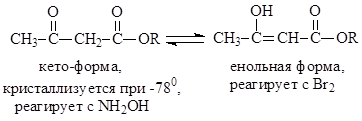
Επιπλέον, αποδείχθηκε ότι τα ταυτομερή μπορούσαν να αποθηκευτούν ως έχουν στους -78 0 για μεγάλο χρονικό διάστημα.
Συνθέσεις με βάση ακετοξικό οξύ. αποκαρβοξυλιώνεται αρκετά εύκολα όταν θερμαίνεται. Αυτό παράγει μια κετόνη
Το ακετοξικό οξύ χρησιμοποιείται στην οργανική σύνθεση για να ληφθούν μονο- και διυποκατεστημένες ακετόνες.
5. Υδροξυοξέα.
Τα υδροξυοξέα περιέχουν ομάδες υδροξυλίου και καρβοξυλίου στο μόριό τους. Ο αριθμός των υδροξυλίων και των καρβοξυλίων στα υδροξυοξέα καθορίζει την ατομικότητα και τη βασικότητά τους. Επιπλέον, τα υδροξυοξέα διαφέρουν επίσης στη σχετική διάταξη των λειτουργικών ομάδων στο μόριο. Παρακάτω είναι τα υδροξυοξέα που βρίσκονται πιο συχνά και τα ονόματά τους (χωρίς να λαμβάνεται υπόψη η στερεοχημεία των οξέων)
5.1. Μέθοδοι παραλαβής. Όπως και στην περίπτωση των οξοξέων, τα υδροξυοξέα λαμβάνονται χρησιμοποιώντας ήδη γνωστές μεθόδους για τη δημιουργία των αντίστοιχων λειτουργικών ομάδων - υδροξυλίου και καρβοξυλίου.
Τα α-υδροξυοξέα συνήθως συντίθενται με υδρόλυση των αντίστοιχων κυανυδρινών ή υδρόλυση α-αλογονωμένων οξέων

Για τη λήψη β-υδροξυοξέων, είναι δυνατόν να χρησιμοποιηθούν παρόμοιες μέθοδοι. Ωστόσο, υπάρχει επίσης μια συγκεκριμένη μέθοδος για αυτό - Η αντίδραση του Ρεφορμάτσκι.Αυτή η αντίδραση περιλαμβάνει την αλληλεπίδραση αλδεϋδών και κετονών με α-βρωμοεστέρες και μέταλλο ψευδαργύρου σε αιθέριο διάλυμα. Στην περίπτωση αυτή, ο εστέρας του υδροξυ οξέος λαμβάνεται με τη μορφή αλκοολικού άλατος, η υδρόλυση του οποίου οδηγεί στο ίδιο το υδροξυ οξύ
Έχει διαπιστωθεί ότι πρώτα ο βρωμοεστέρας αντιδρά με τον ψευδάργυρο για να σχηματίσει μια οργανοψευδαργυρική ένωση, η οποία στη συνέχεια προσκολλάται στην καρβονυλική ομάδα της αλδεΰδης ή της κετόνης

Όλα αυτά είναι παρόμοια με την παρασκευή και την αντίδραση του αντιδραστηρίου Grignard. Ένα χαρακτηριστικό της αντίδρασης Reformatsky είναι η χρήση ψευδαργύρου αντί μαγνησίου και μόνο α-βρωμοεστέρων. Αποδείχθηκε ότι οι οργανοψευδαργυρικές ενώσεις, σε αντίθεση με τις οργανομαγνησίου, είναι λιγότερο αντιδραστικές. Είναι σε θέση να αντιδράσουν μόνο με τα καρβονύλια των αλδεΰδων και των κετονών, χωρίς να επηρεάζουν την εστερική ομάδα.
5.2. Χημικές ιδιότητες. Τα υδροξυοξέα παρουσιάζουν ιδιότητες εγγενείς σε αλκοόλες και οξέα. Στην καρβοξυλική ομάδα δίνουν όλα τα παράγωγα των καρβοξυλικών οξέων
Αντιδρώντας όπως οι αλκοόλες, δίνουν αλκοολικές ενώσεις, αιθέρες και αντικαθιστούν το υδροξύλιο με αλογόνο
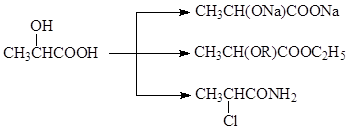
Μερικές φορές υπάρχει ανταγωνισμός μεταξύ λειτουργικών ομάδων. Σε τέτοιες περιπτώσεις, η τοποεπιλεκτικότητα της αντίδρασης καθορίζεται από την επιλογή του αντιδραστηρίου και των συνθηκών αντίδρασης. Έτσι, όταν τα υδραλογονίδια δρουν σε ένα αλογόνο, αντικαθίσταται μόνο το υδροξύλιο της αλκοόλης. Στην περίπτωση χρήσης πενταχλωριούχου φωσφόρου, υπάρχουν τόσο αλκοολικά όσο και καρβοξυλικά υδροξύλια.
Φαίνεται πολύ ενδιαφέρον να εξεταστεί το πρόβλημα της αμοιβαίας επιρροής των λειτουργικών ομάδων στην αντιδραστικότητα και την κατεύθυνση της αντίδρασης στην περίπτωση των υδροξυοξέων.
α - Τα υδροξυοξέα ανάγεται εύκολα σε καρβοξυλικά οξέα
Όταν θερμαίνονται με οξέα, τα α-υδροξυοξέα διασπώνται εύκολα από το μυρμηκικό οξύ
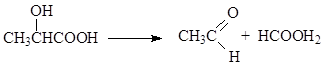
Το αποτέλεσμα της αφυδάτωσης των υδροξυοξέων εξαρτάται από τη σχετική θέση των ομάδων υδροξυλίου και καρβοξυλίου.
Τα β - υδροξυκαρβοξυλικά οξέα αποβάλλουν το νερό με τέτοιο τρόπο ώστε η αντίδραση να παράγει α, β - ακόρεστα καρβοξυλικά οξέα, στα οποία C=C- Και C=O- οι συνδέσεις είναι συζευγμένες
α - Τα υδροξυοξέα, όταν θερμαίνονται, διασπούν το νερό ως αποτέλεσμα της αμοιβαίας εστεροποίησης δύο μορίων για να σχηματίσουν κυκλικούς εστέρες που ονομάζονται λακτίδια
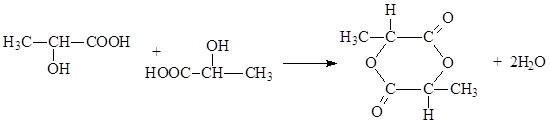
Τέλος, σημειώνουμε ότι τα γ - και δ - υδροξυοξέα υφίστανται ενδομοριακή εστεροποίηση όταν θερμαίνονται. Αυτό παράγει πενταμελείς και εξαμελείς κυκλικούς εστέρες που ονομάζονται γ - και δ - λακτόνες

Τα υδροξυοξέα (τρυγικά οξέα) έπαιξαν εξαιρετικό ρόλο στην ανακάλυψη του φαινομένου του εναντιομερισμού και στη μελέτη των προτύπων αυτού του τύπου χωρικής ισομέρειας.
Το 1848, ο Louis Pasteur, μελετώντας τα τρυγικά οξέα, ανακάλυψε ότι το τρυγικό νάτριο αμμώνιο (τα τρυγικά είναι άλατα του τρυγικού οξέος) ενός από αυτά, όταν κρυσταλλώνεται από αραιά υδατικά διαλύματα, σχηματίζει δύο τύπους κρυστάλλων. Αυτοί οι κρύσταλλοι οξέος που απομονώθηκαν από το χυμό σταφυλιών, που ονομάζονται σταφύλι ή ρακεμικό (λατινικά racemus - σταφύλια) οξύ, διέφεραν πολύ ελαφρώς, όπως το αντικείμενο και η κατοπτρική του εικόνα. Ωστόσο, ο Παστέρ κατάφερε να τα διαχωρίσει και να δείξει ότι οι κρύσταλλοι ενός τύπου περιστρέφουν το επίπεδο του πολωμένου φωτός προς τα δεξιά και ενός άλλου τύπου - προς τα αριστερά. Αυτές οι μελέτες κατέστησαν δυνατό να διαπιστωθεί ότι τα ισομερή τρυγικά οξέα είναι δεξιοστροφικά και αριστερόστροφα. Ένα μείγμα που αποτελείται από ίσες ποσότητες αυτών των οξέων ονομάζεται ρακεμικό. Ένα τέτοιο μείγμα (οξύ σταφυλιού) δεν είναι ικανό να περιστρέφει τα επίπεδα του πολωμένου φωτός λόγω της αντιστάθμισης της περιστροφής από τα ισομερή. Επιπλέον, είναι γνωστό ένα άλλο ισομερές τρυγικών οξέων (μεσοτρυγικό οξύ), το οποίο είναι ένα εσωτερικό ρακεμικό. Σε αυτή την περίπτωση, η περιστροφή του φωτός πάνω μέροςτο μόριο καταστρέφεται από αντίθετο πρόσημο και ίσο σε μέγεθος περιστροφή του κάτω μέρους του μορίου.
Γραφικά, τα ισομερή των τρυγικών οξέων μπορούν να αναπαρασταθούν με τους ακόλουθους τύπους προβολής:
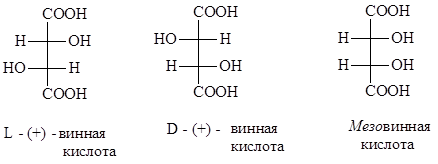
Η σύνθεση των ακόρεστων μονοβασικών οξέων με έναν διπλό δεσμό μπορεί να εκφραστεί με τον γενικό τύπο C n H 2 n -1 COOH. Όπως συμβαίνει με οποιεσδήποτε διλειτουργικές ενώσεις, χαρακτηρίζονται από αντιδράσεις τόσο οξέων όσο και ολεφινών. α.β -Ακόρεστα οξέαείναι κάπως ισχυρότερα από τα αντίστοιχα λιπαρά οξέα, αφού ο διπλός δεσμός που βρίσκεται δίπλα στην καρβοξυλομάδα ενισχύει τις όξινες ιδιότητές της.
Ακρυλικό οξύ. Το απλούστερο ακόρεστο μονοβασικό οξύ
Ελαϊκό, λινολεϊκό και λινολενικό οξύ.
Το ελαϊκό οξύ C 17 H 33 COOH με τη μορφή αιθέρα γλυκερίνης είναι εξαιρετικά κοινό στη φύση. Η δομή του εκφράζεται με τον τύπο
Το ελαϊκό οξύ είναι ένα άχρωμο ελαιώδες υγρό, ελαφρύτερο από το νερό και στο κρύο σκληραίνει σε κρυστάλλους σε σχήμα βελόνας που λιώνουν στους 14 °C. Στον αέρα οξειδώνεται γρήγορα και κιτρινίζει.
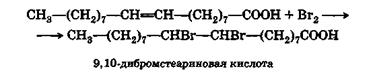 Το μόριο ελαϊκού οξέος είναι ικανό να συνδέει δύο άτομα αλογόνου:
Το μόριο ελαϊκού οξέος είναι ικανό να συνδέει δύο άτομα αλογόνου:
Παρουσία καταλυτών, όπως το Ni, το ελαϊκό οξύ προσθέτει δύο άτομα υδρογόνου και γίνεται στεατικό οξύ.
Το ελαϊκό οξύ είναι ένα ισομερές cis (όλα τα φυσικά ακόρεστα οξέα υψηλού μοριακού βάρους, κατά κανόνα, ανήκουν στη σειρά cis).
Τα λινελαϊκά οξέα C 17 H 31 COOH και λινολενικά C 17 H 29 COOH είναι ακόμη πιο ακόρεστα από το ελαϊκό οξύ. Με τη μορφή εστέρων με γλυκερίνη - γλυκερίδια- είναι το κύριο πράγμα αναπόσπαστο μέροςέλαια λιναρόσπορου και κάνναβης:
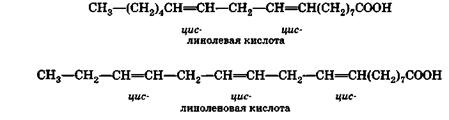
Υπάρχουν δύο διπλοί δεσμοί στο μόριο του λινολεϊκού οξέος. Μπορεί να προσθέσει τέσσερα άτομα υδρογόνου ή αλογόνου. Το μόριο του λινολεϊκού οξέος έχει τρεις διπλούς δεσμούς, επομένως προσθέτει έξι άτομα υδρογόνου ή αλογόνου. Και τα δύο οξέα προσθέτουν υδρογόνο για να σχηματίσουν στεατικό οξύ.
Σορβικό οξύ
Έχει δύο διπλούς δεσμούς συζευγμένους μεταξύ τους και με την καρβοξυλική ομάδα, που έχουν μια trans διαμόρφωση. είναι εξαιρετικό συντηρητικό για πολλούς προϊόντα διατροφής: κονσέρβες λαχανικών, τυρί, μαργαρίνη, φρούτα, ψάρια και προϊόντα κρέατος.
Μηλεϊνικό και φουμαρικό οξύ. Τα απλούστερα διβασικά οξέα που περιέχουν δεσμό αιθυλενίου είναι δύο δομικά ισομερή:
Επιπλέον, για το δεύτερο από αυτά τα οξέα είναι δυνατές δύο χωρικές διαμορφώσεις:

Το φουμαρικό οξύ βρίσκεται σε πολλά φυτά: είναι ιδιαίτερα κοινό στα μανιτάρια. Το μηλεϊνικό οξύ δεν βρίσκεται στη φύση.
Και τα δύο οξέα παρασκευάζονται συνήθως με θέρμανση μηλικού (υδροξυηλεκτρικού) οξέος:
Η αργή, ήπια θέρμανση παράγει κυρίως φουμαρικό οξύ. με ισχυρότερη θέρμανση και απόσταξη μηλικού οξέος, λαμβάνεται μηλεϊνικό οξύ.
Τόσο το φουμαρικό όσο και το μηλεϊνικό οξύ, όταν ανάγεται, δίνουν το ίδιο ηλεκτρικό οξύ.
Ονοματολογία.Στη σειρά των καρβοξυλικών οξέων, χρησιμοποιούνται συχνότερα ασήμαντα ονόματα, πολλά από τα οποία υποδεικνύουν την πηγή των καρβοξυλικών οξέων.
Σύμφωνα με τη συστηματική ονοματολογία, το όνομα των καρβοξυλικών οξέων σχηματίζεται από το όνομα των αντίστοιχων αλκανίων με την προσθήκη της κατάληξης «ωα» και της λέξης «οξύ». Η αρίθμηση της υδρογονανθρακικής αλυσίδας ξεκινά με τον άνθρακα της καρβοξυλικής ομάδας.
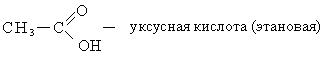


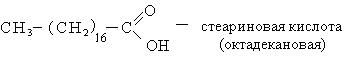
Μέθοδοι απόκτησης.Υπάρχει ένας αριθμός γενικών μεθόδων για την παραγωγή οξέων.
1. Καταλυτική οξείδωση υδρογονανθράκων παραφίνης με ατμοσφαιρικό οξυγόνο:
Στη βιομηχανία, για την παραγωγή καρβοξυλικών οξέων, χρησιμοποιούνται υδρογονάνθρακες παραφίνης με αριθμό ατόμων άνθρακα C 20 - C 40 και λαμβάνονται οξέα C 10 - C 20.
2. Αντίδραση οξοσύνθεσης:
3. Οξείδωση αλδεΰδων:

Απαραίτητες για τη σύνθεση οξέων, οι αλδεΰδες λαμβάνονται με την αντίδραση Kucherov ή με την καταλυτική αφυδρογόνωση των αλκοολών.
4. Υδρόλυση νιτριλίων:
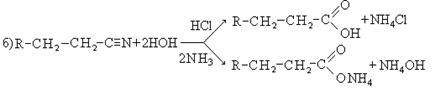
5. Υδρόλυση παραγώγων διδύμων αλογόνου:

6. Υδρόλυση λιπών:

Χημικές ιδιότητες καρβοξυλικών οξέων.Οι χημικές ιδιότητες των καρβοξυλικών οξέων καθορίζονται από τις ηλεκτρονικές επιδράσεις που δρουν στην καρβοξυλική ομάδα και στο μόριο ως σύνολο.
Η ηλεκτρονική δομή του μορίου μας επιτρέπει να προσδιορίσουμε τις ακόλουθες κύριες κατευθύνσεις των χημικών αντιδράσεων των καρβοξυλικών οξέων:
- αντιδράσεις με ρήξη Συνδέσεις O-N(κατεύθυνση Ι);
- αντιδράσεις με ρήξη Συνδέσεις S-O(κατεύθυνση II);
— αντιδράσεις σε ρίζα υδρογονάνθρακα (κατεύθυνση III).
Ι. Οξεοβασικές ιδιότητες οξέων (κατεύθυνση Ι). Η επίδραση του οξυγόνου της καρβονυλικής ομάδας οδηγεί στη συσσώρευση ενός μερικώς θετικού φορτίου στο άτομο άνθρακα, το οποίο με τη σειρά του, λόγω της επαγωγικής επίδρασης, οδηγεί σε σημαντική μείωση της πυκνότητας ηλεκτρονίων στο οξυγόνο της ομάδας υδροξυλίου, με αποτέλεσμα το πρωτόνιο πρακτικά να μην κατακρατείται, να αφαιρείται εύκολα και τα οξέα να έχουν έντονες όξινες ιδιότητες.
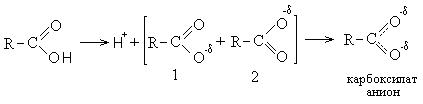
Η διάσταση των οξέων με την αφαίρεση ενός πρωτονίου είναι επίσης ενεργειακά πλεονεκτική, καθώς αυτό παράγει ένα καρβοξυλικό ανιόν, σταθεροποιημένο με συντονισμό και με λιγότερη ενέργεια από το αρχικό οξύ. Το καρβοξυλικό ανιόν είναι ένα υβρίδιο δύο δομών (1 και 2) που σταθεροποιούνται με συντονισμό. Στο καρβοξυλικό ανιόν, το άτομο βρίσκεται σε κατάσταση υβριδισμού sp 2. Το μη ζευγαρωμένο p-ηλεκτρόνιο του άνθρακα επικαλύπτεται εξίσου ομοιόμορφα με το p-ηλεκτρόνιο των δύο ατόμων οξυγόνου.
Η παρουσία ενός αλογόνου σε μια ρίζα αλκυλίου ενισχύει τις όξινες ιδιότητες των οξέων. Το ισχυρότερο οξύ είναι το τριχλωροξικό οξύ. Η ευκολία της αφαίρεσης πρωτονίων στο τριχλωροξικό οξύ εξηγείται από την αρνητική επαγωγική επίδραση του αλογόνου, η οποία μειώνει την πυκνότητα ηλεκτρονίων στο καρβοξυλικό ανιόν και το αποσταθεροποιεί.

Η οξύτητα των αλογονωμένων καρβοξυλικών οξέων αλλάζει με την ακόλουθη σειρά:
Η παρουσία υποκαταστατών δότη στη ρίζα αλκυλίου αυξάνει την πυκνότητα ηλεκτρονίων στο καρβοξυλικό ανιόν και το πρωτόνιο συγκρατείται πιο έντονα από αυτό.
Σε αυτή τη σειρά, το μυρμηκικό οξύ έχει μεγαλύτερες όξινες ιδιότητες από το οξικό οξύ.
Τα καρβοξυλικά οξέα αλληλεπιδρούν με ενεργά μέταλλα, υδροξείδια μετάλλων, άλατα:
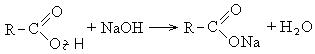
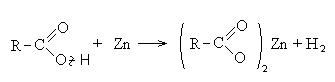
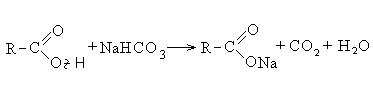
II Αντιδράσεις με τη διάσπαση του δεσμού C-OH (κατεύθυνση II).
Οι αντιδράσεις με τη διάσπαση του δεσμού C-OH προχωρούν μέσω του μηχανισμού της πυρηνόφιλης υποκατάστασης (S N) και οδηγούν στον σχηματισμό των λεγόμενων λειτουργικών παραγώγων των καρβοξυλικών οξέων. Αυτά περιλαμβάνουν:
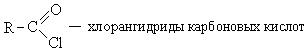
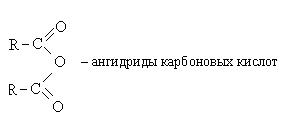
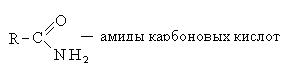

Ο μηχανισμός των αντιδράσεων πυρηνόφιλης υποκατάστασης είναι ο ακόλουθος:
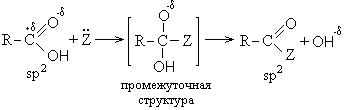
Πυρηνόφιλος.
1. Σχηματισμός όξινων χλωριδίων καρβοξυλικών οξέων:
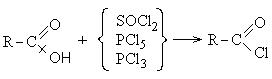

Τα χλωρίδια καρβοξυλικού οξέος είναι μια αντιδραστική κατηγορία ενώσεων και χρησιμοποιούνται ευρέως στην οργανική σύνθεση για την παραγωγή διοξυκετονών και καρβοξυλικών οξέων:
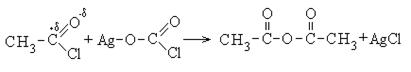
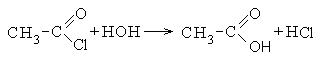
2. Σχηματισμός ανυδρίτες καρβοξυλικού οξέος:
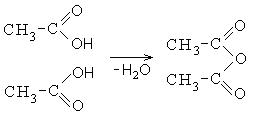
Οι ανυδρίτες καρβοξυλικού οξέος είναι επίσης δραστικές ενώσεις. Ο οξικός ανυδρίτης χρησιμοποιείται ως ακελανοποιητικός παράγοντας:
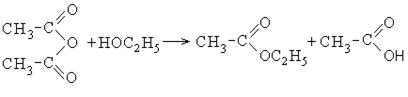
Όταν ο οξικός ανυδρίτης διαλύεται σε νερό, σχηματίζεται οξικό οξύ.
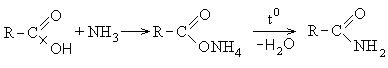
3. Σχηματισμός αμιδίων καρβοξυλικών οξέων:
4. Σχηματισμός εστέρων:
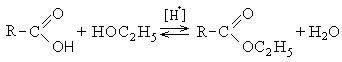
III. Αντιδράσεις σε ρίζες υδρογονανθράκων (κατεύθυνση III). Αυτές οι αντιδράσεις προχωρούν σύμφωνα με τον μηχανισμό ριζικής υποκατάστασης (S R):

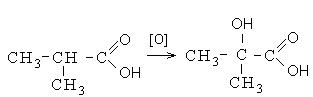
Εκτός από τις προαναφερθείσες κατευθύνσεις αλληλεπίδρασης, τα καρβοξυλικά οξέα εισέρχονται σε αντιδράσεις οξείδωσης. Η οξείδωση των καρβοξυλικών οξέων συμβαίνει κάτω από σκληρές συνθήκες με το σχηματισμό υδροξυοξέων. Στα μη διακλαδισμένα καρβοξυλικά οξέα, η οξείδωση συμβαίνει στη θέση β και σε διακλαδισμένα - στη θέση α στον άνθρακα της καρβονυλικής ομάδας:

Εφαρμογή καρβοξυλικών οξέων.Μυρμηκικό οξύ- υγρό με πικάντικη οσμή. Βιομηχανικά, το μυρμηκικό οξύ λαμβάνεται από μυρμηκικό νάτριο, το οποίο σχηματίζεται με τη διέλευση μονοξειδίου του άνθρακα μέσω ενός διαλύματος υδροξειδίου του νατρίου.

Το άλας που προκύπτει μετατρέπεται σε ελεύθερο οξύ με τη δράση του θειικού οξέος:
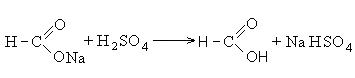
Το μυρμηκικό οξύ είναι ευρέως διαδεδομένο στη φύση. Βρίσκεται στις τσουκνίδες, στις πευκοβελόνες και είναι απόβλητο από μυρμήγκια. Το μυρμηκικό οξύ χρησιμοποιείται ως συντηρητικό. Το διάλυμά του σε αιθανόλη είναι γνωστό ως μυρμηκική αλκοόλη.
Οξικό οξύ. Το οξύ αυτό ονομάζεται και παγόμορφο οξύ, αφού στους +16,5 0 C στερεοποιείται σε κρυσταλλική μάζα. Το οξικό οξύ έχει μια χαρακτηριστική πικάντικη οσμή και αναμιγνύεται με νερό σε οποιαδήποτε αναλογία. Ένα διάλυμα 3-5% οξικού οξέος είναι γνωστό ως ξύδι και ένα διάλυμα 70-80% είναι γνωστό ως απόσταγμα ξυδιού. Για σκοπούς διατροφής, το οξικό οξύ λαμβάνεται με ζύμωση οξικού οξέος.
Καρβοξυλικά οξέα υψηλού μοριακού βάρους(παλμιτικό και στεατικό). Το μείγμα αυτών των οξέων ονομάζεται στεαρίνη. Η στεαρίνη χρησιμοποιείται για την κατασκευή κεριών, τη δημιουργία βάσης για κραγιόν και βερνίκια παπουτσιών. Η στεαρίνη λαμβάνεται με εξάχνωση υδρολυμένου λίπους. Τα υψηλά μοριακά καρβοξυλικά οξέα με τον αριθμό των ατόμων άνθρακα C 10 - C 20 χρησιμοποιούνται για τη λήψη της ενεργής βάσης των συνθετικών απορρυπαντικών.
Τα αλκυλοθειικά άλατα χρησιμοποιούνται συνήθως ως ενεργή βάση των απορρυπαντικών. Γενικό σχήμαΗ λήψη αλκυλοσουλφονικών ενώσεων καταλήγει στα εξής:
Το καθαριστικό αποτέλεσμα είναι επιφανειακό δραστικές ουσίες. Τα επιφανειοδραστικά είναι ενώσεις που μπορούν να προσροφηθούν στη διεπιφάνεια και να αλλάξουν την επιφανειακή τους τάση. Σε επιφανειοδραστικές ουσίες με ιδιότητες καθαρισμού, περιλαμβάνουν:
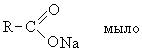
Η δομή των επιφανειοδραστικών μπορεί να θεωρηθεί ότι αποτελείται από δύο τμήματα: υδρόφιλοςμέρος, δηλαδή, διαλυτό στο νερό και υδροφόβοςτο τμήμα που αντιπροσωπεύεται από μια ρίζα υδρογονάνθρακα μακράς αλυσίδας, αδιάλυτη στο νερό.
Η απορρυπαντική δράση των επιφανειοδραστικών ουσιών εξηγείται από τους ακόλουθους παράγοντες: η υδρόλυση των επιφανειοδραστικών ουσιών δημιουργεί ένα αλκαλικό περιβάλλον, το οποίο προκαλεί γαλακτωματοποίηση των λιπών από την επιφάνεια. Τα ίδια τα επιφανειοδραστικά παρέχουν τη σταθερότητα αυτών των γαλακτωμάτων. Τα επίμονα γαλακτώματα σχηματίζονται λόγω της προσρόφησης επιφανειοδραστικών στην επιφάνεια των σταγονιδίων λίπους, η οποία δεν επιτρέπει σε αυτά τα σταγονίδια (βρωμιά) να συνδεθούν μεταξύ τους και η βρωμιά δεν κατακάθεται στο ύφασμα, αλλά παραμένει στο υδατικό περιβάλλον και απομακρύνεται .
Κορεσμένα (κορεσμένα) καρβοξυλικά οξέα - ενώσεις (δεν υπάρχουν βραχείς δεσμοί στη ρίζα υδρογονάνθρακα) έχουν γενικό τύπο ClH2l + 1COOH. Μέθοδοι παρασκευής 1. Οξείδωση πρωτοταγών αλκοολών: 3CH3CH2OH + 2K2CH207 + 8H2S04 - 3CH3COOH + + 2K2S04 + 2Cr2 (S04)3 + 11H20 2. Οξείδωση αλδεϋδών: 5CH3CH20H0 S04+2Mn S04+3H20 3. Υδρόλυση συμπλόκων εστέρων: H+ R"-C00-R* + H20 ^ R"-COOH+R"OH 4. Υδρόλυση παραγώγων υδρογονάνθρακα υποκατεστημένου με τριαλογόνο: 5. Αλληλεπίδραση του αντιδραστηρίου Grignard με μονοξείδιο του άνθρακα (IV): h2o Υδρόλυση ανυδριδίων καρβοξυλικών οξέων: 7. Υδρόλυση αλογονιδίων καρβοξυλικών οξέων: Υπάρχουν ειδικές μέθοδοι για τη λήψη μεμονωμένων αντιπροσώπων (βλ. μυρμηκικά και οξικά οξέα Οι πρώτοι εκπρόσωποι της ομόλογης σειράς αλκανοϊκών οξέων (Q-C3) είναι εύκολα Τα κινητά υγρά με έντονη χαρακτηριστική οσμή Για παράδειγμα, το αιθανικό οξύ (οξικό) έχει χαρακτηριστική οσμή με αριθμό ατόμων άνθρακα δέκα και άνω είναι στερεές ουσίες που είναι πρακτικά άοσμες. Τα καρβοξυλικά οξέα είναι πολύ διαλυτά σε οργανικούς διαλύτες στο νερό, η διαλυτότητά τους μειώνεται με την αύξηση του μήκους της ρίζας υδρογονάνθρακα. Τα οξέα που περιέχουν 1-3 άτομα άνθρακα είναι άπειρα αναμίξιμα με το νερό, 4-9 - περιορισμένα, 10 και άνω - πρακτικά αδιάλυτα στο νερό. Το σημείο βρασμού των καρβοξυλικών οξέων είναι σημαντικά υψηλότερο από το σημείο βρασμού των αντίστοιχων αλκοολών και αλδεϋδών τους. Αυτό εξηγείται από το γεγονός ότι τα καρβοξυλικά οξέα σε αέρια κατάσταση σχηματίζουν διμερή λόγω δεσμών υδρογόνου, τα οποία σχηματίζονται εύκολα λόγω των δομικών χαρακτηριστικών της καρβοξυλικής ομάδας: O n-O R-C^ ^ C-R Στον Πίνακα. Το 29.2 δείχνει τις φυσικές ιδιότητες ορισμένων εκπροσώπων κορεσμένων καρβοξυλικών οξέων. Τα καρβοξυλικά οξέα είναι ισχυρότερα οξέα από τις αλκοόλες επειδή το άτομο υδρογόνου στην ομάδα καρβοξυλίου έχει αυξημένη κινητικότητα λόγω της επίδρασης της ομάδας CO (βλ. παραπάνω). Σε ένα υδατικό διάλυμα, τα καρβοξυλικά οξέα διασπώνται: Ωστόσο, λόγω της ομοιοπολικής φύσης των μορίων των καρβοξυλικών οξέων, η παραπάνω ισορροπία διάστασης μετατοπίζεται αρκετά έντονα προς τα αριστερά. Έτσι, τα καρβοξυλικά οξέα είναι γενικά αδύναμα οξέα. Οι σταθερές διάστασης των κορεσμένων μονοβασικών καρβοξυλικών οξέων κυμαίνονται από 1,77 -10"4 (HCOOH) έως (QHnCOOH), δηλαδή, σε σύγκριση με ανόργανα οξέα όπως HC1, HN03 ή H2S04, είναι αδύναμα, αλλά ισχυρότερα από το ανθρακικό οξύ (Ki = 1 10-7). Σχηματισμός αλάτων Τα καρβοξυλικά οξέα έχουν όλες τις ιδιότητες των συνηθισμένων οξέων. βασικά οξείδια, βάσεις και άλατα ασθενών οξέων: Τα καρβοξυλικά οξέα είναι αδύναμα, επομένως τα ισχυρά ορυκτά οξέα τα εκτοπίζουν από τα αντίστοιχα άλατα: CH3COONa + HCl -CH3COOH + NaCl Τα άλατα καρβοξυλικών οξέων σε υδατικά διαλύματα υδρολύονται: CH3COON + n20 CH3COOH + KOH Η διαφορά μεταξύ καρβοξυλικά οξέα και ανόργανα οξέα είναι στη δυνατότητα σχηματισμού ενός αριθμού λειτουργικών παραγώγων. 3. Σχηματισμός λειτουργικών παραγώγων καρβοξυλικών οξέων. Κατά την αντικατάσταση της ομάδας ΟΗ σε καρβοξυλικά οξέα διάφορες ομάδες(Χ) σχηματίζονται λειτουργικά παράγωγα οξέων που έχουν τον γενικό τύπο R-CO-X. Εδώ το R σημαίνει μια ομάδα αλκυλίου ή αρυλίου. Τα χλωρίδια οξέων λαμβάνονται με τη δράση του χλωριούχου φωσφόρου (V) στα οξέα: Οι εστέρες R-co-OH+pa5-*R-co-a+poa3+Ha σχηματίζονται με θέρμανση ενός οξέος με μια αλκοόλη παρουσία θειικού οξέος. (αντίδραση αναστρέψιμης εστεροποίησης): h2so4 Ο μηχανισμός της αντίδρασης εστεροποίησης καθιερώθηκε με τη μέθοδο των «επισημασμένων ατόμων». Οι εστέρες μπορούν επίσης να ληφθούν με την αλληλεπίδραση χλωριδίων οξέος και αλκοολικών αλκαλικών μετάλλων: Οι αντιδράσεις των χλωριδίων καρβοξυλικού οξέος με την αμμωνία οδηγούν στο σχηματισμό αμιδίων: CH3 - CO - CI + 2NH3 - CH3 - CO - NH2 + NH4CI Επιπλέον, τα αμίδια μπορούν να λαμβάνονται με θέρμανση αλάτων αμμωνίου καρβοξυλικών οξέων: t CH3-COONH4-» CH3-CO-NH2+H2O R-CO- 4. Μια σειρά από ιδιότητες των καρβοξυλικών οξέων οφείλονται στην παρουσία μιας ρίζας υδρογονάνθρακα. Έτσι, όταν τα αλογόνα δρουν στα οξέα στο φως, σχηματίζονται υποκατεστημένα με αλογόνο οξέα και το άτομο υδρογόνου στο άτομο άνθρακα που βρίσκεται δίπλα στην καρβοξυλική ομάδα (a-άτομο) αντικαθίσταται από αλογόνο: 5. Αντιδράσεις οξειδοαναγωγής καρβοξυλικών οξέων. Σε μια ατμόσφαιρα 02, όλα τα καρβοξυλικά οξέα οξειδώνονται σε CO2 και H20: CHeCHYUN + 202 -1 2CO2 + 2H2O Τα κορεσμένα μονοκαρβοξυλικά οξέα είναι ανθεκτικά στη δράση τόσο ισχυρών οξειδωτικών παραγόντων όπως το συμπυκνωμένο HN03 και το H2S04 (με εξαίρεση το μινικό οξύ) . Τα καρβοξυλικά οξέα, υπό τη δράση αναγωγικών παραγόντων παρουσία καταλυτών, μπορούν να μετατραπούν σε αλδεΰδες ή αλκοόλες: 6. Αντιδράσεις αποκαρβοξυλίωσης. Κορεσμένα μη υποκατεστημένα μονοκαρβοξυλικά οξέα λόγω της υψηλής αντοχής τους Συνδέσεις S-SΌταν θερμαίνονται, αποκαρβοξυλιώνονται με δυσκολία. Αυτό απαιτεί τη σύντηξη του άλατος αλκαλιμετάλλου του καρβοξυλικού οξέος με αλκάλιο: CH3-CH2-COONa+NaOH i CjHfij-f-Na2C03 Μεμονωμένοι εκπρόσωποι. Μυρμηκικό (μεθάνιο) οξύ. Το όνομα προέρχεται από το γεγονός ότι το οξύ βρίσκεται στις εκκρίσεις των μυρμηγκιών. Το HCOOH είναι ένα άχρωμο υγρό με πικάντικη οσμή. Το μυρμηκικό οξύ λαμβάνεται με θέρμανση του μονοξειδίου του άνθρακα (II) με κονιοποιημένο υδροξείδιο του νατρίου, σε αντίθεση με άλλα κορεσμένα μονοκαρβοξυλικά οξέα, το μυρμηκικό οξύ είναι ασταθές στη δράση των συμπυκνωμένων θειικών και νιτρικών οξέων: Όντας ταυτόχρονα αλδεΰδη, το μυρμηκικό οξύ εμφανίζει τις ιδιότητες του. ισχυρός αναγωγικός παράγοντας: Τα μυρμηκικά μετάλλων αλκαλίων μετατρέπονται σε άλατα οξαλικού οξέος 2HCOONa i H2T+Na2C204 Το μυρμηκικό οξύ χρησιμοποιείται ευρέως στη χημική, φαρμακευτική, κλωστοϋφαντουργική και δερμάτινη βιομηχανία. Το οξικό (φάσης) οξύ CH3COOH είναι ένα άχρωμο υγρό με πικάντικη οσμή. Το οξικό οξύ λαμβάνεται με την καταλυτική οξείδωση του βουτανίου. Το οξικό οξύ χρησιμοποιείται ευρέως στις βιομηχανίες χημικών, φαρμακευτικών, τροφίμων, κλωστοϋφαντουργίας και χρωμάτων. Το παλμιτικό (δεκαεξανοϊκό) οξύ C17H35COOH και το στεατικό (οκταδεκανοϊκό) οξύ C17H35COOH είναι άοσμα και άγευστα λευκά στερεά, αδιάλυτα στο νερό, εξαιρετικά διαλυτά σε οργανικούς διαλύτες. Αποτελούν μέρος της πλειοψηφίας φυτικά έλαιακαι ζωικά λίπη. Λαμβάνεται με σαπωνοποίηση λιπών και ελαίων. Ένα μείγμα παλμιτικού και στεατικού οξέος ονομάζεται στεαρίνη. Σύμφωνα με τις χημικές ιδιότητες είναι τυπικοί εκπρόσωποικορεσμένα καρβοξυλικά οξέα. Χρησιμοποιείται ευρέως στην παραγωγή απορρυπαντικών και καλλυντικά, στη χημική και φαρμακευτική βιομηχανία.
Σχετικά άρθρα
-
Αγγλικά - ρολόι, ώρα
Όποιος ενδιαφέρεται να μάθει αγγλικά έχει συναντήσει περίεργους συμβολισμούς p. m.
-
και α. m, και γενικά, παντού όπου αναφέρεται χρόνος, για κάποιο λόγο χρησιμοποιείται μόνο η μορφή των 12 ωρών. Μάλλον για εμάς που ζούμε...
Το Doodle Alchemy ή Alchemy on paper για Android είναι ένα ενδιαφέρον παιχνίδι παζλ με όμορφα γραφικά και εφέ. Μάθετε πώς να παίζετε αυτό το καταπληκτικό παιχνίδι και επίσης βρείτε συνδυασμούς στοιχείων για να ολοκληρώσετε το παιχνίδι Αλχημείας σε χαρτί. Παιχνίδι...
-
Batman: Arkham City δεν θα ξεκινήσει;
Εάν αντιμετωπίζετε το γεγονός ότι το Batman: Arkham City επιβραδύνει, κολλάει, το Batman: Arkham City δεν ξεκινά, το Batman: Arkham City δεν εγκαθίσταται, τα στοιχεία ελέγχου δεν λειτουργούν στο Batman: Arkham City, δεν υπάρχει ήχος, εμφανίζονται σφάλματα στο Batman:...
-
Πώς να απογαλακτίσετε κάποιον από τους κουλοχέρηδες Πώς να απογαλακτίσετε κάποιον από τα τυχερά παιχνίδια
Μαζί με έναν ψυχοθεραπευτή στην κλινική Moscow Rehab Family και έναν ειδικό στη θεραπεία του εθισμού στον τζόγο, τον Roman Gerasimov, η Rating Bookmakers εντόπισε το μονοπάτι ενός εθισμένου στον τζόγο στο αθλητικό στοίχημα - από τον σχηματισμό εθισμού έως την επίσκεψη σε γιατρό,...
-
Rebuses Διασκεδαστικά rebuses γρίφοι γρίφους
Παιχνίδι "Riddles Rebuses Charades": απάντηση στην ενότητα "RIDLES" Επίπεδο 1 και 2 ● Ούτε ποντίκι, ούτε πουλί - γλεντάει στο δάσος, ζει στα δέντρα και ροκανίζει ξηρούς καρπούς. ● Τρία μάτια - τρεις παραγγελίες, το κόκκινο είναι το πιο επικίνδυνο.
-
Επίπεδο 3 και 4 ● Δύο κεραίες ανά...
Προθεσμίες παραλαβής κεφαλαίων για δηλητηρίαση
