Νερό οξικού οξέος. Εφαρμογές οξικού οξέος
Ονομα:
Οξικό οξύ(αιθανοϊκό οξύ) είναι ένα μονοβασικό καρβοξυλικό οξύ της αλειφατικής σειράς.
Χημική φόρμουλα:
Ιστορικό ανοίγματος:
Το οξικό οξύ είναι γνωστό από τα αρχαία χρόνια, καθώς σχηματίζεται κατά το ξίνισμα των κρασιών (ξύδι κρασιού).
Αλλά οι επιστήμονες ενδιαφέρθηκαν για τη δομή του οξικού οξέος και την αιτία της εμφάνισής του μόνο μετά την εντυπωσιακή δημοσίευση του εμπειρικού κανόνα του Dumas για την αντικατάσταση του υδρογόνου με το χλώριο σε οργανικές ενώσεις. Πριν από αυτό, η χημεία κυριαρχούνταν από τη θεωρία που προτάθηκε από τον Jens Jakob Berzelius. Χώρισε τα στοιχεία σε ηλεκτροθετικά και ηλεκτραρνητικά και αρνήθηκε εντελώς τις υποκαταστάσεις υδρογόνου και χλωρίου, αντίστοιχα, χωρίς να αλλάξει χημική δομήουσίες.
Στο έργο του το 1839, ο Ντούμα παρουσίασε μια έκθεση στη Σουηδική Ακαδημία στην οποία καθαγίασε τις αρχικές αρχές του εμπειρικού κανόνα που διατύπωσε για τις οργανικές ουσίες, και για το οξικό οξύ ειδικότερα: «Στην ανόργανη χημεία, καθοδηγούμαστε από τον ισομορφισμό. θεωρία βασισμένη σε γεγονότα, ως γνωστόν, λίγοι που συμφωνούν με τις ηλεκτροχημικές θεωρίες. Στην οργανική χημεία η θεωρία της υποκατάστασης παίζει τον ίδιο ρόλο... και ίσως το μέλλον θα δείξει ότι και οι δύο απόψεις συνδέονται στενότερα, ότι προέρχονται από τις ίδιες αιτίες και μπορούν να γενικευθούν με το ίδιο όνομα».
Του πήρε αρκετά χρόνια για να καταλήξει σε αυτό το συμπέρασμα. Ο Ντούμας ξεκίνησε τα πρώτα του πειράματα με τη μελέτη του οξικού οξέος και τη μετατροπή του σε χλωροοξικό οξύ. Το υδρογόνο σε αυτή την αντίδραση αντικαθίσταται πλήρως από χλώριο, σε αναλογία 1:1, και το πιο σημαντικό, χωρίς απώλεια βασικών Χημικές ιδιότητεςκαι η σχέση της ύλης με την τάξη. Περαιτέρω πειράματα με την αντικατάσταση του υδρογόνου με ιώδιο και βρώμιο έπεισαν τελικά τον επιστήμονα για αυτό.
Το συμπέρασμα σχετικά με τη θεμελιώδη διαφορά μεταξύ του σχηματισμού ανόργανων και οργανικών ενώσεων αποδείχθηκε επαναστατικό.
Ωστόσο, ο Berzelius, υπερασπιζόμενος τη θεωρία του, δίνει ένα παράδειγμα οξαλικού οξέος, και του άλατος που προκύπτει όταν συνδυάζεται με χλωρίδιο, που σημαίνει απώλεια όξινων ιδιοτήτων. Υποστηρίζει, χρησιμοποιώντας το παράδειγμα τόσο των οργανικών όσο και των ανόργανων ενώσεων, ότι το τμήμα τους που περιέχει οξυγόνο μπορεί να αντιδράσει με βάσεις και να τις χάσει χωρίς να χάσει την επαφή με το τμήμα που περιέχει χλώριο. Αυτή ακριβώς η πτυχή, σύμφωνα με τον χημικό, είναι η κύρια παράλειψη που έκανε ο Ντούμας στα πειράματά του, αφού. δεν διέψευσε ούτε επιβεβαίωσε αυτό το γνωστό γεγονός.
Προκειμένου να εξηγήσει με κάποιο τρόπο τα αποτελέσματα που έλαβε ο Dumas, ο Berzelius προβάλλει την υπόθεση: «Το χλωροξικό οξύ του Dumas,
προφανώς ανήκει σε αυτή την κατηγορία ενώσεων. σε αυτό συνδέεται η ρίζα άνθρακα
τόσο το οξυγόνο όσο και το χλώριο. Μπορεί επομένως να είναι οξαλικό οξύ, σε
στην οποία το μισό του οξυγόνου αντικαθίσταται από χλώριο, ή μια ένωση 1 ατόμου
(μόρια) οξαλικού οξέος με 1 άτομο (μόριο) σεσκιχλωριούχου άνθρακα
C2Cl6. Η πρώτη υπόθεση δεν μπορεί να γίνει αποδεκτή γιατί το παραδέχεται
η δυνατότητα αντικατάστασης χλωρίου 11/2, άτομα οξυγόνου (Σύμφωνα με τον Berzelius, οξαλικό
το οξύ ήταν C2O3.). Ο Ντούμας, από την άλλη, προσκολλάται στην τρίτη ιδέα, εντελώς
ασυμβίβαστο με τα δύο παραπάνω, σύμφωνα με τα οποία το χλώριο δεν αντικαθιστά το οξυγόνο, αλλά
ηλεκτροθετικό υδρογόνο, σχηματίζοντας υδρογονάνθρακα C4Cl6, που έχει το ίδιο
ιδιότητες μιας πολύπλοκης ρίζας, όπως το C4H6 ή το ακετύλιο, και υποτίθεται ότι μπορεί να 3
άτομα οξυγόνου για να δώσει ένα οξύ ταυτόσημο σε ιδιότητες με το U., αλλά, όπως μπορείτε να δείτε
από τη σύγκριση (των φυσικών τους ιδιοτήτων), εντελώς διαφορετική από αυτήν»
Όμως οι σπόροι που φύτεψε ο Δουμάς έδωσαν τους βλαστούς τους. Τώρα πολλοί επιστήμονες έχουν γυρίσει την πλάτη τους στη θεωρία του Berzelius και συνέχισαν να καινοτομούν. Έτσι ο Charles Frederic Gerard για πρώτη φορά, σε αντίθεση με τη θεωρία των ριζών (δημιουργός και υποστηρικτής της οποίας ήταν ο Berzelius), διαπίστωσε ότι οι ρίζες δεν υπάρχουν ανεξάρτητα, αλλά είναι ατομικές ομάδες - «υπολείμματα», ο συνδυασμός των οποίων σχηματίζει ένα μόριο . Στο δοκίμιό του "On the Basicity of Acids" το 1851, ανέπτυξε τη θεωρία των τύπων, σύμφωνα με την οποία όλες οι χημικές ενώσεις μπορούν να ταξινομηθούν ως παράγωγα τεσσάρων τύπων - υδρογόνο, υδροχλώριο, νερό και αμμωνία. Συγκεκριμένα, υπήρχε μια σκέψη για την ομοιότητα της σύστασης του τριχλωροξικού οξέος και του οξικού οξέος. Στην υπεράσπισή του, ο Berzelius απαντά: «Ο Gerard εξέφρασε μια νέα άποψη για τη σύνθεση του αλκοόλ, του αιθέρα και του
παράγωγα; έχει ως εξής: μια γνωστή ένωση χρωμίου, οξυγόνου και χλωρίου έχει
τύπος \u003d CrO2Cl2, το χλώριο αντικαθιστά το άτομο οξυγόνου σε αυτό (Συνεπάγεται
Berzelius 1 άτομο οξυγόνου χρωμικού ανυδρίτη - CrO3). U. οξύ C4H6 + 3O
περιέχει 2 άτομα (μόρια) οξαλικού οξέος, εκ των οποίων ολόκληρο
οξυγόνο που αντικαθίσταται από υδρογόνο = C2O3+C2H6.» Αλλά ένα τέτοιο παιχνίδι αριθμών δεν είχε την εξουσία της θεωρίας και ένα χρόνο αργότερα ο Ντούμας έδωσε ένα συντριπτικό πλήγμα, αναπτύσσοντας τη θεωρία των τύπων, ερευνώντας τις παρόμοιες ιδιότητες του τριχλωροξικού οξέος και του οξικού οξέος στην αντίδραση αποσύνθεσης, υπό την επίδραση του αλκάλια.
Από την άλλη, ο Λίμπιγκ και ο Γκράχαμ μίλησαν δημόσια υπέρ
μεγαλύτερη απλότητα που επιτυγχάνεται με βάση τη θεωρία της υποκατάστασης, κατά την εξέταση
Λήφθηκαν παράγωγα χλωρίου του συνηθισμένου αιθέρα και μυρμηκικού και εστέρες U. οξέος
Μαλαγούτι.
Ο Berzelius, υποχωρώντας στην πίεση νέων γεγονότων, στην 5η έκδ. του
"Lehrbuch der Chemie" (Πρόλογος με τον Νοέμβριο του 1842), στη σελίδα 709,
ξεχνώντας την αιχμηρή κριτική του για τον Τζέραρντ, βρήκε δυνατό να γράψει τα εξής: «Αν εμείς
θυμηθείτε τη μετατροπή (αποσύνθεση στο κείμενο) του U. οξέος υπό την επίδραση του χλωρίου σε
χλωροοξαλικό οξύ (Chloroxalsaure - Chloroxalsaure - Berzelius calls
τριχλωροξικό οξύ. , τότε εμφανίζεται
είναι δυνατή μια άλλη άποψη της σύνθεσης του U. οξέος, δηλαδή, μπορεί να συνδυαστεί οξαλικό οξύ, στο οποίο η συνδυασμένη ομάδα (Paarling) είναι C2H6, όπως η συνδυασμένη ομάδα στο χλωροοξαλικό οξύ είναι C2Cl6, και στη συνέχεια η επίδραση του χλωρίου στο Το U. οξύ θα συνίστατο μόνο στη μετατροπή του C2H6 σε C2Cl6. Είναι σαφές ότι είναι αδύνατο να αποφασίσουμε εάν μια τέτοια αναπαράσταση είναι πιο σωστή ..., ωστόσο, είναι χρήσιμο να δώσουμε προσοχή στην πιθανότητα της.
Όμως στο σύνταγμα των υποστηρικτών της θεωρίας των τύπων έφτασαν όλα. Το σημείο εκκίνησης για το έργο του Kolbe ήταν η μελέτη μιας κρυσταλλικής ουσίας, της σύνθεσης CCl4SO2, που λήφθηκε νωρίτερα από τους Berzelius και Marse από τη δράση του aqua regia στο CS2 και σχηματίστηκε από τον Kolbe από τη δράση του υγρού χλωρίου στο CS2. Σχεδόν μεταμορφώσεις, ο Kolbe έδειξε ότι αυτό
το σώμα αντιπροσωπεύει, με σύγχρονους όρους, ανυδρίτη χλωρίου
τριχλωρομεθυλοσουλφονικό οξύ, CCl4SO2 \u003d CCl3.SO2Cl, το οποίο, υπό την επίδραση αλκαλίων, μπορεί να δώσει άλατα του αντίστοιχου οξέος - CCl3.SO2 (OH), το οποίο, υπό την επίδραση ψευδάργυρου, αντικαθιστά πρώτα ένα άτομο Cl με υδρογόνο, σχηματίζοντας το οξύ CHCl2.SO2 (OH) Ενυδατωμένο νερό, ως συνήθως, από Berzelius μη αποδεκτό
υπόψη.), και μετά ένα άλλο, σχηματίζοντας το οξύ CH2Cl.SO2 (OH) [σύμφωνα με τον Kolbe -
Chlorelaylunterschwefelsaure], και, τέλος, όταν αποκατασταθεί με ρεύμα ή κάλιο
αμάλγαμα (Η αντίδραση λίγο πριν εφαρμόστηκε από τον Melsance για
αναγωγή του τριχλωροξικού οξέος σε οξικό οξύ.) αντικαθιστά με υδρογόνο και τα τρία
Άτομο Cl, σχηματίζοντας μεθυλοσουλφονικό οξύ. CH3.SO2(OH) [σύμφωνα με τον Kolbe -
Methylunterschwefelsaure].
Αναλογία αυτών των ενώσεων με χλωροοξικά οξέα
τράβηξε ακούσια τα βλέμματα. όντως με τους τότε τύπους δύο
παράλληλες σειρές, όπως φαίνεται από τον παρακάτω πίνακα: H2O+C2Cl6.S2O5
H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5
H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Αυτό δεν ξέφυγε από τον Kolbe,
που σημειώνει (Ι. σελ. σελ. 181): «στα συνδυασμένα θειούχα οξέα που περιγράφονται παραπάνω
οξέα και απευθείας σε χλωροανθρακικό θειικό οξύ (παραπάνω -
H2O + C2Cl6.S2O5) γειτνιάζει με το χλωροοξαλικό οξύ, επίσης γνωστό ως
χλωροοξικό οξύ. Υγρός χλωράνθρακας - CCl (Cl=71, C=12, τώρα γράφουμε
Το C2Cl4 είναι χλωροαιθυλένιο.), είναι γνωστό ότι μετατρέπεται στο φως υπό την επίδραση
χλώριο σε - εξαχλωροαιθάνιο και μπορεί να αναμένεται ότι εάν υποβληθεί ταυτόχρονα στη δράση του νερού, τότε, όπως το χλωριούχο βισμούθιο, το χλώριο αντιμόνιο κ.λπ., κατά τη στιγμή του σχηματισμού, θα αντικαταστήσει το χλώριο με οξυγόνο. Η εμπειρία επιβεβαίωσε την υπόθεση.«Υπό τη δράση του φωτός και
χλώριο σε C2Cl4, το οποίο ήταν κάτω από το νερό, έλαβε ο Kolbe μαζί με εξαχλωροαιθάνιο
και τριχλωροξικό οξύ και εξέφρασε τον μετασχηματισμό ως εξής: (Δεδομένου ότι C2Cl4
μπορεί να ληφθεί από το CCl4 περνώντας το από έναν θερμαινόμενο) σωλήνα και το CCl4
σχηματίζεται από τη δράση, κατά τη θέρμανση, του Cl2 στο CS2, τότε ήταν η αντίδραση Kolbe
η πρώτη σύνθεση U. οξέος από τα στοιχεία.) «Σχηματίζεται ταυτόχρονα
και ελεύθερο οξαλικό οξύ, είναι δύσκολο να αποφασιστεί, αφού στο φως χλώριο αμέσως
το οξειδώνει σε U. οξύ "...
Η άποψη του Berzelius για το χλωροοξικό οξύ
«παραδόξως (auf eine tiberraschende Weise) επιβεβαιώνεται
την ύπαρξη και τον παραλληλισμό των ιδιοτήτων των συνδυασμένων θειούχων οξέων, και, όπως Ι
φαίνεται (λέει ο Kolbe I. σ. σελ. 186), ξεφεύγει από τη σφαίρα των υποθέσεων και
αποκτά υψηλό βαθμό πιθανότητας.
Η προνοητικότητα του για περαιτέρω ανακαλύψεις της φύσης οργανικά οξέαεπιβεβαιώνεται από άρθρο στο οποίο, στηριζόμενος σε πειράματα, γράφει: «Όχι
είναι απίστευτο ότι θα αναγκαστούμε στο μέλλον να παίρνουμε για συνδυασμένα οξέα
ένας σημαντικός αριθμός εκείνων των οργανικών οξέων στα οποία επί του παρόντος, λόγω
τους περιορισμούς των πληροφοριών μας - δεχόμαστε υποθετικούς ριζοσπάστες...».
Η θεωρία των ριζών είναι επίσης χαρακτηριστική γι 'αυτόν, επιβεβαιώνοντας όσα έχουν ήδη ειπωθεί, προσθέτει επίσης: «Όσον αφορά τα φαινόμενα υποκατάστασης σε αυτά τα συνδυασμένα οξέα, λαμβάνουν μια απλή εξήγηση υπό την προϋπόθεση ότι διάφορες, πιθανώς ισόμορφες ενώσεις μπορούν να αντικαταστήσουν ο ένας τον άλλον στο ρόλο του συνδυασμού ομάδων που δεν αλλάζουν σημαντικά τις όξινες ιδιότητες του σώματος σε συνδυασμό με αυτές!
Βρίσκουμε περαιτέρω πειραματική επιβεβαίωση αυτής της άποψης στο άρθρο των Frankland και Kolbe: «Με βάση την ιδέα ότι όλα τα οξέα της σειράς
(CH2)2nO4, κατασκευασμένο σαν μεθυλοοξαλικό οξύ (Τώρα γράφουμε CnH2nO2 και
ονομάζουμε μεθυλοοξαλικό οξύ - οξικό. συνδυασμένο σε
μυρμηκικό οξύ, το υδρογόνο συμμετέχει στην αντίδραση μόνο επειδή συνδυάζεται με
κυανιούχο, σχηματίζει υδροκυανικό οξύ: αντίστροφη εκπαίδευσημυρμηκικό οξύ από
Το υδροκυάνιο υπό την επίδραση των αλκαλίων δεν είναι παρά μια επανάληψη
γνωστή μετατροπή κυανίου διαλυμένου στο νερό σε οξαλικό οξύ και αμμωνία,
με αυτή τη μόνη διαφορά? ότι τη στιγμή του σχηματισμού, το οξαλικό οξύ συνδυάζεται με
υδροκυανικό οξύ."
Το γεγονός ότι το κυανίδιο του βενζολίου (C6H5CN), για παράδειγμα, σύμφωνα με τον Fehling, δεν έχει όξινες ιδιότητες και δεν σχηματίζει το μπλε της Πρωσίας μπορεί, σύμφωνα με τους Kolbe και Fankland, να παραλληλιστεί με την αδυναμία του αιθυλοχλωριδίου να αντιδράσει με το AgNO3, και ορθότητα της κατάδειξής τους Kolbe και
Frankland αποδεικνύουν με σύνθεση σύμφωνα με τη μέθοδο των νιτριλίων (Πήραν νιτρίλια
απόσταξη sernovic οξέων με KCN (μέθοδος Dumas και Malagutti με Leblanc):
R".SO3 (OH) + KCN \u003d R.CN + KHSO4) U., προπιονικό (σύμφωνα με το τότε, μετ-ακετόνη,) και
καπροϊκό οξύ.
Στη συνέχεια, το επόμενο έτος, ο Kolbe ηλεκτρολύει αλκαλικά
άλατα μονοβασικών κορεσμένων οξέων και, σύμφωνα με το σχήμα του, παρατηρούνται σε
Ταυτόχρονα, κατά την ηλεκτρόλυση του οξικού οξέος, σχηματίζεται αιθάνιο, ανθρακικό οξύ και
υδρογόνο:
H2O+C2H6.C2O3=H2+,
και στην ηλεκτρόλυση βαλερικού - οκτανίου, ανθρακικού οξέος και υδρογόνου: H2O + C8H18.C2O3 \u003d H2 +.
Τα έργα του Kolbe, η δομή του οξικού οξέος, και ταυτόχρονα όλα
άλλα οργανικά οξέα αποσαφηνίστηκε τελικά και ο ρόλος των επόμενων χημικών
περιορίζεται μόνο σε διαίρεση - λόγω θεωρητικών εκτιμήσεων και της εξουσίας του Gerard,
Οι τύποι του Kolbe στο μισό και η μετάφρασή τους στη γλώσσα των δομικών απόψεων,
εξαιτίας του οποίου ο τύπος C2H6.C2O4H2 μετατράπηκε σε CH3.CO(OH).
Τρόποι για να πάρετε:
Η κύρια τεχνική μέθοδος για την παραγωγή οξικού οξέος είναι η οξείδωση της ακεταλδεΰδης με ατμοσφαιρικό οξυγόνο παρουσία καταλυτών μαγγανίου.
ακεταλδεΰδη οξικό οξύ
Χημικές ιδιότητες:
ΑΛΛΗΛΕΠΙΔΡΑΣΗ:
μέταλλα
Οξικό οξύ Οξεικό μαγνήσιο
Εφαρμογή:
Το οξικό οξύ χρησιμοποιείται ευρέως στη βιομηχανία για:
- Κονσερβοποίηση κρέατος και προϊόντων ψαριών,
- Κατασκευή συνθετικών (οξικών) ινών,
- παραγωγή ζιζανιοκτόνων,
- Σύνθεση αρωματικών ουσιών και διαλυτών,
- Στη βιομηχανία δέρματος, κλωστοϋφαντουργίας και άλλων,
- Ευρέως χρησιμοποιούμενα άλατα οξικού οξέος - οξικών.
Αναμφίβολα, ο πιο ευέλικτος από τους γνωστούς διαλύτες που σχετίζονται με τα αλειφατικά μονοβασικά οξέα είναι το γνωστό οξικό οξύ. Έχει και άλλα ονόματα: απόσταγμα ξυδιούή αιθανοϊκό οξύ. Το χαμηλό κόστος και η διαθεσιμότητα σε διαφορετικές συγκεντρώσεις (από 3 έως 100%) αυτής της ουσίας, η σταθερότητα και η ευκολία καθαρισμού της, έχουν οδηγήσει στο γεγονός ότι σήμερα είναι ο καλύτερος και πιο διάσημος παράγοντας που έχει τις ιδιότητες να διαλύει τις περισσότερες ουσίες βιολογικής προέλευσης, η οποία έχει μεγάλη ζήτηση σε διάφορους τομείς ανθρώπινη δραστηριότητα.
Το οξικό οξύ και, κατά συνέπεια, η δυνατότητα χρήσης του σε μεμονωμένες βιομηχανίες, μπορεί να ποικίλλουν σε συγκέντρωση. Χωρίζεται σε τρόφιμα, δηλαδή ξύδι (3-15%), και τεχνική - ουσία ξυδιού (70-80%) και πάγο (100%).
Τόσο σε επίπεδο νοικοκυριού όσο και γενικότερα σε Βιομηχανία τροφίμων, ένα διάλυμα χαμηλής συγκέντρωσης έχει μεγάλη ζήτηση, το ποσοστό οξικού οξέος στο οποίο είναι περίπου 3-15%. Είναι καρυκευμένο με έτοιμα πιάτα, χρησιμοποιείται για τον αρωματισμό πολλών προϊόντων, είναι απαραίτητο για κονσερβοποίηση, μαρινάρισμα και αλάτισμα κρέατος και προϊόντων ψαριού κ.λπ.
Τεχνικός οξικό οξύ 70, αγοράτο οποίο, σε αντίθεση με τα τρόφιμα, δεν μπορεί να βρεθεί σε ένα συνηθισμένο παντοπωλείο, χρησιμοποιείται ενεργά στη χημική βιομηχανία ως εξαιρετικός διαλύτης και ένα χημικό αντιδραστήριο που συνθέτει άλλες ουσίες, για παράδειγμα, ακετόνη.
Η ουσία τεχνικής ξιδιού χρησιμοποιείται συχνά στην ιατρική (για παράδειγμα, ασπιρίνη), τον πολτό και το χαρτί (στη βαφή και την εκτύπωση), το χρώμα και το βερνίκι, την αρωματοποιία υφασμάτων, το δέρμα και άλλους βιομηχανικούς τομείς. Χρησιμοποιείται για το συνδυασμό αρωματικών ουσιών, την παραγωγή ζιζανιοκτόνων και τη δημιουργία οξικών (συνθετικών) ινών.
Η σημασία του οξικού οξέος στην ιατρική και φαρμακευτική βιομηχανίαείναι επίσης υπέροχο. Αυτή η ουσία είναι αναπόσπαστο συστατικό μιας σειράς φαρμάκων και φάρμακαόπως άλατα μολύβδου και οξικού αλουμινίου, Ακετυλοσαλυκιλικό οξύ. Σε συνδυασμό, χρησιμοποιούνται στη θεραπεία πολλών φλεγμονώδεις διεργασίεςκαι διάφορες ασθένειες, κυρίως πεντικουλίτιδα, δηλητηρίαση από αλκοόλ, λειχήνες, ριζίτιδα, πολυαρθρίτιδα κ.λπ.
Ουσία ξυδιού, καθώς και διαλύτης 646, τιμήπου είναι επίσης μικρό, μπορείτε να το αγοράσετε σχεδόν σε οποιοδήποτε κατάστημα οικιακών ειδών χωρίς εξαίρεση. Μπορείτε επίσης να το παραγγείλετε και να το αγοράσετε γρήγορα μέσω Διαδικτύου. Το κόστος θα είναι φθηνότερο. Αυτό είναι ιδιαίτερα επωφελές για όσους εργάζονται στη βιομηχανία, όπου απαιτούνται σημαντικές ποσότητες και όπου το οξικό οξύ, όπως άλλα χημικούς διαλύτες, πωλείται σε μπουκάλια και βαρέλια πολλών λίτρων. Επομένως, είναι καλύτερο να το αγοράσετε από προμηθευτές που έχουν ήδη αποδείξει τον εαυτό τους και τα προϊόντα τους σε αυτήν την αγορά.
Προβλήθηκε: 11.857 φορές
Το οξικό οξύ (Οξικό οξύ, αιθανοϊκό οξύ, Ε260) είναι ένα ασθενές, περιοριστικό μονοβασικό καρβοξυλικό οξύ.
Το οξικό οξύ είναι ένα άχρωμο υγρό με χαρακτηριστική πικάντικη οσμή και ξινή γεύση. Υγροσκοπικός. Απεριόριστα διαλυτό στο νερό. Χημικός τύπος CH3COOH.
Ένα υδατικό διάλυμα οξικού οξέος 70-80% ονομάζεται οξική ουσία και το 3-6% ονομάζεται ξύδι. Τα υδατικά διαλύματα οξικού οξέος χρησιμοποιούνται ευρέως στη βιομηχανία τροφίμων και στην οικιακή μαγειρική, καθώς και στην κονσερβοποίηση.
Προϊόν φυσικής ξινίσματος ξηρών κρασιών σταφυλιού και ζύμωσης αλκοολών και υδατανθράκων. Συμμετέχει στο μεταβολισμό στο σώμα. Χρησιμοποιείται ευρέως στην παρασκευή κονσερβοποιημένων τροφίμων, μαρινάδων, βινεγκρέτ.
Το οξικό οξύ χρησιμοποιείται για τη λήψη φαρμακευτικών και αρωματικών ουσιών, ως διαλύτης (για παράδειγμα, στην παραγωγή οξικής κυτταρίνης, ακετόνης). Χρησιμοποιείται στην εκτύπωση και τη βαφή.
Τα άλατα και οι εστέρες του οξικού οξέος ονομάζονται οξικά.
Το πρόσθετο τροφίμων E260 είναι γνωστό σε όλους ως οξικό οξύ ή ξύδι. Το πρόσθετο E260 χρησιμοποιείται στη βιομηχανία τροφίμων ως ρυθμιστής οξύτητας. Βασικά, το οξικό οξύ χρησιμοποιείται σε μορφή υδατικών διαλυμάτων σε αναλογία 3-9% (ξύδι) και 70-80% (οξική ουσία). Το πρόσθετο E260 έχει μια χαρακτηριστική πικάντικη οσμή. Σε υδατικά διαλύματα, ο ρυθμιστής οξύτητας Ε260 είναι ένα μάλλον ασθενές οξύ. Στην καθαρή του μορφή, το οξικό οξύ είναι ένα άχρωμο, καυστικό υγρό που απορροφά την υγρασία από περιβάλλονκαι κατάψυξη ήδη σε θερμοκρασία 16,5 ° C με σχηματισμό στερεών άχρωμων κρυστάλλων. Ο χημικός τύπος του οξικού οξέος είναι C 2 H 4 O 2 .
Το ξύδι είναι γνωστό εδώ και χιλιάδες χρόνια ως φυσικό προϊόν ζύμωσης μπύρας ή κρασιού. Το 1847, ο Γερμανός χημικός Hermann Kolbe συνέθεσε για πρώτη φορά οξικό οξύ στο εργαστήριο. Τώρα στον κόσμο, μόνο το 10% της συνολικής παραγωγής οξικού οξέος εξάγεται με φυσικές μεθόδους. Αλλά η φυσική μέθοδος ζύμωσης εξακολουθεί να είναι σημαντική, καθώς πολλές χώρες έχουν νόμους που απαιτούν τη χρήση μόνο οξικού οξέος με βιολογική βάση στη βιομηχανία τροφίμων. Στη βιοχημική παραγωγή του πρόσθετου Ε260 χρησιμοποιείται η ικανότητα ορισμένων βακτηρίων να οξειδώνουν την αιθανόλη (αλκοόλη). Αυτή η μέθοδοςγνωστή ως οξική ζύμωση. Ως πρώτες ύλες για την παραγωγή του πρόσθετου Ε260 χρησιμοποιούνται χυμοί που έχουν υποστεί ζύμωση, κρασί ή διάλυμα αλκοόλης σε νερό. Υπάρχει επίσης ένας αριθμός βιομηχανικών μεθόδων για τη σύνθεση οξικού οξέος. Το πιο δημοφιλές από αυτά, που αντιπροσωπεύει περισσότερο από το ήμισυ της παγκόσμιας σύνθεσης οξικού οξέος, είναι η καρβονυλίωση της μεθανόλης παρουσία καταλυτών. Τα αρχικά συστατικά αυτής της αντίδρασης είναι η μεθανόλη (CH 3 OH) και το μονοξείδιο του άνθρακα (CO).
Το οξικό οξύ είναι απαραίτητο για να λειτουργήσει ανθρώπινο σώμα. Τα παράγωγά του βοηθούν στη διάσπαση των υδατανθράκων και των λιπών στο σώμα που εισέρχονται στο σώμα με την τροφή. Το οξικό οξύ απελευθερώνεται κατά τη διάρκεια της ζωτικής δραστηριότητας ορισμένων τύπων βακτηρίων, ιδίως Clostridium acetobutylicumκαι βακτήρια του γένους Acetobacter. Αυτά τα βακτήρια βρίσκονται παντού στο νερό, το έδαφος, τα τρόφιμα και Φυσικάεισέλθουν στο ανθρώπινο σώμα.
Η τοξική επίδραση του πρόσθετου Ε260 στον ανθρώπινο οργανισμό εξαρτάται από το βαθμό αραίωσης του οξικού οξέος με νερό. Διαλύματα στα οποία η συγκέντρωση οξικού οξέος είναι πάνω από 30% θεωρούνται επικίνδυνα για την υγεία και τη ζωή. Το υψηλής συγκέντρωσης οξικό οξύ σε επαφή με το δέρμα και τους βλεννογόνους μπορεί να προκαλέσει σοβαρά χημικά εγκαύματα.
Στη βιομηχανία τροφίμων, το πρόσθετο Ε260 χρησιμοποιείται για το ψήσιμο ειδών ζαχαροπλαστικής, την κονσερβοποίηση λαχανικών, την παραγωγή μαγιονέζας και άλλων προϊόντων διατροφής.
Ο ρυθμιστής οξύτητας E260 έχει εγκριθεί για χρήση σε τρόφιμασε όλες τις χώρες, ως πρόσθετο ασφαλές για την ανθρώπινη υγεία.
Το οξικό οξύ χρησιμοποιείται επίσης:
- στην καθημερινή ζωή (αφαίρεση αλάτων από βραστήρες, φροντίδα επιφανειών).
- στη χημική βιομηχανία (ως διαλύτης και χημικός παράγοντας).
- στην ιατρική (απόκτηση φαρμάκων).
- σε άλλους κλάδους.
Το συντηρητικό τροφίμων E260 Το οξικό οξύ είναι γνωστό σε όλους τους ανθρώπους που ενδιαφέρονται για την τέχνη της γαστρονομίας. Αυτό το προϊόν είναι το αποτέλεσμα της ξινίσματος των κρασιών σταφυλιού υπό φυσικές συνθήκες, υπό τις οποίες ζυμώνονται το αλκοόλ και οι υδατάνθρακες. Επιπλέον, είναι γνωστό ότι το οξικό οξύ εμπλέκεται άμεσα στις μεταβολικές διεργασίες στο ανθρώπινο σώμα.
Το οξικό οξύ έχει έντονη οσμή, αλλά καθαρή μορφήείναι ένα εντελώς άχρωμο υγρό που μπορεί να απορροφήσει την υγρασία από το περιβάλλον. Αυτή η ουσία είναι ικανή να παγώσει σε θερμοκρασία μείον 16 βαθμών, με αποτέλεσμα να σχηματίζει διαφανείς κρυστάλλους.
Αξιοσημείωτο είναι ότι ένα διάλυμα 3-6% οξικού οξέος ονομάζεται ξίδι, ενώ σε ποσοστό 70-80 τοις εκατό προκύπτει ουσία ξιδιού. Οι λύσεις με βάση το νερό E260 χρησιμοποιούνται ευρέως όχι μόνο στη βιομηχανία τροφίμων, αλλά και στην οικιακή μαγειρική. Η κύρια εφαρμογή του συντηρητικού τροφίμων Ε260 Οξικό οξύ είναι η παρασκευή μαρινάδων και κονσερβοποιημένων τροφίμων.
Επιπλέον, αυτή η ουσία προστίθεται ενεργά και όταν εργοστασιακή παραγωγήμια σειρά από προϊόντα ζαχαροπλαστικής, καθώς και μαγιονέζα και κονσέρβες λαχανικών. Συχνά, εάν είναι απαραίτητο, το συντηρητικό τροφίμων E260 Οξικό οξύ μπορεί να χρησιμοποιηθεί ως απολυμαντικό και απολυμαντικό.
Ωστόσο, η περιοχή παραγωγής τροφίμων δεν είναι η μόνη περιοχή για τη χρήση του συντηρητικού τροφίμων E260. Έτσι, χρησιμοποιείται ευρέως στη χημική παραγωγή στην παραγωγή οργανικού γυαλιού, οξικών ινών, καθώς και στην παρασκευή εστέρων και φαρμάκων.
Παρεμπιπτόντως, στη φαρμακολογία, χρησιμοποιείται ευρέως ο λεγόμενος οξικός εστέρας, ο οποίος είναι πιο γνωστός στον άνθρωπο με το όνομα ακετυλοσαλικυλικό οξύ ή ασπιρίνη. Ως διαλύτης, το οξικό οξύ βοηθά επίσης τους ανθρώπους σε πολλές περιπτώσεις και τα άλατα που απομονώνονται από τη σύνθεσή του χρησιμοποιούνται με επιτυχία στην καταπολέμηση των παρασίτων των φυτών.
Βλάβη του συντηρητικού τροφίμων E260 Οξικό οξύ
Η βλάβη του συντηρητικού τροφίμων E260 Οξικό οξύ για τον άνθρωπο είναι ιδιαίτερα εμφανής όταν αυτή η ουσία καταναλώνεται σε υψηλές συγκεντρώσεις, καθώς σε αυτή τη μορφή είναι πολύ τοξική. Παρεμπιπτόντως, ο βαθμός όξινης τοξικότητας εξαρτάται άμεσα από το πόσο αραιώθηκε με νερό. Τα διαλύματα των οποίων η συγκέντρωση υπερβαίνει το 30 τοις εκατό θεωρούνται τα πιο επικίνδυνα για την υγεία. Όταν οι βλεννογόνοι ή το δέρμα έρχονται σε επαφή με συμπυκνωμένο οξικό οξύ, συμβαίνουν σοβαρά χημικά εγκαύματα.
Το συντηρητικό τροφίμων E260 Οξικό οξύ είναι εγκεκριμένο για χρήση στη βιομηχανία τροφίμων σε όλες τις χώρες του κόσμου, καθώς δεν θεωρείται επικίνδυνο για την υγεία. Το μόνο πράγμα που συνιστούν οι ειδικοί για να αποφευχθεί η πιθανή βλάβη του συντηρητικού τροφίμων E260 Οξικό οξύ είναι ο περιορισμός της χρήσης προϊόντων με αυτήν την ουσία στη σύνθεση ατόμων με ηπατικές και γαστρεντερικές παθήσεις. Τέτοια προϊόντα δεν συνιστάται να δίνονται σε παιδιά κάτω των 6-7 ετών.
Οξικό οξύ
Τα πτητικά οξέα του κρασιού είναι μονοβασικά λιπαρά οξέα με γενική φόρμουλα που περιλαμβάνεται στη σύνθεσή του.
Αυτά είναι μυρμηκικό, οξικό, προπιονικό, βουτυρικό, βαλερικό, καπρυλικό και άλλα ανώτερα λιπαρά οξέα. Το κυριότερο μεταξύ των πτητικών οξέων ως προς την ποσότητα και την αξία είναι οξικό οξύ. Όλοι οι αναλυτικοί προσδιορισμοί της πτητικής οξύτητας των κρασιών γίνονται με βάση το οξικό οξύ.
Πτητικά οξέα του κρασιούείναι υποπροϊόντα της αλκοολικής ζύμωσης. Κατά τη διάρκεια της ζύμωσης, σχηματίζεται η μικρότερη ποσότητα πτητικών οξέων στο εύρος θερμοκρασίας από 15 ºС έως 25 ºС. Πιο ψηλά και περισσότερα χαμηλές θερμοκρασίεςη ζύμωση συμβάλλει στο σχηματισμό μεγαλύτερης μάζας πτητικών οξέων. Σε συνθήκες αερόβιας ζύμωσης, σχηματίζονται λιγότερο πτητικές συνθήκες.
Τα πτητικά οξέα αποστάζονται με ατμό. Αυτή η ιδιότητα αποτελεί τη βάση όλων των μεθόδων ποσοτικού προσδιορισμού τους.
Τα άλατα των πτητικών οξέων είναι εύκολα διαλυτά στο νερό και την αλκοόλη. Οι εστέρες πτητικών οξέων σε μικρές ποσότητες είναι επιθυμητοί αναπόσπαστο μέροςμπουκέτα κρασιών και κονιάκ.
Οξικό οξύ(CH3COOH) είναι γνωστό από τα αρχαία χρόνια. Η όξινη ρίζα του ονομάζεται Ακετύλιο"από τη λατινική ονομασία του οξέος - « Οξύ Aticum» . Στην καθαρή του μορφή, το άνυδρο οξικό οξύ είναι ένα άχρωμο υγρό με έντονη οσμή που στερεοποιείται σε κρυσταλλική μάζα σε θερμοκρασίες κάτω των 16°C. Το σημείο βρασμού του οξικού οξέος είναι + 118,5 ºС.
Τόσο το ίδιο το οξικό οξύ όσο και τα άλατά του χρησιμοποιούνται στη μηχανική. Τα άλατα χρησιμοποιούνται στις βιομηχανίες κλωστοϋφαντουργίας, χημικών, δέρματος και καουτσούκ. Το ίδιο το οξικό οξύ χρησιμοποιείται για την παρασκευή ακετόνης, οξικής κυτταρίνης, αρωματικών ουσιών, χρησιμοποιείται στην ιατρική, τη βιομηχανία τροφίμων και χρησιμοποιείται για την παρασκευή μαρινάδων.
μολύβδινο ξύδι (CH3 COOH) 2Pb· Pb(Ω)2 Χρησιμοποιείται στην παραγωγή λευκού και σε χημική ανάλυσηγια την καθίζηση φαινολικών ουσιών.
Με βάση το οξικό οξύ παρασκευάζεται το λεγόμενο επιτραπέζιο ξύδι, το οποίο χρησιμοποιείται ευρέως σε μικρές ποσότητες για να αρωματίσει διάφορα πιάτα. Το φυσικό ξύδι κρασιού, που λαμβάνεται από κρασί, έχει μεγάλη ζήτηση στη μαγειρική.
Για την παρασκευή ξυδιού επιτραπέζιου κρασιού, το κρασί αραιωμένο με νερό οξινίζεται ελαφρά με ξύδι και τοποθετείται σε επίπεδες δεξαμενές ή ανοιχτά βαρέλια. Ένα φιλμ οξικών βακτηρίων εφαρμόζεται στην επιφάνεια του υγρού. Ευρεία πρόσβαση αέρα (αερισμός), πυρετόςκαι η πλήρης απουσία θειώσεως συμβάλλουν στην ταχεία ανάπτυξη βακτηρίων οξικού οξέος και στην ταχεία μετατροπή της αιθυλικής αλκοόλης σε οξικό οξύ.
Το οξικό οξύ είναι υποχρεωτικό υποπροϊόν της αλκοολικής ζύμωσης και αποτελεί το μεγαλύτερο μέρος των πτητικών οξέων.
Η αύξηση της περιεκτικότητας σε πτητικά οξέα στα κρασιά εξηγείται από την εμφάνισή τους σε πολλές ασθένειες του κρασιού και ως αποτέλεσμα της δραστηριότητας διαφόρων παθογόνα βακτήρια. Η πιο επικίνδυνη και συνάμα η πιο συχνή ασθένεια του κρασιού είναι Ξίνισμα με ξύδι.Με αυτή την ασθένεια αιθανόλητο γένος με τη δράση των οξικών βακτηρίων (Bact. aceti κ.λπ.) οξειδώνεται σε οξικό οξύ:
Η έγκαιρη αναπλήρωση, η αποθήκευση των υλικών του κρασιού σε θερμοκρασίες 10-12 ºС, η μέτρια θείωση αποτρέπει την εμφάνιση οξικού ξινίσματος στο κρασί. Τα οξικά βακτήρια είναι αερόβια και είναι πολύ ευαίσθητα στο θειικό οξύ, το οποίο περιορίζει την πρόσβαση σε οξυγόνο στο κρασί.
Για τη διόρθωση των κρασιών που υποφέρουν από οξικό ξίνισμα, μπορεί να καλλιεργηθεί ένα φιλμ σέρι στην επιφάνεια του κρασιού. Αναπτύσσεται στο κρασί, η μαγιά sherry μειώνει σημαντικά την περιεκτικότητα σε πτητικά οξέα. Τα επιτραπέζια κρασιά με υψηλή περιεκτικότητα (πάνω από 4 g/dm3) σε πτητικά οξέα, μετά την αφαίρεση της οξικής μεμβράνης, παστεριώνονται για να σκοτώσουν τα οξικά βακτήρια, αλκοολίζονται και χρησιμοποιούνται σε μείγματα συνηθισμένων δυνατών κρασιών. Τα οξικά βακτήρια μπορούν επίσης να καταστραφούν με θείωση σε δόση τουλάχιστον 100 mg/dm3 με άμεση επεξεργασία με μπεντονίτη και διήθηση κρασιού.
Πτητικά οξέα του κρασιού - 3.0 από 5 με βάση 3 ψήφους
Με τα έργα του Kolbe, η δομή του οξικού οξέος, και ταυτόχρονα όλων των άλλων οργανικών οξέων, αποσαφηνίστηκε τελικά και ο ρόλος των επόμενων χημικών περιορίστηκε μόνο σε διαίρεση - λόγω θεωρητικών εκτιμήσεων και της εξουσίας του Gerard, οι τύποι του Kolbe στο μισό και στη μετάφραση τους στη γλώσσα των δομικών όψεων, λόγω των οποίων ο τύπος C2H6.C2O4H2 μετατράπηκε σε CH3.CO(OH).
2. ιδιότητες του οξικού οξέος
Καρβοξυλικά οξέα - οργανικές ενώσεις που περιέχουν μία ή περισσότερες καρβοξυλικές ομάδες -COOH, που σχετίζονται με μια ρίζα υδρογονάνθρακα.
Ιδιότητες οξέος καρβοξυλικά οξέαοφείλονται στη μετατόπιση της πυκνότητας των ηλεκτρονίων στο καρβονυλικό οξυγόνο και στην προκύπτουσα πρόσθετη (σε σύγκριση με τις αλκοόλες) πόλωση του δεσμού Ο–Ν. Σε ένα υδατικό διάλυμα, τα καρβοξυλικά οξέα διασπώνται σε ιόντα:Με την αύξηση μοριακό βάροςη διαλυτότητα των οξέων στο νερό μειώνεται. Ανάλογα με τον αριθμό των καρβοξυλικών ομάδων, τα οξέα διακρίνονται σε μονοβασικά (μονοκαρβοξυλικά) και πολυβασικά (δικαρβοξυλικά, τρικαρβοξυλικά κ.λπ.).
Ανάλογα με τη φύση της ρίζας υδρογονάνθρακα, διακρίνονται τα κορεσμένα, τα ακόρεστα και τα αρωματικά οξέα.
Τα συστηματικά ονόματα των οξέων δίνονται με το όνομα του αντίστοιχου υδρογονάνθρακα με την προσθήκη του επιθέματος -οβάγιακαι λέξεις οξύ. Συχνά χρησιμοποιούνται και ασήμαντα ονόματα.
Μερικά κορεσμένα μονοβασικά οξέα
|
Τύπος |
Ονομα |
|
|
συστηματικός |
ασήμαντος |
|
|
μεθάνιο |
μυρμηκικός |
|
|
αιθάνιο |
οξικός |
|
|
προπάνιο |
προπιονική |
|
|
βουτάνιο |
ελαιώδης |
|
|
πεντάνιο |
βαλεριάνα |
|
|
εξάνιο |
καπρόν |
|
|
πενταδεκανοϊκό |
παλμιτική |
|
|
επταδεκανοϊκό |
στεατικός |
|
Τα καρβοξυλικά οξέα είναι εξαιρετικά αντιδραστικά. Αντιδρούν με διάφορες ουσίες και σχηματίζουν μια ποικιλία ενώσεων, μεταξύ των οποίων έχουν μεγάλη σημασία λειτουργικά παράγωγα, δηλ. ενώσεις που λαμβάνονται ως αποτέλεσμα αντιδράσεων στην καρβοξυλομάδα.
2.1 Σχηματισμός αλάτων α) κατά την αλληλεπίδραση με μέταλλα:
2RCOOH + Mg® (RCOO) 2Mg + H2
β) σε αντιδράσεις με υδροξείδια μετάλλων:
2RCOOH + NaOH ® RCOONa + H2O
Αντί για καρβοξυλικά οξέα, τα αλογονίδια οξέων τους χρησιμοποιούνται συχνότερα: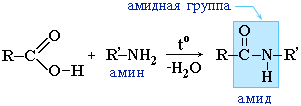 |
Τα αμίδια παίζουν σημαντικό ρόλο στη φύση. Μόρια φυσικών πεπτιδίων και πρωτεϊνών κατασκευάζονται από α-αμινοξέα με τη συμμετοχή αμιδικών ομάδων - πεπτιδικών δεσμών.
Οξεικό (αιθανοϊκό οξύ).
Τύπος: CH 3 - COOH; διαυγές άχρωμο υγρό με πικάντικη οσμή. κάτω από το σημείο τήξης (mp 16,6 βαθμοί C) μια μάζα που μοιάζει με πάγο (επομένως, το συμπυκνωμένο οξικό οξύ ονομάζεται επίσης παγόμορφο οξικό οξύ). Διαλυτό σε νερό, αιθανόλη.
Πίνακας 1. Φυσικές ιδιότητες οξικού οξέος
| Ονομα | Φόρμουλα οξέος |
Διαλυτότητα (g/100ml H2O;25°C) | Ka (στους 25°C) |
|||||
|
τα άλατά του (εστέρες) |
||||||||
|
οξικός |
αιθάνιο | |||||||
Παρόμοια άρθρα
-
Αγγλικά - ρολόι, ώρα
Όλοι όσοι ενδιαφέρονται να μάθουν αγγλικά έχουν να αντιμετωπίσουν περίεργους χαρακτηρισμούς σελ. Μ. και ένα. m , και γενικά, όπου αναφέρεται χρόνος, για κάποιο λόγο χρησιμοποιείται μόνο 12ωρη μορφή. Μάλλον για εμάς που ζούμε...
-
«Αλχημεία στο χαρτί»: συνταγές
Το Doodle Alchemy ή Alchemy on paper για Android είναι ένα ενδιαφέρον παιχνίδι παζλ με όμορφα γραφικά και εφέ. Μάθετε πώς να παίξετε αυτό το καταπληκτικό παιχνίδι και βρείτε συνδυασμούς στοιχείων για να ολοκληρώσετε το Alchemy on Paper. Το παιχνίδι...
-
Το παιχνίδι κολλάει στο Batman: Arkham City;
Εάν αντιμετωπίζετε το γεγονός ότι το Batman: Arkham City επιβραδύνει, κολλάει, το Batman: Arkham City δεν θα ξεκινήσει, το Batman: Arkham City δεν θα εγκατασταθεί, δεν υπάρχουν στοιχεία ελέγχου στο Batman: Arkham City, δεν υπάρχει ήχος, εμφανίζονται σφάλματα επάνω, στο Batman:...
-
Πώς να απογαλακτίσετε έναν άνθρωπο από τους κουλοχέρηδες Πώς να απογαλακτίσετε έναν άνθρωπο από τον τζόγο
Μαζί με έναν ψυχοθεραπευτή στην κλινική Rehab Family στη Μόσχα και έναν ειδικό στη θεραπεία του εθισμού στον τζόγο Roman Gerasimov, οι Rating Bookmakers εντόπισαν την πορεία ενός παίκτη στο αθλητικό στοίχημα - από τη δημιουργία εθισμού έως την επίσκεψη σε γιατρό,...
-
Rebuses Διασκεδαστικά παζλ γρίφους γρίφους
Το παιχνίδι "Riddles Charades Rebuses": η απάντηση στην ενότητα "RIDDLES" Επίπεδο 1 και 2 ● Ούτε ποντίκι, ούτε πουλί - γλεντάει στο δάσος, ζει στα δέντρα και ροκανίζει ξηρούς καρπούς. ● Τρία μάτια - τρεις παραγγελίες, κόκκινο - το πιο επικίνδυνο. Επίπεδο 3 και 4 ● Δύο κεραίες ανά...
-
Όροι λήψης κεφαλαίων για δηλητήριο
ΠΟΣΑ ΧΡΗΜΑΤΑ ΠΑΝΕ ΣΤΟΝ ΛΟΓΑΡΙΑΣΜΟ ΚΑΡΤΑΣ SBERBANK Σημαντικές παράμετροι των συναλλαγών πληρωμών είναι οι όροι και τα επιτόκια για πίστωση κεφαλαίων. Αυτά τα κριτήρια εξαρτώνται κυρίως από την επιλεγμένη μέθοδο μετάφρασης. Ποιες είναι οι προϋποθέσεις για τη μεταφορά χρημάτων μεταξύ λογαριασμών
