น้ำกรดอะซิติก. การใช้กรดอะซิติก
ชื่อ:
กรดน้ำส้ม(กรดเอทาโนอิก) เป็นกรดคาร์บอกซิลิก monobasic ของชุดอะลิฟาติก
สูตรเคมี:
ประวัติการเปิด:
กรดอะซิติกเป็นที่รู้จักกันมาตั้งแต่สมัยโบราณ เนื่องจากกรดอะซิติกเกิดขึ้นในระหว่างการหมักไวน์ (น้ำส้มสายชูไวน์)
แต่นักวิทยาศาสตร์เริ่มให้ความสนใจในโครงสร้างของกรดอะซิติกและสาเหตุของการเกิดขึ้นหลังจากที่ได้ตีพิมพ์กฎง่ายๆ ของ Dumas เพื่อแทนที่ไฮโดรเจนด้วยคลอรีนในสารประกอบอินทรีย์ ก่อนหน้านี้ เคมีถูกครอบงำโดยทฤษฎีที่เสนอโดย Jens Jakob Berzelius เขาแบ่งธาตุออกเป็นอิเล็กโตรโพซิทีฟและอิเล็กโตรเนกาทีฟและปฏิเสธการแทนที่ของไฮโดรเจนและคลอรีนอย่างสมบูรณ์ตามลำดับโดยไม่เปลี่ยนแปลง โครงสร้างทางเคมีสาร
ในงาน 2382 ของเขา Dumas นำเสนอรายงานต่อสถาบันการศึกษาของสวีเดนซึ่งเขาได้อุทิศหลักการเริ่มต้นของกฎง่ายๆที่เขากำหนดขึ้นสำหรับสารอินทรีย์และโดยเฉพาะกรดอะซิติก: "ในเคมีอนินทรีย์เราได้รับคำแนะนำจาก isomorphism a ทฤษฎีที่ยึดตามข้อเท็จจริง อย่างที่ทราบกันดีว่า มีเพียงไม่กี่คนที่เห็นด้วยกับทฤษฎีไฟฟ้าเคมี ในเคมีอินทรีย์ ทฤษฎีการแทนที่มีบทบาทเหมือนกัน... และบางทีอนาคตอาจแสดงให้เห็นว่ามุมมองทั้งสองมีความเกี่ยวข้องกันอย่างใกล้ชิดมากขึ้น ซึ่งเป็นไปตามสาเหตุเดียวกันและสามารถสรุปได้ภายใต้ชื่อเดียวกัน”
เขาใช้เวลาหลายปีกว่าจะได้ข้อสรุปนี้ Dumas เริ่มการทดลองครั้งแรกของเขาด้วยการศึกษากรดอะซิติก และเปลี่ยนเป็นกรดคลอโรอะซิติก ไฮโดรเจนในปฏิกิริยานี้จะถูกแทนที่ด้วยคลอรีนอย่างสมบูรณ์ในอัตราส่วน 1:1 และที่สำคัญที่สุดคือไม่มีการสูญเสียเบส คุณสมบัติทางเคมีและความสัมพันธ์ของสสารกับชั้นเรียน การทดลองเพิ่มเติมด้วยการเปลี่ยนไฮโดรเจนด้วยไอโอดีนและโบรมีนทำให้นักวิทยาศาสตร์เชื่อมั่นในเรื่องนี้ในที่สุด
ข้อสรุปเกี่ยวกับความแตกต่างพื้นฐานระหว่างการก่อตัวของสารประกอบอนินทรีย์และอินทรีย์กลายเป็นการปฏิวัติ
อย่างไรก็ตาม Berzelius ปกป้องทฤษฎีของเขาได้ยกตัวอย่างของกรดออกซาลิกและเกลือที่ได้เมื่อรวมกับคลอไรด์ซึ่งหมายถึงการสูญเสียคุณสมบัติที่เป็นกรด เขาโต้แย้งโดยใช้ตัวอย่างของสารประกอบอินทรีย์และอนินทรีย์ว่าส่วนที่ประกอบด้วยออกซิเจนของพวกมันสามารถทำปฏิกิริยากับเบสและสูญเสียพวกมันไปโดยไม่สูญเสียการสัมผัสกับส่วนที่มีคลอรีน นักเคมีกล่าวว่าแง่มุมนี้เป็นสิ่งที่ Dumas ละเลยหลักในการทดลองของเขาตั้งแต่นั้นเป็นต้นมา เขาไม่ได้หักล้างหรือยืนยันข้อเท็จจริงที่เป็นที่รู้จักกันดีนี้
เพื่อที่จะอธิบายผลลัพธ์ที่ได้รับจาก Dumas อย่างใด Berzelius เสนอสมมติฐาน: “กรดคลอโรอะซิติกของ Dumas
เห็นได้ชัดว่าเป็นของสารประกอบประเภทนี้ ในนั้นคาร์บอนเรดิคัลเชื่อมต่อกัน
ทั้งออกซิเจนและคลอรีน ดังนั้นจึงอาจเป็นกรดออกซาลิกใน
โดยที่ออกซิเจนครึ่งหนึ่งถูกแทนที่ด้วยคลอรีนหรือสารประกอบ 1 อะตอม
(โมเลกุล) ของกรดออกซาลิกที่มี 1 อะตอม (โมเลกุล) ของคาร์บอนเซสควิคลอไรด์
C2Cl6. สมมติฐานแรกรับไม่ได้เพราะยอมรับ
ความเป็นไปได้ของการเปลี่ยนคลอรีน 11/2, อะตอมออกซิเจน (ตาม Berzelius, oxalic
กรดคือ C2O3) ในทางกลับกัน Dumas ยึดติดกับความคิดที่สามอย่างสมบูรณ์
เข้ากันไม่ได้กับสองข้างต้นตามที่คลอรีนไม่ได้แทนที่ออกซิเจนแต่
ไฮโดรเจนอิเล็กโตรโพซิทีฟ ก่อตัวเป็นไฮโดรคาร์บอน C4Cl6 ซึ่งมีคุณสมบัติเหมือนกัน
คุณสมบัติของอนุมูลเชิงซ้อน เช่น C4H6 หรืออะเซทิล และคาดว่ามีความสามารถ 3
อะตอมของออกซิเจนให้กรดเหมือนกันในคุณสมบัติของ U. แต่อย่างที่คุณเห็น
จากการเปรียบเทียบ (คุณสมบัติทางกายภาพ) แตกต่างไปจากเดิมอย่างสิ้นเชิง "
แต่เมล็ดที่ปลูกโดยดูมาสก็ออกยอด ตอนนี้นักวิทยาศาสตร์หลายคนหันหลังให้กับทฤษฎีของ Berzelius และยังคงสร้างสรรค์สิ่งใหม่ ๆ ต่อไป ดังนั้น Charles Frederic Gerard เป็นครั้งแรกซึ่งตรงกันข้ามกับทฤษฎีของอนุมูล (ผู้สร้างและผู้ติดตามซึ่งคือ Berzelius) ยอมรับว่าอนุมูลไม่มีอยู่อย่างอิสระ แต่เป็นกลุ่มอะตอม - "สารตกค้าง" ซึ่งรวมกันเป็นโมเลกุล . ในบทความเรื่อง "On the Basicity of Acids" ในปี ค.ศ. 1851 เขาได้พัฒนาทฤษฎีของประเภทตามที่สารประกอบเคมีทั้งหมดสามารถจำแนกได้เป็นอนุพันธ์ของสี่ประเภท ได้แก่ ไฮโดรเจน ไฮโดรเจนคลอไรด์ น้ำ และแอมโมเนีย โดยเฉพาะอย่างยิ่ง มีความคิดเกี่ยวกับความคล้ายคลึงกันของรัฐธรรมนูญของกรดไตรคลอโรอะซิติกและกรดอะซิติก ในการป้องกันของเขา Berzelius โต้กลับ: “เจอราร์ดแสดงมุมมองใหม่เกี่ยวกับองค์ประกอบของแอลกอฮอล์อีเธอร์และของพวกเขา
อนุพันธ์ เป็นดังนี้ สารประกอบที่รู้จักกันดีของโครเมียม ออกซิเจน และคลอรีนมี
สูตร \u003d CrO2Cl2 คลอรีนแทนที่อะตอมออกซิเจนในนั้น (หมายถึง
Berzelius 1 อะตอมออกซิเจนของโครเมียมแอนไฮไดรด์ - CrO3) กรดยู C4H6 + 3O
ประกอบด้วย 2 อะตอม (โมเลกุล) ของกรดออกซาลิกซึ่งทั้งหมด
ออกซิเจนถูกแทนที่ด้วยไฮโดรเจน = C2O3+C2H6” แต่เกมตัวเลขดังกล่าวไม่ได้มีอำนาจของทฤษฎีนี้ และอีกหนึ่งปีต่อมา Dumas ก็ได้จัดการระเบิดครั้งใหญ่ พัฒนาทฤษฎีประเภทต่าง ๆ ศึกษาคุณสมบัติที่คล้ายคลึงกันของกรดไตรคลอโรอะซิติกและกรดอะซิติกในปฏิกิริยาการสลายตัวภายใต้อิทธิพลของ ด่าง
ในทางกลับกัน Liebig และ Graham พูดต่อสาธารณะในความโปรดปรานของ
ความเรียบง่ายที่มากขึ้นทำได้บนพื้นฐานของทฤษฎีการทดแทนเมื่อพิจารณา
อนุพันธ์คลอรีนของอีเทอร์ธรรมดาและฟอร์มิกและเอสเทอร์กรดยูที่ได้รับ
มาลากุตตี.
Berzelius ยอมจำนนต่อแรงกดดันของข้อเท็จจริงใหม่ในการตีพิมพ์ครั้งที่ 5 ของเขา
"Lehrbuch der Chemie" (คำนำทำเครื่องหมายพฤศจิกายน 1842) ในหน้า 709
ลืมคำวิจารณ์ที่เฉียบคมของเจอราร์ด เขาพบว่ามันเป็นไปได้ที่จะเขียนสิ่งต่อไปนี้: “ถ้าเรา
เรียกคืนการเปลี่ยนแปลง (การสลายตัวในข้อความ) ของกรดยูภายใต้อิทธิพลของคลอรีนเป็น
กรดคลอโรซาลิก (Chloroxalsaure - Chloroxalsaure - Berzelius โทร
กรดไตรคลอโรอะซิติก แล้วมันปรากฏ
อีกมุมมองหนึ่งขององค์ประกอบของกรด U. เป็นไปได้ กล่าวคือ สามารถรวมกรดออกซาลิกได้ ซึ่งกลุ่มที่รวมกัน (พาร์ลิ่ง) คือ C2H6 เช่นเดียวกับกลุ่มที่รวมกันในกรดคลอโรออกซาลิกคือ C2Cl6 แล้วผลของคลอรีนต่อ กรดยูจะประกอบด้วยการแปลงของ C2H6 เป็น C2Cl6 เท่านั้น เป็นที่ชัดเจนว่าเป็นไปไม่ได้ที่จะตัดสินใจว่าการเป็นตัวแทนดังกล่าวถูกต้องมากกว่าหรือไม่ ... อย่างไรก็ตามการให้ความสนใจกับความเป็นไปได้นั้นมีประโยชน์
แต่ในกองทหารของผู้สนับสนุนทฤษฎีประเภททุกอย่างก็มาถึง จุดเริ่มต้นของงานของ Kolbe คือการศึกษาสารผลึกซึ่งเป็นองค์ประกอบ CCl4SO2 ซึ่งได้รับก่อนหน้านี้โดย Berzelius และ Marse โดยการกระทำของ aqua regia บน CS2 และเกิดขึ้นโดย Kolbe โดยการกระทำของคลอรีนเปียกใน CS2 ใกล้การเปลี่ยนแปลง Kolbe แสดงให้เห็นว่าสิ่งนี้
ร่างกายเป็นตัวแทนของคลอรีนแอนไฮไดรด์
กรดไตรคลอโรเมทิลซัลโฟนิก CCl4SO2 \u003d CCl3.SO2Cl ซึ่งภายใต้อิทธิพลของด่างสามารถให้เกลือของกรดที่สอดคล้องกัน - CCl3.SO2 (OH) ซึ่งภายใต้อิทธิพลของสังกะสีจะแทนที่อะตอม Cl หนึ่งตัวด้วยไฮโดรเจนก่อน กรด CHCl2.SO2 (OH) ไฮเดรต น้ำตามปกติ โดย Berzelius ไม่ยอมรับ
เข้าบัญชี) จากนั้นอีกรูปแบบหนึ่งสร้างกรด CH2Cl.SO2 (OH) [ตาม Kolbe -
Chlorelaylunterschwefelsaure] และในที่สุดเมื่อถูกฟื้นฟูด้วยกระแสหรือโพแทสเซียม
มัลกัม (ปฏิกิริยาก่อนหน้านี้ถูกใช้โดย Melsance for
การลดกรดไตรคลอโรอะซิติกเป็นกรดอะซิติก) แทนที่ด้วยไฮโดรเจนและทั้งสาม
อะตอม Cl สร้างกรดเมทิลซัลโฟนิก CH3.SO2(OH) [ตาม Kolbe -
เมทิลลันเทอร์ชเวเฟลซาอูร์].
ความคล้ายคลึงของสารประกอบเหล่านี้กับกรดคลอโรอะซิติก
จับตาโดยไม่ได้ตั้งใจ อันที่จริงด้วยสูตรนั้นสอง
อนุกรมขนาน ดังที่เห็นจากตารางต่อไปนี้: H2O+C2Cl6.S2O5
H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5
H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 นี่ไม่ได้หนี Kolbe
ที่บันทึก (I. p. p. 181): "สำหรับกรดกำมะถันรวมที่อธิบายไว้ข้างต้น
กรดและโดยตรงในกรดกำมะถันคลอโรคาร์บอน (ด้านบน -
H2O + C2Cl6.S2O5) ติดกับกรดคลอรูซาลิกหรือที่เรียกว่า
กรดคลอโรอะซิติก คลอโรคาร์บอนเหลว - CCl (Cl=71, C=12; ตอนนี้เราเขียน
C2Cl4 คือคลอโรเอทิลีน) เป็นที่ทราบกันดีว่าถูกแปลงเป็นแสงภายใต้อิทธิพล
คลอรีนใน - เฮกซาคลอโรอีเทนและเป็นที่คาดหวังได้ว่าหากอยู่ภายใต้การกระทำของน้ำในเวลาเดียวกันเช่นบิสมัทคลอไรด์คลอรีนพลวง ฯลฯ ในช่วงเวลาของการก่อตัวจะแทนที่คลอรีนด้วยออกซิเจน ประสบการณ์ยืนยันสมมติฐาน "ภายใต้การกระทำของแสงและ
คลอรีนบน C2Cl4 ซึ่งอยู่ใต้น้ำ Kolbe ได้รับพร้อมกับ hexachloroethane
และกรดไตรคลอโรอะซิติก และแสดงการเปลี่ยนแปลงดังนี้ (ตั้งแต่ C2Cl4
สามารถรับได้จาก CCl4 โดยผ่านท่อความร้อน) และ CCl4
เกิดขึ้นจากการกระทำเมื่อได้รับความร้อนของ Cl2 บน CS2 จากนั้นปฏิกิริยา Kolbe จะเป็น
การสังเคราะห์กรดยูจากธาตุครั้งแรก) "มันเกิดขึ้นพร้อมกันหรือไม่
และกรดออกซาลิกอิสระก็ยากจะตัดสินใจเพราะในคลอรีนเบาทันที
ออกซิไดซ์ให้เป็นกรดยู "...
มุมมองของ Berzelius เกี่ยวกับกรดคลอโรอะซิติก
"น่าแปลกใจ (auf eine tiberraschende Weise) ได้รับการยืนยัน
การดำรงอยู่และความเท่าเทียมกันของคุณสมบัติของกรดกำมะถันรวมกันและในขณะที่I
ดูเหมือน (Kolbe I. p. p. 186) กล่าว, ไปไกลกว่าขอบเขตของสมมติฐานและ
ได้รับความน่าจะเป็นสูง
มองการณ์ไกลเกี่ยวกับการค้นพบธรรมชาติต่อไป กรดอินทรีย์ได้รับการยืนยันโดยบทความซึ่งอาศัยการทดลองเขาเขียนว่า: "ไม่
ไม่น่าเชื่อว่าในอนาคตเราจะถูกบังคับให้ใช้กรดรวมกัน
กรดอินทรีย์จำนวนมากในปัจจุบันเนื่องจาก
ข้อ จำกัด ของข้อมูลของเรา - เรายอมรับอนุมูลสมมุติ ... "
ทฤษฏีของอนุมูลก็มีลักษณะเฉพาะของเขาเช่นกัน ซึ่งยืนยันสิ่งที่ได้กล่าวไปแล้ว เขายังกล่าวเสริมว่า “สำหรับปรากฏการณ์การแทนที่ในกรดรวมเหล่านี้ พวกเขาได้รับคำอธิบายง่ายๆ ในสถานการณ์ที่สารประกอบไอโซมอร์ฟิกต่างๆ สามารถทดแทนได้ ซึ่งกันและกันในบทบาทของการรวมกลุ่มไม่เปลี่ยนแปลงคุณสมบัติที่เป็นกรดของร่างกายรวมกันอย่างมีนัยสำคัญ!
เราพบการยืนยันการทดลองเพิ่มเติมของมุมมองนี้ในบทความโดย Frankland และ Kolbe: “จากแนวคิดที่ว่ากรดทั้งหมดของซีรีส์
(CH2)2nO4 สร้างเหมือนกรดเมทิลออกซาลิก (ตอนนี้เราเขียน CnH2nO2 และ
เราเรียกกรดเมทิลออกซาลิก - อะซิติก รวมกันใน
กรดฟอร์มิก ไฮโดรเจนมีส่วนร่วมในปฏิกิริยาเท่านั้นเพราะมันรวมเข้ากับ
ไซยาไนด์ สร้างกรดไฮโดรไซยานิก: การศึกษาย้อนกลับกรดฟอร์มิกจาก
ไฮโดรไซยานิกภายใต้อิทธิพลของด่างไม่มีอะไรมากไปกว่าการทำซ้ำ
การเปลี่ยนแปลงของไซยาไนด์ที่ละลายในน้ำให้เป็นกรดออกซาลิกและแอมโมเนีย
ด้วยความแตกต่างเพียงอย่างเดียวนั้น ที่ในขณะที่ก่อตัว กรดออกซาลิกจะรวมตัวกับ
กรดไฮโดรไซยานิก"
ความจริงที่ว่าเบนซีนไซยาไนด์ (C6H5CN) เช่นตาม Fehling ไม่มีคุณสมบัติเป็นกรดและไม่ก่อให้เกิดกระป๋องปรัสเซียนสีน้ำเงินตาม Kolbe และ Fankland ที่ขนานกับการที่เอทิลคลอไรด์ไม่สามารถทำปฏิกิริยากับ AgNO3 และ ความถูกต้องของการชี้ของพวกเขา Kolbe และ
แฟรงก์แลนด์พิสูจน์โดยการสังเคราะห์ตามวิธีการของไนไตรล์ (พวกเขาได้รับไนไตรล์
การกลั่นกรดเซอร์โนวิกด้วย KCN (วิธี Dumas และ Malagutti ด้วย Leblanc):
R".SO3 (OH) + KCN \u003d R.CN + KHSO4) U. , propionic (ตามนั้น, met-acetone,) และ
กรดคาโปรอิก
จากนั้นในปีต่อมา Kolbe ได้อิเล็กโทรไลต์อัลคาไลน์
เกลือของกรดอิ่มตัว monobasic และตามรูปแบบของเขาสังเกตที่
ในเวลาเดียวกัน ในระหว่างการอิเล็กโทรไลซิสของกรดอะซิติก การก่อตัวของอีเทน กรดคาร์บอนิกและ
ไฮโดรเจน:
H2O+C2H6.C2O3=H2+,
และในอิเล็กโทรไลซิสของวาเลอริก - ออกเทน กรดคาร์บอนิกและไฮโดรเจน: H2O + C8H18.C2O3 \u003d H2 +
ผลงานของ Kolbe โครงสร้างของกรดอะซิติกและในขณะเดียวกันทั้งหมด
กรดอินทรีย์อื่น ๆ ได้รับการอธิบายในที่สุดและบทบาทของนักเคมีที่ตามมา
ลดเหลือเพียงการแบ่ง - เนื่องจากการพิจารณาทางทฤษฎีและอำนาจของเจอราร์ด
สูตรของ Kolbe ครึ่งหนึ่งและการแปลเป็นภาษาของมุมมองเชิงโครงสร้าง
เนื่องจากสูตร C2H6.C2O4H2 เปลี่ยนเป็น CH3.CO(OH)
วิธีรับ:
วิธีการทางเทคนิคหลักในการผลิตกรดอะซิติกคือการเกิดออกซิเดชันของอะซีตัลดีไฮด์กับออกซิเจนในบรรยากาศเมื่อมีตัวเร่งปฏิกิริยาแมงกานีส
กรดอะซิตัลดีไฮด์อะซิติก
คุณสมบัติทางเคมี:
ปฏิสัมพันธ์:
โลหะ
กรดอะซิติก แมกนีเซียม อะซิเตท
แอปพลิเคชัน:
กรดอะซิติกใช้กันอย่างแพร่หลายในอุตสาหกรรมสำหรับ:
- ผลิตภัณฑ์เนื้อสัตว์และปลากระป๋อง
- การผลิตเส้นใยสังเคราะห์ (อะซิเตท)
- การผลิตสารกำจัดวัชพืช,
- การสังเคราะห์สารอะโรมาติกและตัวทำละลาย
- ในอุตสาหกรรมเครื่องหนัง สิ่งทอ และอุตสาหกรรมอื่นๆ
- เกลือที่ใช้กันอย่างแพร่หลายของกรดอะซิติก - อะซิเตท
ไม่ต้องสงสัยเลยว่าตัวทำละลายที่รู้จักหลากหลายที่สุดที่เกี่ยวข้องกับกรดอะลิฟาติกโมโนเบสิกคือกรดอะซิติกที่รู้จักกันดี นอกจากนี้ยังมีชื่ออื่นๆ: สาระสำคัญของน้ำส้มสายชูหรือกรดเอทาโนอิก ต้นทุนต่ำและความพร้อมใช้งานในความเข้มข้นต่างกัน (จาก 3 ถึง 100%) ของสารนี้มีความเสถียรและความสะดวกในการทำความสะอาดได้นำไปสู่ความจริงที่ว่าวันนี้เป็นสารที่ดีที่สุดและมีชื่อเสียงที่สุดที่มีคุณสมบัติในการละลายสารส่วนใหญ่ แหล่งกำเนิดอินทรีย์ซึ่งเป็นที่ต้องการอย่างมากในด้านต่าง ๆ กิจกรรมของมนุษย์
กรดอะซิติกและความเป็นไปได้ในการใช้งานในแต่ละอุตสาหกรรม อาจมีความเข้มข้นแตกต่างกันไป มันถูกแบ่งออกเป็นอาหารนั่นคือน้ำส้มสายชู (3-15%) และเทคนิค - สาระสำคัญของน้ำส้มสายชู (70-80%) และน้ำแข็ง (100%)
ทั้งในระดับครัวเรือนและโดยทั่วไปใน อุตสาหกรรมอาหาร, สารละลายเข้มข้นต่ำเป็นที่ต้องการอย่างมาก โดยคิดเป็นเปอร์เซ็นต์ของกรดอะซิติกซึ่งอยู่ที่ประมาณ 3-15% ปรุงรสด้วยอาหารสำเร็จรูป ใช้ปรุงรสผลิตภัณฑ์ต่างๆ ที่จำเป็นสำหรับการบรรจุกระป๋อง การหมัก การทำเกลือผลิตภัณฑ์จากเนื้อสัตว์และปลา ฯลฯ
เทคนิค กรดอะซิติก 70, buyซึ่งแตกต่างจากอาหารที่ไม่สามารถหาได้ในร้านขายของชำทั่วไป มีการใช้อย่างแข็งขันในอุตสาหกรรมเคมีเป็นตัวทำละลายที่ดีเยี่ยม และสารเคมีที่สังเคราะห์สารอื่นๆ เช่น อะซิโตน
สาระสำคัญของน้ำส้มสายชูทางเทคนิคมักใช้ในยา (เช่น แอสไพริน) เยื่อกระดาษและกระดาษ (ในการย้อมสีและการพิมพ์) สีและสารเคลือบเงา น้ำหอมสิ่งทอ หนัง และสาขาอุตสาหกรรมอื่นๆ มันถูกใช้เพื่อรวมสารที่มีกลิ่นหอม การผลิตสารกำจัดวัชพืช และการสร้างเส้นใยอะซิเตท (สังเคราะห์)
ความสำคัญของกรดอะซิติกในทางการแพทย์และ อุตสาหกรรมยาก็ยอดเยี่ยมเช่นกัน สารนี้เป็นส่วนประกอบสำคัญของยาหลายชนิดและ ยาเช่น เกลือตะกั่วและอะลูมิเนียมอะซิเตท กรดอะซิติลซาลิไซลิก. ร่วมกันใช้รักษาได้หลายอย่าง กระบวนการอักเสบและ โรคต่างๆ, ส่วนใหญ่ pediculosis, พิษแอลกอฮอล์, ไลเคน, radiculitis, polyarthritis ฯลฯ
สาระสำคัญของน้ำส้มสายชูเช่นเดียวกับ ตัวทำละลาย 646 ราคาซึ่งมีขนาดเล็กเช่นกันคุณสามารถซื้อได้ในร้านค้าของใช้ในครัวเรือนเกือบทุกแห่งโดยไม่มีข้อยกเว้น คุณยังสามารถสั่งซื้อและซื้อผ่านทางอินเทอร์เน็ตได้อย่างรวดเร็ว ค่าใช้จ่ายจะถูกกว่า ซึ่งเป็นประโยชน์อย่างยิ่งสำหรับผู้ที่ทำงานในอุตสาหกรรมที่ต้องการปริมาณมาก และในที่ที่มีกรดอะซิติก เช่น อื่นๆ ตัวทำละลายเคมี, จำหน่ายในขวดและถังหลายลิตร ดังนั้นจึงเป็นการดีที่สุดที่จะซื้อจากซัพพลายเออร์ที่พิสูจน์ตัวเองและสินค้าในตลาดนี้แล้ว
เข้าชม: 11,857 ครั้ง
กรดอะซิติก (กรดอะซิติก, กรดเอทาโนอิก, E260) เป็นกรดคาร์บอกซิลิกชนิดโมโนเบสิกที่อ่อนแอและจำกัด
กรดอะซิติกเป็นของเหลวไม่มีสีมีกลิ่นฉุนและมีรสเปรี้ยว ดูดความชื้น ละลายได้ไม่จำกัดในน้ำ สูตรเคมี CH3COOH.
สารละลายกรดอะซิติก 70-80% เรียกว่าน้ำส้มสายชูและ 3-6% เรียกว่าน้ำส้มสายชู สารละลายน้ำของกรดอะซิติกใช้กันอย่างแพร่หลายในอุตสาหกรรมอาหารและการปรุงอาหารในครัวเรือนตลอดจนในกระป๋อง
ผลิตภัณฑ์จากการทำให้เปรี้ยวตามธรรมชาติของไวน์องุ่นแห้งและการหมักแอลกอฮอล์และคาร์โบไฮเดรต มีส่วนร่วมในการเผาผลาญในร่างกาย มันถูกใช้กันอย่างแพร่หลายในการเตรียมอาหารกระป๋อง, หมัก, vinaigrettes
กรดอะซิติกใช้เพื่อให้ได้ยาและสารอะโรมาติกเป็นตัวทำละลาย (เช่น ในการผลิตเซลลูโลสอะซิเตท อะซิโตน) ใช้ในการพิมพ์และย้อมสี
เกลือและเอสเทอร์ของกรดอะซิติกเรียกว่าอะซิเตท
สารเติมแต่งอาหาร E260 เป็นที่รู้จักของทุกคนในชื่อกรดอะซิติกหรือน้ำส้มสายชู สารเติมแต่ง E260 ใช้ในอุตสาหกรรมอาหารเป็นตัวควบคุมความเป็นกรด โดยทั่วไปกรดอะซิติกจะใช้ในรูปของสารละลายในน้ำในสัดส่วน 3-9% (น้ำส้มสายชู) และ 70-80% (สาระสำคัญของอะซิติก) สารเติมแต่ง E260 มีกลิ่นฉุนเฉพาะตัว ในสารละลายที่เป็นน้ำ ตัวควบคุมความเป็นกรด E260 เป็นกรดที่ค่อนข้างอ่อน ในรูปแบบบริสุทธิ์ กรดอะซิติกเป็นของเหลวกัดกร่อนไม่มีสีซึ่งดูดซับความชื้นจาก สิ่งแวดล้อมและจุดเยือกแข็งที่อุณหภูมิ 16.5 ° C ด้วยการก่อตัวของผลึกไม่มีสีที่เป็นของแข็ง สูตรทางเคมีของกรดอะซิติกคือ C 2 H 4 O 2
น้ำส้มสายชูเป็นที่รู้จักมานานนับพันปีว่าเป็นผลิตภัณฑ์หมักตามธรรมชาติของเบียร์หรือไวน์ ในปี ค.ศ. 1847 แฮร์มันน์ โคลเบ นักเคมีชาวเยอรมันได้สังเคราะห์กรดอะซิติกขึ้นเป็นครั้งแรกในห้องปฏิบัติการ ขณะนี้ในโลก มีเพียง 10% ของการผลิตกรดอะซิติกทั้งหมดที่ถูกสกัดด้วยวิธีการทางธรรมชาติ แต่วิธีการหมักแบบธรรมชาติยังคงมีความสำคัญ เนื่องจากหลายประเทศมีกฎหมายที่กำหนดให้ใช้เฉพาะกรดอะซิติกชีวภาพที่ใช้ในอุตสาหกรรมอาหาร ในการผลิตทางชีวเคมีของสารเติมแต่ง E260 จะใช้ความสามารถของแบคทีเรียบางชนิดในการออกซิไดซ์เอทานอล (แอลกอฮอล์) วิธีนี้เรียกว่าการหมักอะซิติก น้ำผลไม้หมัก ไวน์ หรือสารละลายแอลกอฮอล์ในน้ำใช้เป็นวัตถุดิบในการผลิตสารเติมแต่ง E260 นอกจากนี้ยังมีวิธีการทางอุตสาหกรรมหลายวิธีในการสังเคราะห์กรดอะซิติก กรดอะซิติกที่ได้รับความนิยมมากที่สุดซึ่งคิดเป็นมากกว่าครึ่งหนึ่งของการสังเคราะห์กรดอะซิติกของโลกคือคาร์บอนิลเลชันของเมทานอลต่อหน้าตัวเร่งปฏิกิริยา ส่วนประกอบเริ่มต้นสำหรับปฏิกิริยานี้คือเมทานอล (CH 3 OH) และคาร์บอนมอนอกไซด์ (CO)
กรดอะซิติกเป็นสิ่งจำเป็นในการทำงาน ร่างกายมนุษย์. อนุพันธ์ของมันช่วยสลายคาร์โบไฮเดรตและไขมันในร่างกายที่เข้าสู่ร่างกายด้วยอาหาร กรดอะซิติกถูกปล่อยออกมาในระหว่างกิจกรรมสำคัญของแบคทีเรียบางชนิดโดยเฉพาะ Clostridium acetobutylicumและแบคทีเรียในสกุล อะซิโตแบคเตอร์. แบคทีเรียเหล่านี้พบได้ทั่วไปในน้ำ ดิน อาหาร และ โดยธรรมชาติเข้าสู่ร่างกายมนุษย์
พิษของสารเติมแต่ง E260 ต่อร่างกายมนุษย์ขึ้นอยู่กับระดับการเจือจางของกรดอะซิติกกับน้ำ สารละลายที่มีความเข้มข้นของกรดอะซิติกสูงกว่า 30% ถือว่าเป็นอันตรายต่อสุขภาพและชีวิต กรดอะซิติกที่มีความเข้มข้นสูงเมื่อสัมผัสกับผิวหนังและเยื่อเมือกอาจทำให้เกิดแผลไหม้จากสารเคมีอย่างรุนแรง
ในอุตสาหกรรมอาหาร สารเติมแต่ง E260 ใช้สำหรับการอบขนม ผักกระป๋อง การผลิตมายองเนส และผลิตภัณฑ์อาหารอื่นๆ
ตัวควบคุมความเป็นกรด E260 ได้รับการอนุมัติให้ใช้ใน ผลิตภัณฑ์อาหารในทุกประเทศเป็นสารเติมแต่งที่ปลอดภัยต่อสุขภาพของมนุษย์
กรดอะซิติกยังใช้:
- ในชีวิตประจำวัน (การกำจัดตะกรันออกจากกาต้มน้ำ, การดูแลพื้นผิว);
- ในอุตสาหกรรมเคมี (ในฐานะตัวทำละลายและสารเคมี);
- ในการแพทย์ (การได้รับยา);
- ในอุตสาหกรรมอื่นๆ
สารกันบูดอาหาร E260 กรดอะซิติกเป็นที่รู้จักกันดีสำหรับทุกคนที่มีความสนใจในศิลปะการทำอาหาร ผลิตภัณฑ์นี้เป็นผลมาจากการหมักไวน์องุ่นภายใต้สภาวะธรรมชาติภายใต้การหมักแอลกอฮอล์และคาร์โบไฮเดรต นอกจากนี้ เป็นที่ทราบกันว่ากรดอะซิติกเกี่ยวข้องโดยตรงกับกระบวนการเผาผลาญในร่างกายมนุษย์
กรดอะซิติกมีกลิ่นแรงแต่ รูปแบบบริสุทธิ์เป็นของเหลวไม่มีสีที่สามารถดูดซับความชื้นจากสิ่งแวดล้อมได้ สารนี้มีความสามารถในการแช่แข็งที่อุณหภูมิลบ 16 องศา ส่งผลให้เกิดผลึกใส
เป็นที่น่าสังเกตว่าสารละลายกรดอะซิติก 3-6% เรียกว่าน้ำส้มสายชูในขณะที่ 70-80 เปอร์เซ็นต์จะได้รับน้ำส้มสายชู สารละลายที่ใช้น้ำ E260 ใช้กันอย่างแพร่หลายไม่เพียงแต่ในอุตสาหกรรมอาหาร แต่ยังรวมถึงการปรุงอาหารในครัวเรือนด้วย การใช้งานหลักของสารกันบูดอาหาร E260 กรดอะซิติกคือการผลิตน้ำดองและอาหารกระป๋อง
นอกจากนี้สารนี้จะถูกเพิ่มอย่างแข็งขันและเมื่อ การผลิตภาคอุตสาหกรรมผลิตภัณฑ์ขนมมากมาย รวมทั้งมายองเนสและผักกระป๋อง บ่อยครั้งหากจำเป็น สารกันบูดอาหาร E260 กรดอะซิติกสามารถใช้เป็นยาฆ่าเชื้อและยาฆ่าเชื้อได้
อย่างไรก็ตาม พื้นที่การผลิตอาหารไม่ใช่พื้นที่เดียวสำหรับการใช้สารกันบูดอาหาร E260 ดังนั้นจึงใช้กันอย่างแพร่หลายในการผลิตสารเคมีในการผลิตแก้วอินทรีย์ เส้นใยอะซิเตท ตลอดจนในการผลิตเอสเทอร์และยารักษาโรค
ในทางเภสัชวิทยาเรียกว่า acetic ester กันอย่างแพร่หลายซึ่งเป็นที่รู้จักกันดีในหมู่มนุษย์ภายใต้ชื่อ acetylsalicylic acid หรือ aspirin ในฐานะที่เป็นตัวทำละลาย กรดอะซิติกยังช่วยผู้คนได้ในหลายกรณี และเกลือที่แยกได้จากองค์ประกอบของกรดนี้ก็ถูกใช้อย่างประสบความสำเร็จในการต่อสู้กับศัตรูพืช
อันตรายของวัตถุกันเสียในอาหาร E260 กรดอะซิติก
อันตรายของสารกันบูดอาหาร E260 กรดอะซิติกสำหรับมนุษย์นั้นชัดเจนโดยเฉพาะอย่างยิ่งเมื่อสารนี้ถูกบริโภคในระดับความเข้มข้นสูงเนื่องจากในรูปแบบนี้เป็นพิษมาก อย่างไรก็ตาม ระดับความเป็นพิษของกรดจะขึ้นอยู่กับปริมาณกรดที่เจือจางด้วยน้ำโดยตรง สารละลายที่มีความเข้มข้นเกิน 30 เปอร์เซ็นต์ถือว่าเป็นอันตรายต่อสุขภาพมากที่สุด เมื่อเยื่อเมือกหรือผิวหนังสัมผัสกับกรดอะซิติกเข้มข้น จะเกิดแผลไหม้จากสารเคมีอย่างรุนแรง
สารกันบูดในอาหาร E260 กรดอะซิติกได้รับการอนุมัติให้ใช้ในอุตสาหกรรมอาหารในทุกประเทศทั่วโลก เนื่องจากไม่ถือว่าเป็นอันตรายต่อสุขภาพ สิ่งเดียวที่ผู้เชี่ยวชาญแนะนำเพื่อหลีกเลี่ยงอันตรายที่อาจเกิดขึ้นจากสารกันบูดอาหาร E260 กรดอะซิติกคือการ จำกัด การใช้ผลิตภัณฑ์ที่มีสารนี้ในองค์ประกอบของผู้ที่เป็นโรคตับและทางเดินอาหาร ผลิตภัณฑ์ดังกล่าวไม่แนะนำให้มอบให้กับเด็กอายุต่ำกว่า 6-7 ปี
กรดน้ำส้ม
กรดระเหยของไวน์เป็นกรดไขมัน monobasic ที่มีสูตรทั่วไปรวมอยู่ในองค์ประกอบ
เหล่านี้ได้แก่ กรดฟอร์มิก อะซิติก โพรพิโอนิก บิวทิริก วาเลอริก คาปริลิก และกรดไขมันอื่นๆ กรดระเหยที่สำคัญในแง่ของปริมาณและมูลค่าคือ กรดน้ำส้ม. การวิเคราะห์หาค่าความเป็นกรดที่ระเหยง่ายของไวน์ทั้งหมดทำในรูปของกรดอะซิติก
กรดระเหยของไวน์เป็นผลพลอยได้จากการหมักด้วยแอลกอฮอล์ ในระหว่างการหมักกรดระเหยในปริมาณที่น้อยที่สุดจะเกิดขึ้นในช่วงอุณหภูมิตั้งแต่ 15 ºСถึง 25 ºС สูงขึ้นเรื่อย ๆ อุณหภูมิต่ำการหมักก่อให้เกิดกรดระเหยในปริมาณที่มากขึ้น ภายใต้สภาวะการหมักแบบแอโรบิกจะเกิดสภาวะผันผวนน้อยลง
กรดระเหยถูกกลั่นด้วยไอน้ำ คุณสมบัตินี้รองรับวิธีการทั้งหมดของการกำหนดเชิงปริมาณ
เกลือของกรดระเหยสามารถละลายได้ง่ายในน้ำและแอลกอฮอล์ ควรใช้เอสเทอร์ของกรดระเหยในปริมาณเล็กน้อย ส่วนสำคัญช่อไวน์และคอนญัก
กรดน้ำส้ม(CH3COOH) เป็นที่รู้จักมาตั้งแต่สมัยโบราณ กรดอนุมูลอิสระเรียกว่า อะเซทิล"จากการกำหนดกรดละติน - « กรด อะซิติคัม» . ในรูปแบบบริสุทธิ์ กรดอะซิติกปราศจากน้ำเป็นของเหลวไม่มีสีมีกลิ่นฉุนที่แข็งตัวเป็นผลึกที่อุณหภูมิต่ำกว่า 16°C จุดเดือดของกรดอะซิติกคือ +118.5 ºС
ทั้งกรดอะซิติกและเกลือของมันถูกใช้ในงานวิศวกรรม เกลือใช้ในอุตสาหกรรมสิ่งทอ เคมี หนังและยาง กรดอะซิติกนั้นใช้เพื่อเตรียมอะซิโตน, เซลลูโลสอะซิเตท, สารอะโรมาติก, ใช้ในยา, อุตสาหกรรมอาหารและใช้สำหรับเตรียมน้ำดอง
น้ำส้มสายชูตะกั่ว (CH3 COOH)2พีบี· พีบี(โอ้)2 ใช้ในการผลิตสีขาวและใน การวิเคราะห์ทางเคมีสำหรับการตกตะกอนของสารฟีนอลิก
ขึ้นอยู่กับกรดอะซิติกที่เรียกว่าน้ำส้มสายชูบนโต๊ะซึ่งใช้กันอย่างแพร่หลายในปริมาณเล็กน้อยเพื่อปรุงรสอาหารต่างๆ น้ำส้มสายชูไวน์ธรรมชาติที่ได้จากไวน์เป็นที่ต้องการอย่างมากในการปรุงอาหาร
ในการเตรียมน้ำส้มสายชูไวน์บนโต๊ะ ไวน์ที่เจือจางด้วยน้ำจะถูกทำให้เป็นกรดเล็กน้อยด้วยน้ำส้มสายชูและวางในถังแบนหรือถังเปิด ฟิล์มของแบคทีเรียอะซิติกถูกนำไปใช้กับพื้นผิวของของเหลว การเข้าถึงอากาศกว้าง (เติมอากาศ), ไข้และการขาดซัลเฟตอย่างสมบูรณ์ทำให้เกิดการพัฒนาอย่างรวดเร็วของแบคทีเรียกรดอะซิติกและการเปลี่ยนเอทิลแอลกอฮอล์เป็นกรดอะซิติกอย่างรวดเร็ว
กรดอะซิติกเป็นผลพลอยได้จากการหมักแอลกอฮอล์และประกอบด้วยกรดระเหยจำนวนมาก
การเพิ่มขึ้นของเนื้อหาของกรดระเหยในไวน์นั้นอธิบายได้จากการเกิดโรคในไวน์หลายชนิดและเป็นผลมาจากกิจกรรมต่างๆ แบคทีเรียก่อโรค. ที่อันตรายที่สุดและในขณะเดียวกันโรคไวน์ที่พบบ่อยที่สุดคือ น้ำส้มสายชูเปรี้ยวด้วยโรคนี้ เอทานอลสกุลโดยการกระทำของแบคทีเรียอะซิติก (Bact. aceti ฯลฯ ) ถูกออกซิไดซ์เป็นกรดอะซิติก:
การเติมวัสดุไวน์ในเวลาที่เหมาะสมที่อุณหภูมิ 10-12 ºСการเกิดซัลเฟตในระดับปานกลางช่วยป้องกันการเกิดกรดอะซิติกในไวน์ แบคทีเรียอะซิติกเป็นแอโรบิกและไวต่อกรดกำมะถันมาก ซึ่งจำกัดการเข้าถึงออกซิเจนในไวน์
ในการแก้ไขไวน์ที่มีกรดอะซิติกเปรี้ยว สามารถปลูกฟิล์มเชอร์รี่บนผิวของไวน์ได้ เชอร์รี่ยีสต์ที่พัฒนาจากไวน์ช่วยลดปริมาณกรดระเหยได้อย่างมาก ไวน์โต๊ะที่มีปริมาณกรดระเหยสูง (มากกว่า 4 g/dm3) หลังจากลอกฟิล์มอะซิติกออกแล้ว จะถูกพาสเจอร์ไรส์เพื่อฆ่าเชื้อแบคทีเรียอะซิติก แอลกอฮอล์ และใช้ในการผสมไวน์ที่เข้มข้นธรรมดา แบคทีเรียอะซิติกสามารถถูกทำลายได้ด้วยการใช้ซัลเฟตในขนาดอย่างน้อย 100 มก./ดม.3 ด้วยการบำบัดทันทีด้วยการกรองเบนโทไนต์และการกรองไวน์
กรดระเหยของไวน์ - 3.0 จาก 5 ขึ้นอยู่กับ 3 คะแนนโหวต
โดยผลงานของ Kolbe โครงสร้างของกรดอะซิติกและในเวลาเดียวกันกรดอินทรีย์อื่น ๆ ทั้งหมดได้รับการอธิบายในที่สุดและบทบาทของนักเคมีที่ตามมาก็ลดลงเพียงการแบ่ง - เนื่องจากการพิจารณาทางทฤษฎีและอำนาจของเจอราร์ดสูตรของ Kolbe ในครึ่ง และแปลเป็นภาษาของมุมมองเชิงโครงสร้าง เนื่องจากสูตร C2H6.C2O4H2 กลายเป็น CH3.CO(OH)
2. คุณสมบัติของกรดอะซิติก
กรดคาร์บอกซิลิก - สารประกอบอินทรีย์ที่มีหมู่คาร์บอกซิลหนึ่งกลุ่มหรือมากกว่า -COOH ซึ่งเกี่ยวข้องกับอนุมูลไฮโดรคาร์บอน
คุณสมบัติของกรด กรดคาร์บอกซิลิกเกิดจากการเปลี่ยนความหนาแน่นของอิเล็กตรอนเป็นคาร์บอนิลออกซิเจนและทำให้เกิดโพลาไรเซชันเพิ่มเติม (เมื่อเทียบกับแอลกอฮอล์) ของพันธะ О–Н ในสารละลายที่เป็นน้ำ กรดคาร์บอกซิลิกจะแยกตัวออกเป็นไอออน:ด้วยการเพิ่มขึ้น น้ำหนักโมเลกุลความสามารถในการละลายของกรดในน้ำลดลง ตามจำนวนกลุ่มคาร์บอกซิล กรดจะถูกแบ่งออกเป็น monobasic (monocarboxylic) และ polybasic (dicarboxylic, tricarboxylic เป็นต้น)
ตามลักษณะของอนุมูลไฮโดรคาร์บอนกรดอิ่มตัวไม่อิ่มตัวและอะโรมาติกมีความโดดเด่น
ชื่อกรดที่เป็นระบบจะได้รับจากชื่อของไฮโดรคาร์บอนที่สอดคล้องกันด้วยการเติมคำต่อท้าย -ovayaและคำพูด กรด. มักจะใช้ชื่อที่ไม่สำคัญเช่นกัน
กรดโมโนเบสิกอิ่มตัวบางชนิด
|
สูตร |
ชื่อ |
|
|
เป็นระบบ |
ไร้สาระ |
|
|
มีเทน |
แบบฟอร์ม |
|
|
อีเทน |
อะซิติก |
|
|
โพรเพน |
โพรพิโอนิก |
|
|
บิวเทน |
มันเยิ้ม |
|
|
เพนเทน |
valerian |
|
|
เฮกเซน |
kapron |
|
|
pentadecanoic |
palmitic |
|
|
ตับอ่อน |
สเตียริก |
|
กรดคาร์บอกซิลิกมีปฏิกิริยาสูง พวกมันทำปฏิกิริยากับสารต่าง ๆ และสร้างสารประกอบต่าง ๆ ซึ่งมีความสำคัญอย่างยิ่ง อนุพันธ์เชิงฟังก์ชัน, เช่น. สารประกอบที่ได้จากปฏิกิริยาที่กลุ่มคาร์บอกซิล
2.1 การก่อตัวของเกลือ ก) เมื่อทำปฏิกิริยากับโลหะ:
2RCOOH + Mg® (RCOO)2Mg + H2
b) ในปฏิกิริยากับโลหะไฮดรอกไซด์:
2RCOOH + NaOH ® อาร์คูน่า + H2O
แทนที่จะใช้กรดคาร์บอกซิลิก กรดเฮไลด์ของพวกมันมักถูกใช้แทน: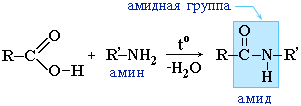 |
เอไมด์มีบทบาทสำคัญในธรรมชาติ โมเลกุลของเปปไทด์และโปรตีนธรรมชาติถูกสร้างขึ้นจากกรดอะมิโนโดยมีส่วนร่วมของกลุ่มเอไมด์ - พันธะเปปไทด์
อะซิติก (กรดเอทาโนอิก)
สูตร: CH 3 - COOH; ของเหลวใสไม่มีสีมีกลิ่นฉุน ใต้จุดหลอมเหลว (mp 16.6 องศาเซลเซียส) มวลเหมือนน้ำแข็ง (ดังนั้น กรดอะซิติกเข้มข้นจึงเรียกว่ากรดอะซิติกน้ำแข็ง) ละลายในน้ำเอทานอล
ตารางที่ 1. คุณสมบัติทางกายภาพของกรดอะซิติก
| ชื่อ | สูตรกรด |
ความสามารถในการละลาย (g/100ml H2O;25°C) | กะ (ที่อุณหภูมิ 25 องศาเซลเซียส) |
|||||
|
เกลือของมัน (เอสเทอร์) |
||||||||
|
อะซิติก |
อีเทน | |||||||
บทความที่คล้ายกัน
-
ภาษาอังกฤษ - นาฬิกา เวลา
ทุกคนที่สนใจเรียนภาษาอังกฤษต้องเจอกับการเรียกชื่อแปลกๆ น. เมตร และก. m และโดยทั่วไป ไม่ว่าจะกล่าวถึงเวลาใดก็ตาม ด้วยเหตุผลบางอย่างจึงใช้รูปแบบ 12 ชั่วโมงเท่านั้น คงจะเป็นการใช้ชีวิตของเรา...
-
"การเล่นแร่แปรธาตุบนกระดาษ": สูตร
Doodle Alchemy หรือ Alchemy บนกระดาษสำหรับ Android เป็นเกมปริศนาที่น่าสนใจที่มีกราฟิกและเอฟเฟกต์ที่สวยงาม เรียนรู้วิธีเล่นเกมที่น่าตื่นตาตื่นใจนี้และค้นหาการผสมผสานขององค์ประกอบต่างๆ เพื่อทำให้การเล่นแร่แปรธาตุบนกระดาษสมบูรณ์ เกม...
-
เกมล่มใน Batman: Arkham City?
หากคุณต้องเผชิญกับความจริงที่ว่า Batman: Arkham City ช้าลง พัง Batman: Arkham City ไม่เริ่มทำงาน Batman: Arkham City ไม่ติดตั้ง ไม่มีการควบคุมใน Batman: Arkham City ไม่มีเสียง ข้อผิดพลาดปรากฏขึ้น ขึ้นในแบทแมน:...
-
วิธีหย่านมคนจากเครื่องสล็อต วิธีหย่านมคนจากการพนัน
ร่วมกับนักจิตอายุรเวทที่คลินิก Rehab Family ในมอสโกและผู้เชี่ยวชาญด้านการรักษาผู้ติดการพนัน Roman Gerasimov เจ้ามือรับแทงจัดอันดับติดตามเส้นทางของนักพนันในการเดิมพันกีฬา - จากการก่อตัวของการเสพติดไปจนถึงการไปพบแพทย์...
-
Rebuses ปริศนาที่สนุกสนาน ปริศนา ปริศนา
เกม "Riddles Charades Rebuses": คำตอบของส่วน "RIDDLES" ระดับ 1 และ 2 ● ไม่ใช่หนู ไม่ใช่นก - มันสนุกสนานในป่า อาศัยอยู่บนต้นไม้และแทะถั่ว ● สามตา - สามคำสั่ง แดง - อันตรายที่สุด ระดับ 3 และ 4 ● สองเสาอากาศต่อ...
-
เงื่อนไขการรับเงินสำหรับพิษ
เงินเข้าบัญชีบัตร SBERBANK ไปเท่าไหร่ พารามิเตอร์ที่สำคัญของธุรกรรมการชำระเงินคือข้อกำหนดและอัตราสำหรับการให้เครดิตเงิน เกณฑ์เหล่านี้ขึ้นอยู่กับวิธีการแปลที่เลือกเป็นหลัก เงื่อนไขการโอนเงินระหว่างบัญชีมีอะไรบ้าง
