Formula bezvodne octene kiseline. Kemija: octena kiselina, sažetak
na temu:
Izradio:_____________
______________________
Provjereno:_____________
______________________
Volgograd 2004
Uvod……………………………………………………….3
1. Otkriće octene kiseline……………………..5
2. Svojstva octene kiseline……………………..13
3. Dobivanje octene kiseline……………………19
4. Upotreba octene kiseline………………….22
Zaključak………………………………………………....26
Popis korištene literature………………..…27
Uvod
OKTENA KISELINA, CH3COOH, bezbojna zapaljiva tekućina oštrog mirisa, dobro topljiva u vodi. Ima karakterističan kiselkasti okus, provodi struju.
Octena kiselina bila je jedina poznata starim Grcima. Otuda i naziv: "oksos" - kiseo, kiseo okus. Octena kiselina je najjednostavnija vrsta organskih kiselina koje su sastavni dio biljnih i životinjskih masti. U malim koncentracijama prisutan je u hrani i piću te sudjeluje u metaboličkim procesima tijekom zrenja plodova. Octena kiselina se često nalazi u biljkama, u životinjskim izlučevinama. Soli i esteri octene kiseline nazivaju se acetati.
Octena kiselina je slaba (u vodenoj otopini samo djelomično disocira). Međutim, budući da kiseli okoliš inhibira vitalnu aktivnost mikroorganizama, octena kiselina se koristi u konzerviranju prehrambeni proizvodi kao što je u marinadama.
Octena kiselina se dobiva oksidacijom acetaldehida i drugim metodama, prehrambena octena kiselina dobiva se octenokiselim vrenjem etanola. Koristi se za dobivanje ljekovitih i aromatičnih tvari, kao otapalo (na primjer, u proizvodnji celuloznog acetata), u obliku stolnog octa u proizvodnji začina, marinada i konzervirane hrane. Octena kiselina sudjeluje u mnogim metaboličkim procesima u živim organizmima. Jedna je od hlapljivih kiselina prisutnih u gotovo svim namirnicama, kiselkastog je okusa i glavni je sastojak octa.
Svrha ovog rada: proučavanje svojstava, proizvodnje i uporabe octene kiseline.
Zadaci ovu studiju:
1. Ispričajte povijest otkrića octene kiseline
2. Proučiti svojstva octene kiseline
3. Opišite metode dobivanja octene kiseline
4. Otkrijte značajke uporabe octene kiseline
1. Otkriće octene kiseline
Struktura octene kiseline bila je zanimljiva kemičarima još od Dumasovog otkrića trikloroctene kiseline, jer je to otkriće zadalo udarac tada dominantnoj Berzeliusovoj elektrokemijskoj teoriji. Potonji, raspoređujući elemente na elektropozitivne i elektronegativne, nisu prepoznali mogućnost supstitucije u organskim tvarima, bez duboke promjene u njima. kemijska svojstva , vodik (elektropozitivan element) klorom (elektronegativan element), ali se u međuvremenu, prema Dumasovim opažanjima ("Comptes rendus" Pariške akademije, 1839.), pokazalo da "uvođenje klora umjesto vodika ne potpuno mijenjaju vanjska svojstva molekule ...", zašto Dumas i postavlja pitanje "jesu li elektrokemijski pogledi i ideje o polarnosti pripisani molekulama (atomima) jednostavnih tijela utemeljeni na tako jasnim činjenicama da ih se može smatrati objektima bezuvjetne vjere; ako ih treba smatrati hipotezama, onda jesu li te hipoteze prikladne za činjenice "... Moramo priznati, nastavlja on, da je situacija drugačija. U anorganskoj kemiji vodimo se izomorfizmom, a teorija utemeljena na činjenicama, koje se, kao što je dobro poznato, malo slažu s elektrokemijskim teorijama. U organskoj kemiji, teorija supstitucije igra istu ulogu... i možda će budućnost pokazati da su oba gledišta bliskije povezana jedno s drugim , da slijede iz istih uzroka i mogu se generalizirati jedno te isto ime. U međuvremenu, na temelju pretvorbe U. kiseline u klorooctenu kiselinu i aldehida u kloraldehid (kloral) i iz činjenice da se u tim slučajevima sav vodik može zamijeniti jednakim volumenom klora bez promjene osnovne kemijske prirode tvari, možemo zaključiti da u organskoj kemiji postoje tipovi koji se očuvaju čak i kada umjesto vodika uvedemo jednake količine klora, broma i joda. A to znači da je teorija supstitucije utemeljena na činjenicama, i štoviše, najbriljantnija je u organskoj kemiji." Citirajući ovaj izvadak u svom godišnjem izvješću Švedske akademije ("Jahresbericht etc.", sv. 19, 1840., str. 370). ovo zapažanje on svrstava među faits les plus eclatants de la Chimie organique; ovo je osnova njegove teorije supstitucije. što će, po njegovom mišljenju, srušiti elektrokemijske teorije ... ali u međuvremenu se ispostavlja da je potrebno samo malo drugačije napisati njegovu formulu da bi se dobio spoj oksalne kiseline. s odgovarajućim kloridom, C2Cl6 + C2O4H2, koji ostaje spojen s oksalnom kiselinom u kiselini i solima. Radimo dakle o nekoj vrsti spoja, za koju su poznati mnogi primjeri; mnogi ... i jednostavni i složeni radikali imaju svojstvo da njihov dio koji sadržava kisik može ući u kombinaciju s bazama i izgubiti ih bez gubitka kontakta s dijelom koji sadržava klor. Ovo gledište nije iznio Dumas i nije bilo podvrgnuto eksperimentalnoj provjeri, ali u međuvremenu, ako je točno, tada je novo učenje, koje je, prema Dumasu, nespojivo s teorijskim idejama koje su do sada prevladavale, imalo tlo joj se izvuklo ispod nogu i mora pasti, zatim neki anorganski spojevi, slični, po njegovom mišljenju, klorooctenoj kiselini (između njih Berzelius je naveo i klorid kromove kiseline - CrO2Cl2, za koji je smatrao da je spoj perklorkroma ( do danas nepoznat) s kromnim anhidridom: 3CrO2Cl2 \u003d CrCl6 + 2CrO3), Berzelius nastavlja: "Dumasova klorooctena kiselina očito pripada ovoj klasi spojeva; u njemu se radikal ugljika spaja i s kisikom i s klorom. To dakle može biti oksalna kiselina, u kojoj je polovica kisika zamijenjena klorom, ili spoj 1 atoma (molekule) oksalne kiseline s 1 atomom (molekulom) ugljikovog seskviklorida - C2Cl6. Prva se pretpostavka ne može prihvatiti, jer dopušta mogućnost supstitucije 11/2 atoma kisika klorom (Prema Berzeliusu, oksalna kiselina je bila C2O3.). Dumas se, pak, drži treće ideje, koja je potpuno nespojiva s prethodnima dvjema, prema kojoj klor ne zamjenjuje kisik, nego elektropozitivni vodik, tvoreći ugljikovodik C4Cl6, koji ima ista svojstva složenog radikala kao i C4H6 ili acetil, i navodno je sposoban dati kiselinu s 3 atoma kisika, identičnu svojstvima s W., ali, kao što se vidi iz usporedbe (njihovih fizikalnih svojstava), potpuno je različit od njega. iste godine ( "Jahresb.", 19, 1840, 558) u vezi Gerardova članka ("Journ. f. pr. Ch.", XIV, 17): "Gerard je, kaže, izrazio novo gledište o sastavu alkohola, etera i njihovih derivati; ona je sljedeća: dobro poznati spoj kroma, kisika i klora ima formulu = CrO2Cl2, klor u njemu zamjenjuje atom kisika (Berzelius misli na 1 atom kisika kromnog anhidrida - CrO3). U. kiselina C4H6 + 3O sadrži 2 atoma (molekule) oksalne kiseline, od kojih je u jednom sav kisik zamijenjen vodikom \u003d C2O3 + C2H6. I takva igra formula ispunila je 37 stranica. Ali već sljedeće godine, Dumas, dalje razvijajući ideju tipova, istaknuo je da, govoreći o identičnosti svojstava U. i trikloroctene kiseline, misli na identičnost njihovih kemijskih svojstava, jasno izraženih, na primjer, u analogiji njihovog raspada pod utjecajem lužina: C2H3O2K + KOH \u003d CH4 + K2CO8 i S2Cl3O2K + KOH \u003d CHCl3 + K2CO8, budući da su CH4 i CHCl3 predstavnici istog mehaničkog tipa. S druge strane, Liebig i Graham javno su govorili o velikoj jednostavnosti postignutoj na temelju teorije supstitucije, kada su razmatrani klorni derivati običnog etera i esteri mravlje i U. kiseline koje su dobili Malagutti i Berzelius, dajući na pritisak novih činjenica, u 5. čit. njegovog "Lehrbuch der Chemie" (Predgovor označen studenim 1842.), zaboravljajući svoju oštru recenziju Gerarda, našao je mogućim napisati sljedeće: "Ako se prisjetimo transformacije (u tekstu razgradnje) octene kiseline pod utjecajem klora u klorooksalnu kiselinu (Chloroxalic acid - Chloroxalsaure - Berzelius naziva trikloroctena kiselina ("Lehrbuch", 5. izd., str. 629), onda je moguće i drugo gledište o sastavu octene kiseline (octenu kiselinu Berzelius naziva Acetylsaure), naime, to može biti kombinirana oksalna kiselina, u kojoj je odgovarajuća skupina (Paarling) C2H6, kao što je odgovarajuća skupina u klorooksalnoj kiselini C2Cl6, i tada bi se djelovanje klora na octenu kiselinu sastojalo samo u pretvaranju C2H6 u C2Cl6. . ., međutim, korisno je obratiti pozornost na mogućnost toga".
Stoga je Berzelius morao priznati mogućnost zamjene vodika klorom bez promjene kemijske funkcije izvornog tijela u kojem se supstitucija odvija. Ne zadržavajući se na primjeni njegovih pogleda na druge spojeve, okrećem se radovima Kolbea, koji je pronašao niz činjenica za octenu kiselinu, a zatim i za druge ograničavajuće monobazične kiseline, koje su bile u skladu s Berzeliusovim (Gerardovim) stajalištima. . Polazna točka za Kolbeov rad bilo je proučavanje kristalne tvari, sastava CCl4SO2, koju su ranije dobili Berzelius i Marse djelovanjem aqua regia na CS2, a formirao Kolbe djelovanjem vlažnog klora na CS2. Brojne Kolbeove transformacije (vidi Kolbe, "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph.", 54, 1845, 145).) pokazalo je da je ovo tijelo, u modernim terminima, triklorometilsulfonski anhidrid klora. kiseline, CCl4SO2 = CCl3.SO2Cl (Kolbe ga je nazvao Schwefligsaures Kohlensuperchlorid), sposoban dati soli odgovarajuće kiseline - CCl3.SO2 (OH) pod utjecajem lužina [prema Kolbeu HO + C2Cl3S2O5 - Chlorkohlenunterschwefelsaure] (Atomske težine: H =2, Cl=71 , C \u003d 12 i O \u003d 16; i prema tome, pri modernim atomskim težinama, to je C4Cl6S2O6H2.), koji pod utjecajem cinka prvi zamjenjuje jedan atom Cl vodikom, tvoreći kiselinu CHCl2.SO2 (OH) [prema Kolbeu - wasserhaltige Chlorformylunterschwefelsaure (Berzelius (" Jahresb. "25, 1846, 91) napominje da je ispravno smatrati ga kombinacijom ditionske kiseline S2O5 s kloroformilom, zašto on naziva CCl3SO2 (OH) Kohlensuperchlorur (C2Cl6) - Dithionsaure (S2O5). Hidratiziranu vodu, kao i obično, Berzelius ne uzima u obzir.), i jedemo i drugi, tvoreći kiselinu CH2Cl.SO2 (OH) [prema Kolbeu - Chlorelaylunterschwefelsaure], i, konačno, tijekom redukcije sa strujom ili kalijevim amalgamom (reakciju je malo prije upotrijebio Melsance za redukciju trikloroctene kiseline u octenu kiselina.) zamjenjuje vodikom i sva tri atoma Cl, stvarajući metilsulfonsku kiselinu. CH3.SO2(OH) [prema Kolbeu - Methylunterschwefelsaure]. Analogija ovih spojeva s klorooctenim kiselinama bila je nehotice upečatljiva; dapače s ondašnjim formulama dobivena su dva paralelna niza, kako se vidi iz slijedeće tablice: S2O5 H2O + C2H6.C2O3 To nije promaklo Kolbeu, koji primjećuje (I. str. 181.): »sdruženim sumpornim kiselinama. gore opisano i izravno u klorougljičnoj sumpornoj kiselini (iznad - H2O + C2Cl6. S2O5) nadovezuje se na klorooksalnu kiselinu, također poznatu kao kloroctena kiselina. Tekući klorougljik - SCl (Sl = 71, S = 12; sada pišemo C2Cl4 - ovo je kloroetilen.), Kao što je poznato, pretvara se u svjetlost pod utjecajem klora - heksakloroetana (prema nomenklaturi tog vremena - Kohlensuperchlorurur), i možemo očekivati da ako je istodobno podvrgnut djelovanju vode, tada će, poput bizmut-klorida, klor-antimona itd., u trenutku stvaranja, zamijeniti klor s kisikom. Iskustvo je potvrdilo pretpostavku. "Pod djelovanjem svjetlosti i klora na C2Cl4, koji je bio pod vodom, Kolbe je uz heksakloroetan primio trikloroctenu kiselinu i izrazio transformaciju na sljedeći način: (Budući da se C2Cl4 može dobiti iz CCl4 propuštanjem kroz grijana) cijev, a CCl4 nastaje djelovanjem, zagrijavanjem, Cl2 na CS2, tada je Kolbeova reakcija bila prva sinteza octene kiseline iz elemenata.) „Da li pritom nastaje slobodna oksalna kiselina, teško je odlučiti, budući da ga klor odmah oksidira u octenu kiselinu na svjetlu "... Berzeliusov pogled na klorooctenu kiselinu "iznenađujuće (auf eine tiberraschende Weise) je potvrđen postojanjem i paralelizmom svojstava spojenih sumpornih kiselina, i, čini se da me (kaže Kolbe I. str. 186), nadilazi polje hipoteza i dobiva visok stupanj vjerojatnosti. Jer ako klorooctena kiselina (Chlorkohlenoxalsaure, kako Kolbe sada naziva klorooctenu kiselinu.) ima sastav, nalik kompoziciji klorokarbonska kiselina, onda također moramo uzeti u obzir octenu kiselinu, koja je odgovorna za metil sumpornu kiselinu, kao kombiniranu kiselinu i smatrati je metil oksalnom kiselinom: C2H6.C2O3 (Ovo je gledište koje je ranije izrazio Gerard). Nije nevjerojatno da ćemo u budućnosti biti prisiljeni uzeti za kombinirane kiseline značajan broj onih organskih kiselina u kojima trenutno, zbog ograničenosti naših informacija, prihvaćamo hipotetske radikale ... "" Što se tiče fenomena supstitucije u tim kombiniranim kiselinama, onda oni dobivaju jednostavno objašnjenje u činjenici da različiti, vjerojatno izomorfni spojevi mogu zamijeniti jedni druge u ulozi kombiniranih skupina (als Paarlinge, l. p. p. 187), bez značajnije promjene kiselinskih svojstava kiseline. tijelo u kombinaciji s njima!" Daljnja eksperimentalna potvrda Ovo gledište nalazimo u članku Franklanda i Kolbea: "Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen "Nitrile" bekannten Verbindungen" ("Ann. Chem. . n. Pharm.", 65, 1848, 288) Na temelju ideje da su sve kiseline niza (CH2)2nO4 građene poput metiloksalne kiseline (Sada pišemo CnH2nO2 i zovemo metiloksalnu kiselinu - octena.), primjećuju sljedeće općenito: "ako formula H2O + H2.C2O3 predstavlja pravi izraz racionalnog sastava mravlje kiseline, odnosno ako se smatra oksalnom kiselinom u kombinaciji s jednim ekvivalentom vodika (Izraz nije točan; umjesto H. Frankland i Kolbe koriste prekriženo slovo, što je ekvivalentno 2 N.), zatim transformaciju s visoka temperatura amonijev format u vodenu cijanovodičnu kiselinu, jer je poznato i po Dobereineru našao, da se amonijev oksalat zagrijavanjem razlaže u vodu i cijan. Kombiniran u mravlju kiselinu, vodik sudjeluje u reakciji samo tako što, spojen s cijanom, tvori cijanovodičnu kiselinu: obrnuto obrazovanje mravlja kiselina iz cijanovodične kiseline pod utjecajem lužina nije ništa drugo nego ponavljanje dobro poznate transformacije cijanida otopljenog u vodi u oksalnu kiselinu i amonijak, s jedinom razlikom; da se u trenutku stvaranja oksalna kiselina spaja s vodikom cijanovodične kiseline.»Činjenica da benzen cijanid (C6H5CN), na primjer, prema Fehlingu, nema kisela svojstva i ne tvori prusko modrilo može, prema Kolbeu. i Frankland, usporediti s nesposobnošću etil klorida za reakciju s AgNO3, a Kolbe i Frankland dokazuju njihovu ispravnost sintezom nitrilnom metodom (Nitrile su dobili destilacijom sumpornih kiselina s KCN (po Dumas i Malagutti metodi s Leblanc) : R "SO3 (OH) + KCN \u003d R. CN + KHSO4) octena, propionska (prema tadašnjem, meta-aceton,) i kapronska kiselina. Zatim, sljedeće godine, Kolbe je podvrgao alkalnim solima jednobazičnih zasićenih kiselina na elektrolizu i, u skladu sa svojom shemom, promatrao istovremeno, tijekom elektrolize octene kiseline, stvaranje etana, ugljične kiseline i vodika: H2O+C2H6.C2O3=H2+, au elektrolizi valerijanske kiseline - oktana. , ugljična kiselina i vodik: H2O+C8H18.C2O3=H2+. Međutim, nemoguće je ne primijetiti da je Kolbe očekivao da će iz octene kiseline dobiti metil (CH3) "u kombinaciji s vodikom, tj. močvarnim plinom, a iz valerijanske kiseline butil C4H9, također u kombinaciji s vodikom, tj. C4H10 (on C4H9 naziva valil) , ali u tom očekivanju treba vidjeti ustupak formulama Gerarda, koji je već dobio značajna građanska prava, koji je napustio svoj prijašnji pogled na octenu kiselinu i smatrao je ne za C4H8O4, koju formulu, sudeći po krioskopskim podacima, zapravo posjeduje , već za C2H4O2, kako piše u svim modernim udžbenicima kemije.
Kolbeovim radovima struktura octene kiseline, a ujedno i svih drugih organskih kiselina, konačno je razjašnjena, a uloga kasnijih kemičara svedena je samo na podjelu - zbog teorijskih razmatranja i autoriteta Gerarda, Kolbeove formule na pola te njihovom prevođenju na jezik strukturnih pogleda, zbog čega se formula C2H6.C2O4H2 pretvorila u CH3.CO(OH).
2. svojstva octene kiseline
karboksilne kiseline- organski spojevi koji sadrže jednu ili više karboksilnih skupina -COOH povezanih s radikalom ugljikovodika.
Svojstva kiselina karboksilne kiseline su posljedica pomaka elektronske gustoće prema karbonilnom kisiku i rezultirajuće dodatne (u usporedbi s alkoholima) polarizacije O–H veze.
U vodenoj otopini karboksilne kiseline disociraju na ione:
Povećanjem molekulske mase smanjuje se topljivost kiselina u vodi.
Prema broju karboksilnih skupina kiseline se dijele na jednobazične (monokarboksilne) i višebazične (dikarboksilne, trikarboksilne itd.).
Prema prirodi ugljikovodičnog radikala razlikuju se zasićene, nezasićene i aromatske kiseline.
Sustavni nazivi kiselina dani su imenom odgovarajućeg ugljikovodika uz dodatak sufiksa -ovaja i riječi kiselina. Često se koriste i trivijalni nazivi.
Neke zasićene jednobazične kiseline
| Formula | Ime |
|
| sustavan | trivijalno |
|
| HCOOH | metan | mravlja |
| etan | octena | |
| propan | propionski | |
| butan | uljasti | |
| pentan | odoljen | |
| heksan | kapron | |
| pentadekanski | palmitinska | |
| heptadekanski | stearinska | |
Karboksilne kiseline su vrlo reaktivne. Reagiraju s različitim tvarima i tvore niz spojeva među kojima su od velike važnosti funkcionalne izvedenice, tj. spojevi koji nastaju reakcijama na karboksilnoj skupini.
2.1 Stvaranje soli
a) u interakciji s metalima:
2RCOOH + Mg® (RCOO) 2 Mg + H 2
b) u reakcijama s metalnim hidroksidima:
2RCOOH + NaOH ® RCOONa + H 2 O
Umjesto karboksilnih kiselina češće se koriste njihovi kiseli halogenidi:
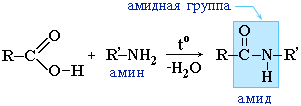 |
Amidi također nastaju interakcijom karboksilnih kiselina (njihovih halogenida ili anhidrida) s organskim derivatima amonijaka (amini):
Amidi imaju važnu ulogu u prirodi. Molekule prirodnih peptida i proteina građene su od a-aminokiselina uz sudjelovanje amidnih skupina – peptidne veze.
Octena (etanska kiselina).
Formula: CH3 - COOH; bistra bezbojna tekućina s oštrim mirisom; ispod tališta (t.t. 16,6 stupnjeva C) masa nalik ledu (stoga se koncentrirana octena kiselina naziva i ledena octena kiselina). Topljiv u vodi, etanolu.
Tablica 1. Fizikalna svojstva octene kiseline
| Ime | Formula | tvrijenje | Riješenje- | Ka |
||||
| kiseline | njezina sol |
|||||||
| octena | etan | acetat | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
Sintetička octena kiselina prehrambene kvalitete je bezbojna, bistra, zapaljiva tekućina s jakim mirisom octa. Sintetička prehrambena octena kiselina proizvodi se iz metanola i ugljičnog monoksida na rodijevom katalizatoru. Sintetička prehrambena octena kiselina koristi se u kemijskoj, farmaceutskoj i lakoj industriji, kao i u Industrija hrane kao konzervans. Formula CH3COOH.
Sintetička prehrambena octena kiselina dostupna je koncentrirana (99,7%) i u obliku vodene otopine (80%).
Prema fizičkim i kemijskim pokazateljima, sintetička prehrambena octena kiselina mora biti u skladu sa sljedećim standardima:
Tablica 2. Glavni tehnički zahtjevi
| Naziv indikatora | |
| 1. Izgled | Bezbojna, prozirna tekućina bez mehaničkih nečistoća |
| 2. Topivost u vodi | Kompletno, jasno rješenje |
| 3. Maseni udio octene kiseline,%, ne manje od | 99,5 |
| 4. Maseni udio acetaldehida,%, ne više | 0,004 |
| 5. Maseni udio mravlje kiseline,%, ne više | 0,05 |
| 6. Maseni udio sulfata (SO 4),%, ne više | 0,0003 |
| 7. Maseni udio klorida (Cl),%, ne više | 0,0004 |
| 8. Maseni udio teških metala istaloženih sumporovodikom (Pb),%, ne više | 0,0004 |
| 9. Maseni udio željeza (Fe),%, ne više | 0,0004 |
| 10. Maseni udio nehlapljivog ostatka,%, ne više | 0,004 |
| 11. Postojanost boje otopine kalijevog permanganata, min, ne manje | 60 |
| 12. Maseni udio tvari oksidiranih kalijevim dikromatom, cm 3 otopina natrijeva tiosulfata, koncentracija c (Na 2 SO 3 * 5H 2 O) \u003d 0,1 mol / dm 3 (0,1 H), ne više | 5,0 |
Sintetička prehrambena octena kiselina je zapaljiva tekućina, prema stupnju utjecaja na tijelo pripada tvarima 3. razreda opasnosti. Pri radu s octenom kiselinom koristite pojedinačna sredstva zaštita (filtarske plinske maske). Prva pomoć kod opeklina - obilno ispiranje vodom.
Sintetička prehrambena octena kiselina ulijeva se u čiste željezničke cisterne, kamione cisterne sa unutarnja površina od nehrđajućeg čelika, u inox posude, kontejnere i bačve zapremnine do 275 dm3, te u staklene boce i polietilenske bačve zapremnine do 50 dm3. Polimerni spremnik prikladan je za zaljev i skladištenje octene kiseline unutar jednog mjeseca. Sintetička prehrambena octena kiselina pohranjuje se u hermetički zatvorenim spremnicima od nehrđajućeg čelika. Kontejneri, spremnici, bačve, boce i polietilenske tikvice skladište se u skladištima ili pod nadstrešnicom. Nije dopušteno zajedničko skladištenje s jakim oksidansima (dušična kiselina, sumporna kiselina, kalijev permanganat itd.).
Transportira se u željezničkim cisternama od nehrđajućeg čelika marke 12X18H10T ili 10X17H13M2T, s gornjim pražnjenjem.
3. Dobivanje octene kiseline
Octena kiselina je najvažniji kemijski proizvod koji se široko koristi u industriji za proizvodnju estera, monomera (vinil acetat), u prehrambenoj industriji itd. Njegova svjetska proizvodnja doseže 5 milijuna tona godišnje. Donedavno se proizvodnja octene kiseline temeljila na petrokemijskim sirovinama. U Walkerovom procesu, etilen ulazi blagi uvjeti oksidiraju s atmosferskim kisikom u acetaldehid u prisutnosti katalitičkog sustava PdCl2 i CuCl2. Nadalje, acetaldehid se oksidira u octenu kiselinu:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
Prema drugoj metodi, octena kiselina se dobiva oksidacijom n-butana na temperaturi od 200 C i tlaku od 50 atm u prisutnosti kobaltnog katalizatora.
Graciozni Walkerov proces, jedan od simbola razvoja petrokemije, postupno se zamjenjuje novim metodama koje se temelje na korištenju ugljenih sirovina. Razvijene su metode za proizvodnju octene kiseline iz metanola:
CH3OH + COCH3COOH
Ova reakcija, koja je od velike industrijske važnosti, izvrstan je primjer uspjeha homogene katalize. Budući da se obje komponente reakcije - CH3OH i CO - mogu dobiti iz ugljena, proces karbonilacije trebao bi postati ekonomičniji kako cijene nafte rastu. Postoje dva industrijska procesa za karbonilaciju metanola. Starija metoda koju je razvio BASF koristila je kobaltni katalizator, uvjeti reakcije bili su teški: temperatura 250°C i tlak 500-700 atm. Drugi proces kojim je ovladao Monsanto koristio je rodij katalizator, reakcija je provedena na višoj temperaturi niske temperature(150-200 C) i tlak (1-40 atm). Zanimljiva je povijest otkrića ovog procesa. Znanstvenici tvrtke istraživali su hidroformilaciju pomoću rodij fosfin katalizatora. Tehnički direktor petrokemijskog odjela predložio je korištenje istog katalizatora za karbonilaciju metanola. Rezultati pokusa bili su negativni, a to je zbog teškoće u stvaranju veze metal-ugljik. Međutim, prisjećajući se predavanja konzultanta tvrtke o lakom oksidativnom dodavanju metil jodida metalnim kompleksima, istraživači su odlučili dodati jodni promotor u reakcijsku smjesu i dobili briljantan rezultat, u koji se isprva nije vjerovalo. Do sličnog su otkrića došli i znanstvenici konkurentske tvrtke Union Carbide, koji su kasnili samo nekoliko mjeseci. Tim za razvoj tehnologije karbonilacije metanola nakon samo 5 mjeseci intenzivnog rada kreirao je Monsantov industrijski proces uz pomoć kojeg je 1970. godine dobiveno 150 tisuća tona octene kiseline. Taj je proces postao preteča područja znanosti koje je nazvano C1-kemija.
Mehanizam karbonilacije opsežno je istražen. Metil jodid, potreban za reakciju, dobiva se jednadžbom
CH3OH + HI CH3I + H2O
Katalitički ciklus može se predstaviti na sljedeći način:
Metil jodid se oksidativno dodaje kvadratno-planarnom kompleksu - (I) da nastane šest-koordinacijski kompleks II, zatim, kao rezultat uvođenja CO preko metil-rodijeve veze, nastaje acetilrodijev kompleks (III). Reduktivnom eliminacijom jodida octene kiseline regenerira se katalizator, a hidrolizom jodida nastaje octena kiselina.
Industrijska sinteza octene kiseline:
a) katalitička oksidacija butana
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
b) zagrijavanje smjese ugljikovog monoksida (II) i metanola na katalizatoru pod tlakom
CH3OH + COCH3COOH
Proizvodnja octene kiseline vrenjem (octenokiselo vrenje).
Sirovine: tekućine koje sadrže etanol (vino, fermentirani sokovi), kisik.
Pomoćne tvari: enzimi bakterija octene kiseline.
Kemijska reakcija: Etanol se biokatalitički oksidira u octenu kiselinu.
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
Glavni proizvod: octena kiselina.
4. Primjena octene kiseline
Octena kiselina se koristi za dobivanje ljekovitih i aromatičnih tvari, kao otapalo (na primjer, u proizvodnji celuloznog acetata), u obliku stolnog octa u proizvodnji začina, marinada i konzervirane hrane.
Vodena otopina octene kiseline koristi se kao aroma i konzervans (začin jelima, kiseljenje gljiva, povrće).
Sastav octa uključuje kiseline kao što su jabučna, mliječna, askorbinska, octena.
Jabučni ocat (4% octene kiseline)
Jabučni ocat sadrži 20 esencijalnih minerali i elementi u tragovima, kao i octena, propionska, mliječna i limunska kiselina, niz enzima i aminokiselina, vrijedna dijetalna vlakna, kao što je potaša, pektin. Jabučni ocat ima široku primjenu u kuhanju i konzerviranju. Odlično ide uz sve vrste salata, kako od svježeg povrća, tako i od mesa i ribe. Može se koristiti za mariniranje mesa, krastavaca, kupusa, kapara, portulaka i tartufa. Međutim, na Zapadu je jabučni ocat najpoznatiji po svom ljekovita svojstva. Koristi se za visoke krvni tlak, migrene, astma, glavobolje, alkoholizam, vrtoglavica, artritis, bolesti bubrega, visoka temperatura, opekline, dekubitusi itd.
Zdravi ljudi preporuča se svaki dan konzumirati zdrav i osvježavajući napitak: žlicu meda razmutiti u čaši vode i dodati 1 žlicu jabučnog octa. Ako želite smršaviti, preporučamo da svaki put kada jedete popijete čašu nezaslađene vode s dvije žlice jabučnog octa.
Ocat se široko koristi u kućnom konzerviranju za pripremu marinada različite jačine. NA narodna medicina ocat se koristi kao nespecifični antipiretik (trljanjem kože otopinom vode i octa u omjeru 3:1), kao i protiv glavobolje pomoću losiona. Uobičajeno je koristiti ocat za ubode insekata kroz obloge.
Poznata je primjena alkoholnog octa u kozmetologiji. Naime, dati mekoću i sjaj kosi nakon trajne i trajnog bojanja. Za to se preporuča isprati kosu toplom vodom uz dodatak alkoholnog octa (3-4 žlice octa na 1 litru vode).
Ocat od grožđa (4% octene kiseline)
Ocat od grožđa naširoko koriste vodeći kuhari ne samo u Sloveniji, već iu cijelom svijetu. U Sloveniji se tradicionalno koristi u pripremi raznih povrtnih i sezonskih salata (2-3 žlice u zdjelu za salatu). daje jedinstven i profinjen okus jelu. Ocat od grožđa dobro ide i uz razne riblje salate i jela od plodova mora. Kod pripreme ćevapa od raznih vrsta mesa, a posebno od svinjetine, lozovača je jednostavno nezamjenjiva.
Za proizvodnju se koristi i octena kiselina lijekovi.
Aspirin tablete (ES) sadrže aktivni sastojak acetilsalicilnu kiselinu, koja je ester octene kiseline salicilna kiselina.
Acetilsalicilna kiselina proizveden zagrijavanjem salicilne kiseline s bezvodnom octenom kiselinom u prisutnosti male količine sumporne kiseline (kao katalizatora).
Kada se zagrijava s natrijevim hidroksidom (NaOH) u vodenoj otopini, acetilsalicilna kiselina hidrolizira u natrijev salicilat i natrijev acetat. Kada se medij zakiseli, salicilna kiselina se taloži i može se identificirati po talištu (156-160°C). Druga metoda za prepoznavanje salicilne kiseline nastale tijekom hidrolize je bojanje njezine otopine u tamnoljubičastu boju kada se doda željezov klorid (FeCl3). Octena kiselina prisutna u filtratu pretvara se zagrijavanjem s etanolom i sumpornom kiselinom u etoksietanol, koji se lako prepoznaje po karakterističnom mirisu. Osim toga, acetilsalicilna kiselina se može identificirati različitim kromatografskim metodama.
Acetilsalicilna kiselina kristalizira stvarajući bezbojne monoklinske poliedre ili iglice blago kiselkastog okusa. Stabilni su na suhom zraku, ali postupno hidroliziraju u salicilnu kiselinu i octenu kiselinu u vlažnom okruženju (Leeson i Mattocks, 1958; Stempel, 1961). Čista tvar je bijeli kristalni prah, gotovo bez mirisa. Miris octene kiseline ukazuje na to da je tvar počela hidrolizirati. Acetilsalicilna kiselina se podvrgava esterifikaciji pod djelovanjem alkalnih hidroksida, alkalnih bikarbonata, a također i u kipućoj vodi.
Acetilsalicilna kiselina ima protuupalno, antipiretičko i analgetsko djelovanje, a široko se koristi kod vrućice, glavobolje, neuralgije i dr. te kao antireumatik.
Octena kiselina se također koristi u kemijskoj industriji (proizvodnja celuloznog acetata, iz kojeg se dobivaju acetatna vlakna, organsko staklo, film; za sintezu boja, lijekova i estera), u proizvodnji negorivih filmova, parfemskih proizvoda, otapala, u sintezi boja, ljekovite tvari kao što je aspirin. Soli octene kiseline koriste se za suzbijanje biljnih štetnika.
Zaključak
U ovom radu razmotrena su pitanja otkrića octene kiseline, njezina glavna svojstva, proizvodnja i primjena.
Dakle, octena kiselina (CH3COOH), bezbojna zapaljiva tekućina oštrog mirisa, vrlo je topljiva u vodi. Ima karakterističan kiselkasti okus, provodi struju. Primjena octene kiseline u industriji je vrlo velika.
Na octena kiselina proizvedena u Rusiji na razini je najboljih svjetskih standarda, vrlo je tražena na svjetskom tržištu i izvozi se u mnoge zemlje svijeta.
Proizvodnja octene kiseline ima niz svojih specifičnih zahtjeva, stoga su potrebni stručnjaci s velikim iskustvom ne samo u području industrijske automatizacije i upravljanja procesima, već i s jasnim razumijevanjem posebnih zahtjeva ove industrije.
Popis korištene literature
1. Artemenko, Aleksandar Ivanovič. Referentni vodič za kemiju / A.I. Artemenko, I.V. Tikunova, V.A. Slikano. - 2. izdanje, revidirano. i dodatni - M.: Viša škola, 2002. - 367 str.
2. Ahmetov, Nail Sibgatovič. Opća i anorganska kemija: udžbenik za studente. kemijsko-tehnološki specijalista. sveučilišta / Akhmetov N.S. - 4. izdanje / Rev. - M .: Viša škola, 2002.-743 str.
3. Berezin, Boris Dmitrijevič. Kolegij moderne organske kemije: Proc. dodatak za studente. sveučilišta, obrazovanje na kemijsko-tehnološkim poseban / Berezin B.D., Berezin D.B.-M.: Viša škola, 2001.-768 str.
4. I. G. Bolesov, G. S. Zaitseva. Karboksilne kiseline i njihovi derivati (sinteza, reaktivnost, primjena u organskoj sintezi). Metodički materijali u općem tečaju organske kemije. Broj 5. Moskva 1997
5. Sommer K. Akumulator znanja iz kemije. Po. s njemačkim, 2. izd. – M.: Mir, 1985. – 294 str.
6. Karahanov E.A. Sintezni plin kao alternativa nafti. I. Fischer-Tropsch proces i okso-sinteza // Soros Educational Journal. 1997. br. 3. S. 69-74.
Više iz kemije:
- Ispitivanje: Kemijske metode ekstrakcije sume vode i dušika
- Sažetak: Destilacijski uređaj kontinuiranog rada za odvajanje 4,1 t/h binarne smjese aceton - etanol
Kolegijski projekt na OHT
"Industrijska metoda za proizvodnju octene kiseline"
Uvod
Octena (etanska) kiselina je organska tvar s molekulskom formulom CH 3COOH (skraćeno AcOH). To je limitirajuća slaba jednobazna kiselina. Soli octene kiseline i njezini esteri nazivaju se acetati .
Ocat (otopina octene kiseline) poznata je od davnina kao produkt vrenja. U antici (oko 3. st. pr. Kr.) ocat se koristio za proizvodnju olovnog bijelog. Trenutno, octena kiselina ima tri glavne namjene: prvo, kao otapalo za neke organske sinteze, drugo, kao slabo kiseli reagens (za gašenje nastalih glavnih proizvoda, itd.), i, konačno, treće, za proizvodnju važnih derivata kao što su kiselinski klorid ili anhidrid octene kiseline , kao i ona amid I tako dalje. Acil klorid i anhidrid octene kiseline važna su sredstva za aciliranje koja se često koriste u organskoj sintezi.
Otopine octene kiseline koje se koriste u prehrambenoj industriji (kao iu kuhanju i soljenju u kućanstvu) imaju imena ocat (3-15%) i octena esencija (70-80%). Apsolutna octena kiselina (ca. 99,8%) naziva se led , jer kada se zamrzne, stvara masu nalik ledu.
Obujam proizvodnje octene kiseline je oko 5 milijuna tona godišnje, od čega se oko 50% proizvodi Kolbeovom metodom (vidi dolje).
. Fizikalno-kemijska svojstva
Na n.o. octena kiselina je bezbojna tekućina izrazito oštrog mirisa. Donja tablica sažima glavne fizičke konstante octene kiseline.
M r , g/molp, g/cm 3Ttopiti., oko STkip., oko SKrit. točka Rez., J/mol*KDN oko , kJ/molrKan60.051.049216.75118.1321.6 oko C 5.79 MPa 123.4-4874.761.372
Octena kiselina je ambijentalna u pogledu otapala, jer ima u svom sastavu polarnu grupu (-COOH) i nepolarnu (-CH 3). Stoga je savršeno topljiv u vodi iu nekim organskim otapalima. Također tvori dvostruke i trostruke azeotrope tipa "octena kiselina-voda-organsko otapalo".
Octena kiselina je slaba organska kiselina. Može reagirati s aktivnim metalima uz oslobađanje vodika:
Prelaze u kiselinske derivate pod djelovanjem odgovarajućih reagensa (važne reakcije u organskoj sintezi):
a) u kisele halogenide
b) u estere
c) u amide
Vratiti u etilni alkohol:
Također ulazite u reakcije supstitucije na metilnoj skupini, od kojih je najvažnija Gel-Volhard-Zelinsky reakcija, koja se koristi za dobivanje važne aminokiseline - glicina:
Štoviše, svakom sljedećom zamjenom, zbog induktivnog učinka halogena, jačina kiseline raste. Tako je, na primjer, trifluoroctena kiselina po snazi bliska mineralnim kiselinama.
. Kako doći
Najprofitabilniji i očiti kemijska metodadobivanje octene kiseline je oksidacija odgovarajućeg aldehida ( acetaldehid ili etanal ), koji se pak dobiva na jedan od dva načina: hidratacijom acetilen u prisutnosti živinih (II) soli (Chugajevljeva reakcija), ili oksidacijom (dehidrogenacijom) etil alkohol preko vrućeg bakra:
Sam acetaldehid lako oksidira atmosferskim kisikom i polako prelazi u octenu kiselinu.
Prva metoda dobivanja etanola Chugaevljevom reakcijom nije isplativa iz mnogo razloga, uključujući rad s eksplozivnim acetilenom, kontaminaciju proizvoda otrovnim živinim solima, velike količine reaktora i tako dalje. Najčešći je drugi način dobivanja iz etilnog alkohola (koji se proizvodi u ogromnim količinama i relativno je jeftin).
Nastali acetaldehid oksidira se kisikom u prisutnosti katalizatora - soli mangana (II). Upravo će ova metoda biti razmotrena u nastavku.
Suvremenija je metoda katalitičke karbonilacije metanola (Kolbeova metoda) prema reakciji:
Ova metoda omogućuje postizanje prinosa reda veličine 99% za metanol i 90% za CO. Sastoji se od propuštanja ugljičnog monoksida na temperaturi od 180°C i tlaku od 200-700 atm kroz mješavinu reagensa. Katalizatori su jodidi kobalta ili rodija, a rjeđe spojevi iridija. Na ovaj trenutak oko 50% sve octene kiseline proizvedene u svijetu dobiva se ovom metodom.
Postoje također biokemijske metode(tj. fermentacijom šećera), međutim, rijetko se koriste, uglavnom zbog njihove niske produktivnosti i poteškoća u odvajanju dobivene smjese proizvoda.
. Opravdanost izbora tehnološkog procesa metodom oksidacije etanola
Ova metoda ima niz pozitivnih kvaliteta, kao što su:
)Jeftini početni reagensi
)Visoke performanse
)Relativno niski troškovi energije (50-60 o IZ)
)Visoki prinosi početnih reagensa
)Visoka pretvorba i selektivnost procesa
)Relativno lako odvajanje smjese
Reakcija se provodi u koloni s mjehurićima. Povišena temperatura potrebno za sprječavanje popratne reakcije stvaranja peroksida (zbog čega može nastati eksplozivna smjesa). Gornja granica temperature određena je hlapljivošću acetaldehida. Octena kiselina nije samo proizvod reakcije, već i otapalo, što uvelike pojednostavljuje proces.
Glavni tehnološki pokazatelji procesa sažeti su u donjoj tablici:
. Tehnološka shema procesa
Dolje je pojednostavljeni dijagram toka za proizvodnju octene kiseline oksidacijom acetaldehida. Oznake dane u dijagramu sažete su u tablicama.
Početna smjesa (I) ulazi u izmjenjivač topline (1), gdje se zagrijava do reakcijske temperature (50-80 °C). Zagrijavanje se vrši grijaćom parom (IX), koja se zatim u obliku kondenzata (X) odvodi iz prstenastog prostora. Dovod aldehida proizvodi se centrifugalnim pumpama (5) i regulira ventilima.
Zagrijani aldehid ulazi u kolonu s mjehurićima (2) opremljenu spiralnim hladnjacima (reakcija je egzotermna). U kolonu se upuhuje tehnički kisik (II), počinje oksidacija aldehida.
Nastali produkti u obliku parno-tekuće smjese ispuštaju se kroz vrh kolone i ulaze u razdjelnik (4), nakon čega dio reakcijske mase ulazi u prvu destilacijsku kolonu (3), dizajniranu za uklanjanje hlapljivih nečistoća ( ispušni plinovi - VII). Nadalje, ostatak reakcijske mase (IV) ulazi u drugu kolonu, gdje se nastala octena kiselina (V) ispušta potrošaču ili u skladište. PDV ostatak (VI) koji sadrži etiliden diacetat je također uklonjen iz kolone. Nereagirani acetaldehid (VIII) vraća se u kolonu s mjehurićima, čime se smanjuje količina aldehida koja je početno potrebna da se osigura zadani učinak (povećana konverzija sirovine). .
Tablice glavnih tokova i oznaka:
Naseljski dio
. Izrada materijalne bilance
Izrada materijalne bilance jedna je od glavnih točaka u proračunu tehnoloških procesa. Njegova bit leži u zakonu održanja mase (Dolazak-Odlazak=0). Zahvaljujući formuliranju jednadžbi mat. ravnoteže, možete raditi s različitim indikatorima procesa (koncentracije, maseni tokovi itd.) kako biste optimizirali proces.
Trebali biste započeti sastavljanje bilance s pojednostavljenim dijagramom u obliku blokova. Svaki od blokova će uključivati glavnu funkciju - miješanje, oksidaciju ili distribuciju. Za ovaj proces, dijagram toka izgledat će ovako (sastav tokova naveden je u gornjoj tablici):
Dakle, može se vidjeti da je tehnološka shema podijeljena u četiri glavna bloka:
1) Jedinica za miješanje.
)Jedinica za oksidaciju (izravno sama kolona mjehurića).
)Blok za odvajanje (prva destilacijska kolona, iz koje se uklanjaju hlapljive tvari, ispušni plinovi).
)Blok odvajanja i vraćanje neizreagiranih sirovina u prvi blok.
U drugom bloku mase se preraspodjeljuju zbog kemijskih transformacija prema glavnoj reakciji:
CH 3CHO + 0,50 2 = CH 3UNSD
I za dvoje neželjene reakcije nastajanje metil acetata odnosno etiliden diacetata:
CH 3CHO + 1,50 2= CH 3OOOOOOOo 3+ CO2 + H 2O
CH 3CHO + O 2= CH 3CH(OOCH 3)2+ H 2O
Na temelju zadane produktivnosti proizvoda i selektivnosti i stupnja pretvorbe za acetaldehid, potrebna količina etanala može se izračunati pomoću osnovne jednadžbe:
gdje je N broj molova izvornog acetaldehida potreban da uđe u prvi reaktor; M je molarna masa proizvoda (octena kiselina); a i c su stehiometrijski koeficijenti reaktanta i produkta,
Stoga bi blok 1 trebao primiti 31,6265 kmol acetaldehida. Treba napomenuti da acetaldehid ulazi i u čisti (izvorni) i u reverzni (nakon četvrtog bloka) kroz recirkulaciju. Maseni protok je:
Također izračunavamo količinu nastalih nusproizvoda:
a) metil acetat:
b) etiliden diacetat:
Gdje su 0,5 i 0,33 faktori pretvorbe (uzimajući u obzir stehiometriju reakcije). Izračunajte količinu kisika potrebnu za reakciju (uzimajući u obzir njegovu pretvorbu, tj. nepotpunu pretvorbu):
Tehnički kisik sadrži malu količinu dušika (2,5%), što treba uzeti u obzir:
Nereagirani aldehid:
Količina proizvedenog ugljičnog dioksida:
Nastala je voda po reakcijama:
Treba imati na umu da sa sirovinom dolazi i voda.
Aldehid (u atmosferu):
Aldehid (u 4. bloku):
Budući da se sav aldehid koji prolazi u blok 4 zatim vraća u blok 1, sada je moguće izračunati količinu svježeg aldehida koji ulazi u 1. blok za miješanje:
Kao i količina nečistoća (octena kiselina i voda) u svježem aldehidu:
Ukupna količina vode (reakcijom i sa svježim aldehidom) je:
Octena kiselina nastaje kao rezultat reakcije i kada ulazi sa svježim aldehidom:
Dio vode se uklanja zajedno s octenom kiselinom (0,2% težine):
Bilanca vode se sastavlja na sljedeći način: nastaje reakcijom + sa svježim aldehidom - s kiselinom - u atmosferu = 0. Zatim:
Radi praktičnosti, sve izračunate vrijednosti sažete su u tablici toka i tablici materijalne bilance.
*Napomena #1: Metil acetat ima vrelište od 57°C i vrlo je hlapljiv, pa se uklanja ispušnim plinovima, tj. u trećem bloku (prva destilacijska kolona).
*Napomena #2: Također treba uzeti u obzir da postoji stalna količina octene kiseline (kao otapala) u koloni, a acetaldehid se reciklira.
Zaključak
kiselinski aldehid etanal
Zaključno, valja napomenuti da je ova metoda praktički glavna u proizvodnji octene kiseline. U posljednje vrijeme sve se više zamjenjuje Kolbeovom metodom (karboksilacija metilnog alkohola) koja daje veće prinose polaznih reagensa.
Ova metoda također ima nedostatke, kao što je, na primjer, ispuštanje neizreagiranog acetaldehida i metil acetata u atmosferu, korištenje visoki krvni tlak stvaranje nusproizvoda itd.
Ipak, oko 50% sve proizvedene octene kiseline u svijetu dobiva se na ovaj način, koristeći mangan (II) acetate kao katalizator. Općenito, ova metoda je jedna od najprikladnijih i najpovoljnijih za tehnologiju.
Octena kiselina jedna je od najpopularnijih i najkorištenijih sirovina, a također je vrlo tražena u prehrambenoj i kemijskoj industriji.
Popis korištene literature
1) „Ekološki faktor odn okoliš kao poticaj za razvoj industrijske kemije". Roger A. Sheldon
) "Organska kemija". Morrison R., Boyd R. 1974
) "Reakcijski mehanizmi u organskoj kemiji". Sykes P., 1991
) "Zbirka zadataka i smjernica za proračun materijalne bilance kemijskih i tehnoloških industrija." MITHT, 2008. (enciklopedijska natuknica).
Dodatna literatura:
5) "Opći tijek procesa i aparata kemijske tehnologije". Einstein V.G., Zakharov M.K., 1999
) "Kratki priručnik o fizikalnim i kemijskim veličinama". Ravdel A.A., 1999
) "Sheme kemijsko-tehnoloških procesa". Nosov G.A., Vyshnepolsky V.I., Lapshenkov G.I., 2011.
Duljina i udaljenost Masa Mjere za obujam rasutih proizvoda i prehrambenih proizvoda Površina Zapremina i mjerne jedinice u Recepti Temperatura Tlak, mehaničko naprezanje, Youngov modul Energija i rad Snaga Sila Vrijeme Linearna brzina Ravni kut Toplinska učinkovitost i iskoristivost goriva Brojevi Mjerne jedinice količine informacija Razmjenski tečajevi Veličine ženske odjeće i obuće Veličine muške odjeće i obuće Kutna brzina i rotacija frekvencija Ubrzanje Kutno ubrzanje Gustoća Specifični volumen Moment tromosti Moment sile Okretni moment Specifična kalorična vrijednost (po masi) Gustoća energije i specifična kalorična vrijednost goriva (po volumenu) Temperaturna razlika Koeficijent toplinskog širenja Toplinski otpor Toplinska vodljivost Specifični toplinski kapacitet Izloženost energiji, toplinska snaga zračenja Gustoća toplinskog toka Koeficijent prijenosa topline Volumenski protok Maseni protok Molarni protok Maseni protok Gustoća Molarna koncentracija Masena koncentracija u otopini Dinamička (apsolutna) viskoznost Kinematička viskoznost Površinska napetost Propusnost vodene pare propusnost, brzina prijenosa pare Razina zvuka Osjetljivost mikrofona Razina zvučnog tlaka (SPL) Svjetlina Svjetlosni intenzitet Osvjetljenje Razlučivost u računalnoj grafici Frekvencija i valna duljina optička snaga u dioptrijama i žarišnoj duljini Snaga u dioptrijama i povećanje leće (×) Električni naboj Linearna gustoća naboja Gustoća površinskog naboja Gustoća skupnog naboja Struja Linearna gustoća struje Površinska gustoća struje Jakost električnog polja Elektrostatički potencijal i napon Električni otpor Električni otpor Električna vodljivost Električna vodljivost Električni kapacitet Induktivitet Američki mjerni kabel Razine u dBm (dBm ili dBmW), dBV (dBV), vatima itd. jedinice Magnetomotorna sila Magnetsko polje jakost Magnetski tok Magnetska indukcija Brzina apsorbirane doze ionizirajućeg zračenja Radioaktivnost. Radioaktivni raspad Zračenje. Doza izloženosti zračenju. Apsorbirana doza Decimalni prefiksi Prijenos podataka Tipografija i obrada slike Jedinice volumena drveta Izračun molarne mase Periodni sustav kemijskih elemenata D. I. Mendeljejeva
Kemijska formula
Molarna masa CH 3 COOH, octene kiseline 60.05196 g/mol
12.0107+1.00794 3+12.0107+15.9994+15.9994+1.00794
Maseni udjeli elemenata u spoju
Korištenje kalkulatora molarne mase
- Kemijske formule moraju biti unesene s razlikovanjem velikih i malih slova
- Indeksi se unose kao uobičajeni brojevi
- Točka na srednjoj crti (znak množenja), koja se koristi, na primjer, u formulama kristalnih hidrata, zamijenjena je pravilnom točkom.
- Primjer: umjesto CuSO₄ 5H₂O, pretvarač koristi pisanje CuSO4.5H2O radi lakšeg unosa.
Kalkulator molarne mase
madež
Sve tvari sastoje se od atoma i molekula. U kemiji je važno točno izmjeriti masu tvari koje ulaze u reakciju i iz nje nastaju. Prema definiciji, mol je količina tvari koja sadrži onoliko strukturnih elemenata (atoma, molekula, iona, elektrona i drugih čestica ili njihovih skupina) koliko ima atoma u 12 grama izotopa ugljika s relativnom atomskom masom od 12 Taj se broj naziva konstantom ili Avogadrovim brojem jednak je 6,02214129(27)×10²³ mol⁻¹.
Avogadrov broj N A = 6,02214129(27)×10²³ mol⁻¹
Drugim riječima, mol je količina tvari jednaka masi zbroju atomskih masa atoma i molekula tvari, pomnoženih s Avogadrovim brojem. Mol je jedna od sedam osnovnih jedinica SI sustava i označava se molom. Budući da su naziv jedinice i njezin simbol isti, treba napomenuti da se simbol ne mijenja, za razliku od naziva jedinice koji se može deklinirati prema uobičajena pravila Ruski jezik. Prema definiciji, jedan mol čistog ugljika-12 iznosi točno 12 grama.
Molekulska masa
Molarna masa je fizičko svojstvo tvari, definirano kao omjer mase te tvari i količine tvari u molovima. Drugim riječima, to je masa jednog mola tvari. U SI sustavu jedinica molarne mase je kilogram/mol (kg/mol). Međutim, kemičari su navikli koristiti prikladniju jedinicu g/mol.
molarna masa = g/mol

Molarna masa elemenata i spojeva
Spojevi su tvari koje se sastoje od različitih atoma koji su međusobno kemijski vezani. Na primjer, sljedeće tvari koje se mogu naći u kuhinji svake domaćice su kemijski spojevi:
- sol (natrijev klorid) NaCl
- šećer (saharoza) C₁₂H₂₂O₁₁
- ocat (otopina octene kiseline) CH₃COOH
Molarna masa kemijskih elemenata u gramima po molu brojčano je jednaka masi atoma elementa izraženoj u jedinicama atomske mase (ili daltonima). Molarna masa spojeva jednaka je zbroju molarnih masa elemenata koji čine spoj, uzimajući u obzir broj atoma u spoju. Na primjer, molarna masa vode (H₂O) je približno 2 × 2 + 16 = 18 g/mol.
Molekulska masa

Molekulska težina (stari naziv je molekularna težina) je masa molekule, izračunata kao zbroj masa svakog atoma koji čini molekulu, pomnožen s brojem atoma u toj molekuli. Molekularna težina je bez dimenzija fizička količina, brojčano jednaka molarnoj masi. To je, molekularna masa razlikuje se od molarne mase u dimenziji. Iako je molekularna težina bezdimenzionalna veličina, ona još uvijek ima veličinu koja se naziva jedinica atomske mase (a.m.u.) ili dalton (Da), a približno jednaka masi jedan proton ili neutron. Jedinica atomske mase također je brojčano jednaka 1 g/mol.
Slični članci
-
engleski - sat, vrijeme
Svatko tko je zainteresiran za učenje engleskog morao se suočiti s čudnim oznakama str. m. i a. m , i općenito, gdje god se spominje vrijeme, iz nekog razloga koristi se samo 12-satni format. Vjerojatno za nas žive...
-
"Alkemija na papiru": recepti
Doodle Alchemy ili Alkemija na papiru za Android je zanimljiva puzzle igra s prekrasnom grafikom i efektima. Naučite kako igrati ovu nevjerojatnu igru i pronađite kombinacije elemenata za dovršetak Alkemije na papiru. Igra...
-
Igra se ruši u Batman: Arkham City?
Ako ste suočeni s činjenicom da se Batman: Arkham City usporava, ruši, Batman: Arkham City se ne pokreće, Batman: Arkham City se ne instalira, nema kontrola u Batman: Arkham Cityju, nema zvuka, pojavljuju se pogreške gore, u Batmanu:...
-
Kako odviknuti osobu od automata Kako odviknuti osobu od kockanja
Zajedno s psihoterapeutom klinike Rehab Family u Moskvi i specijalistom za liječenje ovisnosti o kockanju Romanom Gerasimovim, Rating Bookmakers je pratio put kockara u sportskom klađenju - od stvaranja ovisnosti do posjeta liječniku,...
-
Rebusi Zabavne zagonetke zagonetke zagonetke
Igra "Zagonetke Šarade Rebusi": odgovor na odjeljak "ZAGONETKE" Razina 1 i 2 ● Nije miš, nije ptica - ona se zabavlja u šumi, živi na drveću i grize orahe. ● Tri oka - tri reda, crveno - najopasnije. Razina 3 i 4 ● Dvije antene po...
-
Uvjeti primitka sredstava za otrov
KOLIKO NOVCA IDE NA KARTIČNI RAČUN SBERBANK Važni parametri platnog prometa su rokovi i tarife odobrenja sredstava. Ti kriteriji prvenstveno ovise o odabranoj metodi prevođenja. Koji su uvjeti za prijenos novca između računa
