สูตรกรดอะซิติกปราศจากน้ำ เคมี: กรดอะซิติก บทคัดย่อ
ในหัวข้อ:
« กรดน้ำส้ม»
ทำได้โดย:_____________
______________________
ตรวจสอบแล้ว:_____________
______________________
โวลโกกราด 2004
บทนำ…………………………………………………….3
1. การค้นพบกรดอะซิติก……………………..5
2. คุณสมบัติของกรดอะซิติก……………………..13
3. ได้รับกรดอะซิติก…………………… 19
4. การใช้กรดอะซิติก………………….22
สรุป……………………………………………….26
รายการวรรณกรรมที่ใช้แล้ว………………..…27
บทนำ
ACETIC ACID, CH3COOH ของเหลวไม่มีสี มีกลิ่นฉุน ละลายได้ดีในน้ำ มีรสเปรี้ยวนำไฟฟ้า
กรดอะซิติกเป็นกรดเดียวที่ชาวกรีกโบราณรู้จัก ดังนั้นชื่อของมัน: "oksos" - รสเปรี้ยวอมเปรี้ยว กรดอะซิติกเป็นกรดอินทรีย์ชนิดที่ง่ายที่สุดซึ่งเป็นส่วนประกอบสำคัญของไขมันพืชและสัตว์ มีความเข้มข้นเล็กน้อยในอาหารและเครื่องดื่มและเกี่ยวข้องกับกระบวนการเผาผลาญในระหว่างการสุกของผล กรดอะซิติกมักพบในพืช ในสารคัดหลั่งจากสัตว์ เกลือและเอสเทอร์ของกรดอะซิติกเรียกว่าอะซิเตท
กรดอะซิติกอ่อน (เพียงบางส่วนแยกตัวในสารละลายที่เป็นน้ำ) อย่างไรก็ตาม เนื่องจากสภาพแวดล้อมที่เป็นกรดยับยั้งกิจกรรมสำคัญของจุลินทรีย์ กรดอะซิติกจึงถูกใช้ในการบรรจุกระป๋อง ผลิตภัณฑ์อาหารเช่นในน้ำดอง
กรดอะซิติกได้มาจากการออกซิเดชันของอะซีตัลดีไฮด์และวิธีการอื่น ๆ กรดอะซิติกได้มาจากการหมักกรดอะซิติกของเอทานอล ใช้เพื่อให้ได้ยาและสารอะโรมาติก เป็นตัวทำละลาย (เช่น ในการผลิตเซลลูโลสอะซิเตท) ในรูปของน้ำส้มสายชูบนโต๊ะในการผลิตเครื่องปรุงรส หมัก และอาหารกระป๋อง กรดอะซิติกเกี่ยวข้องกับกระบวนการเผาผลาญหลายอย่างในสิ่งมีชีวิต เป็นกรดระเหยชนิดหนึ่งที่มีอยู่ในอาหารเกือบทุกชนิด มีรสเปรี้ยวและเป็นส่วนประกอบหลักในน้ำส้มสายชู
วัตถุประสงค์ของงานนี้ เพื่อศึกษาคุณสมบัติ การผลิต และการใช้กรดอะซิติก
งาน การศึกษานี้:
1. เล่าประวัติการค้นพบกรดอะซิติก
2. ศึกษาคุณสมบัติของกรดอะซิติก
3. อธิบายวิธีการผลิตกรดอะซิติก
4. เผยคุณสมบัติการใช้กรดอะซิติก
1. การค้นพบกรดอะซิติก
โครงสร้างของกรดอะซิติกเป็นที่สนใจของนักเคมีตั้งแต่การค้นพบกรดไตรคลอโรอะซิติกโดย Dumas เนื่องจากการค้นพบครั้งนี้ส่งผลกระทบต่อทฤษฎีเคมีไฟฟ้าของ Berzelius ที่โดดเด่นในขณะนั้น อย่างหลังซึ่งกระจายองค์ประกอบออกเป็นอิเล็กโตรโพซิทีฟและอิเล็กโตรเนกาทีฟไม่รู้จักความเป็นไปได้ของการทดแทนสารอินทรีย์โดยไม่มีการเปลี่ยนแปลงอย่างลึกซึ้ง คุณสมบัติทางเคมี , ไฮโดรเจน (องค์ประกอบอิเล็กโทรโพซิทีฟ) โดยคลอรีน (องค์ประกอบอิเล็กโทรเนกาทีฟ) แต่ในขณะเดียวกันตามข้อสังเกตของดูมัส ("Comptes rendus" ของ Paris Academy, 1839) กลับกลายเป็นว่า "การนำคลอรีนมาแทนที่ไฮโดรเจนไม่ได้ เปลี่ยนคุณสมบัติภายนอกของโมเลกุลอย่างสมบูรณ์ ... " ทำไม Dumas และถามคำถาม "เป็นมุมมองและความคิดทางไฟฟ้าเคมีเกี่ยวกับขั้วที่เกิดจากโมเลกุล (อะตอม) ของร่างกายที่เรียบง่ายตามข้อเท็จจริงที่ชัดเจนว่าพวกเขาสามารถถือเป็นวัตถุได้ ของศรัทธาที่ไม่มีเงื่อนไข ถ้าจะถือเป็นสมมติฐาน สมมุติฐานเหล่านี้เหมาะสมกับข้อเท็จจริงหรือไม่ "... เราต้องยอมรับ เขาพูดต่อ ว่าสถานการณ์แตกต่างกัน ในเคมีอนินทรีย์ เราได้รับคำแนะนำจาก isomorphism, a ทฤษฏีที่อยู่บนพื้นฐานของข้อเท็จจริงซึ่งดังที่ทราบกันดีอยู่แล้วว่ามีข้อตกลงเพียงเล็กน้อยกับทฤษฎีไฟฟ้าเคมี ในเคมีอินทรีย์ ทฤษฎีการทดแทนมีบทบาทเหมือนกัน .. และบางทีอนาคตอาจแสดงให้เห็นว่ามุมมองทั้งสองมีความเกี่ยวข้องกันมากขึ้น ที่สืบเนื่องมาจากเหตุเดียวกันและสามารถสรุปได้ทั่วไป หนึ่งและชื่อเดียวกัน ในระหว่างนี้ บนพื้นฐานของการแปลงกรดยูเป็นกรดคลอโรอะซิติกและอัลดีไฮด์เป็นคลอราลดีไฮด์ (คลอเรล) และจากข้อเท็จจริงที่ว่าในกรณีเหล่านี้ไฮโดรเจนทั้งหมดสามารถถูกแทนที่ด้วยปริมาตรที่เท่ากันของคลอรีนโดยไม่เปลี่ยนลักษณะทางเคมีพื้นฐานของ สารนี้ เราสามารถสรุปได้ว่าในเคมีอินทรีย์ มีหลายชนิดที่คงสภาพไว้แม้ว่าเราจะแนะนำคลอรีน โบรมีน และไอโอดีนในปริมาณที่เท่ากันแทนไฮโดรเจน และนี่หมายความว่าทฤษฎีการทดแทนมีพื้นฐานมาจากข้อเท็จจริงและยิ่งไปกว่านั้น เคมีอินทรีย์ที่ฉลาดที่สุด " อ้างถึงข้อความที่ตัดตอนมานี้ในรายงานประจำปีของสถาบันสวีเดน ("Jahresbericht etc.", vol. 19, 1840, p . 370) ข้อสังเกตของ Berzelius: "ดูมัสเตรียมสารประกอบที่เขาให้สูตรตรรกยะ C4Cl6O3 + H2O (ตุ้มน้ำหนักอะตอมเป็นแบบสมัยใหม่ กรดไตรคลอโรอะซิติกถือเป็นสารประกอบแอนไฮไดรด์กับน้ำ); การสังเกตนี้เขาจัดอยู่ในกลุ่ม faits les plus eclatants de la Chimie organique; นี่คือพื้นฐานของทฤษฎีการทดแทนของเขา ซึ่งในความเห็นของเขาจะล้มล้างทฤษฎีไฟฟ้าเคมี ... แต่ในขณะเดียวกันกลับกลายเป็นว่ามีเพียงการเขียนสูตรของเขาให้ต่างออกไปเล็กน้อยเพื่อให้มีสารประกอบของกรดออกซาลิก ด้วยคลอไรด์ที่สอดคล้องกัน C2Cl6 + C2O4H2 ซึ่งยังคงรวมกับกรดออกซาลิกทั้งในกรดและเกลือ ดังนั้นเราจึงจัดการกับชนิดของสารประกอบ ซึ่งมีหลายตัวอย่างที่ทราบ; จำนวนมาก ... ทั้งอนุมูลทั้งแบบธรรมดาและแบบซับซ้อนมีคุณสมบัติที่ส่วนที่ประกอบด้วยออกซิเจนของพวกมันสามารถรวมเข้ากับเบสและสูญเสียพวกมันไปโดยไม่สูญเสียการสัมผัสกับส่วนที่ประกอบด้วยคลอรีน มุมมองนี้ไม่ได้นำเสนอโดย Dumas และไม่ได้อยู่ภายใต้การตรวจสอบการทดลอง แต่ในขณะเดียวกันหากเป็นความจริง คำสอนใหม่ซึ่งตาม Dumas นั้นไม่สอดคล้องกับแนวคิดเชิงทฤษฎีที่มีชัยชนะจนถึงปัจจุบันมี ดินดึงออกมาจากใต้ฝ่าเท้าของมันและมันจะต้องตก จากนั้น สารประกอบอนินทรีย์บางอย่างในความคิดของเขาคล้ายกับกรดคลอโรอะซิติก (ระหว่างนั้น Berzelius ยังอ้างถึงโครเมียมกรดคลอไรด์ - CrO2Cl2 ซึ่งเขาถือว่าเป็นสารประกอบของโครเมียมเปอร์คลอริก ( ไม่ทราบมาจนถึงทุกวันนี้) ด้วยโครเมียมแอนไฮไดรด์: 3CrO2Cl2 \u003d CrCl6 + 2CrO3) , Berzelius พูดต่อ: "กรดคลอโรอะซิติกของ Dumas เห็นได้ชัดว่าเป็นของสารประกอบประเภทนี้ ในนั้นคาร์บอนแรดิคัลจะถูกรวมเข้ากับทั้งออกซิเจนและคลอรีน มันสามารถเป็นกรดออกซาลิกซึ่งออกซิเจนครึ่งหนึ่งถูกแทนที่ด้วยคลอรีนหรือสารประกอบของกรดออกซาลิก 1 อะตอม (โมเลกุล) กับคาร์บอนเซสควิคลอไรด์ 1 อะตอม (โมเลกุล) - C2Cl6 ไม่สามารถยอมรับสมมติฐานแรกได้ เนื่องจากยอมรับความเป็นไปได้ของการแทนที่อะตอมออกซิเจน 11/2 ด้วยคลอรีน (ตาม Berzelius กรดออกซาลิกคือ C2O3) ในทางกลับกัน Dumas ยึดติดกับแนวคิดที่สามซึ่งเข้ากันไม่ได้อย่างสมบูรณ์กับสองข้อข้างต้นตามที่คลอรีนไม่ได้แทนที่ออกซิเจน แต่ไฮโดรเจนอิเล็กโตรโพซิทีฟทำให้เกิดไฮโดรคาร์บอน C4Cl6 ซึ่งมีคุณสมบัติเหมือนกันของอนุมูลเชิงซ้อนเช่น C4H6 หรือ อะเซทิล และคาดว่าสามารถให้กรดกับออกซิเจน 3 อะตอม ซึ่งมีคุณสมบัติเหมือนกันกับ W. แต่จากการเปรียบเทียบ (จากคุณสมบัติทางกายภาพของพวกมัน) จะแตกต่างไปจากเดิมอย่างสิ้นเชิงในปีเดียวกัน ( "Jahresb.", 19, 1840, 558) เกี่ยวกับบทความของเจอราร์ด ("Journ. f. pr. Ch.", XIV, 17): "เจอร์ราร์ด เขาพูด แสดงความคิดเห็นใหม่เกี่ยวกับองค์ประกอบของแอลกอฮอล์ อีเธอร์ และของพวกมัน อนุพันธ์ เป็นดังนี้: สารประกอบที่รู้จักกันดีของโครเมียม ออกซิเจน และคลอรีนมีสูตร = CrO2Cl2 คลอรีนแทนที่อะตอมออกซิเจนในนั้น (Berzelius หมายถึง 1 อะตอมออกซิเจนของโครเมียมแอนไฮไดรด์ - CrO3) U. กรด C4H6 + 3O มี 2 อะตอม (โมเลกุล) ของกรดออกซาลิกซึ่งในออกซิเจนทั้งหมดจะถูกแทนที่ด้วยไฮโดรเจน \u003d C2O3 + C2H6 และเกมของสูตรดังกล่าวเต็มไปด้วย 37 หน้า แต่ในปีหน้า Dumas ได้พัฒนาแนวคิดของประเภทต่อไป ชี้ให้เห็นถึงอัตลักษณ์ของคุณสมบัติของ U. และกรดไตรคลอโรอะซิติก เขาหมายถึงเอกลักษณ์ของคุณสมบัติทางเคมีของพวกมัน แสดงออกอย่างชัดเจน เช่น ในการเปรียบเทียบการสลายตัวภายใต้อิทธิพลของด่าง: C2H3O2K + KOH \u003d CH4 + K2CO8 และ C2Cl3O2K + KOH \u003d CHCl3 + K2CO8 เนื่องจาก CH4 และ CHCl3 เป็นตัวแทนของประเภทกลไกเดียวกัน ในทางกลับกัน Liebig และ Graham ได้พูดต่อสาธารณชนถึงความเรียบง่ายที่ยอดเยี่ยมซึ่งทำได้โดยอาศัยทฤษฎีการทดแทน เมื่อพิจารณาอนุพันธ์ของคลอรีนของอีเทอร์ธรรมดาและเอสเทอร์ของฟอร์มิกและกรด U. ที่ได้รับจาก Malagutti และ Berzelius ให้ผล เพื่อกดดันข้อเท็จจริงใหม่ ฉบับที่ 5 ของ "Lehrbuch der Chemie" ของเขา (คำนำที่ทำเครื่องหมายพฤศจิกายน 1842) ลืมการทบทวนที่รุนแรงของเจอราร์ดพบว่าเป็นไปได้ที่จะเขียนสิ่งต่อไปนี้: "ถ้าเราจำการเปลี่ยนแปลง (ในข้อความของการสลายตัว) ของกรดอะซิติกภายใต้อิทธิพลของคลอรีน เป็นกรดคลอโรซาลิก (กรดคลอรอกซาลิก - Chloroxalsaure - Berzelius เรียกกรดไตรคลอโรอะซิติก ("Lehrbuch", 5th ed., p. 629) จากนั้นมุมมองอื่นขององค์ประกอบของกรดอะซิติกก็เป็นไปได้ (กรดอะซิติกเรียกว่า Acetylsaure โดย Berzelius) กล่าวคือ มันสามารถรวมกรดออกซาลิกซึ่งกลุ่มที่ตรงกัน (Paarling) คือ C2H6 เช่นเดียวกับกลุ่มที่ตรงกันในกรดคลอโรซาลิกคือ C2Cl6 จากนั้นการกระทำของคลอรีนต่อกรดอะซิติกจะประกอบด้วยเฉพาะในการแปลง C2H6 เป็น C2Cl6 . อย่างไรก็ตาม การใส่ใจกับความเป็นไปได้นั้นมีประโยชน์"
ดังนั้น Berzelius ต้องยอมรับความเป็นไปได้ที่จะแทนที่ไฮโดรเจนด้วยคลอรีนโดยไม่เปลี่ยนการทำงานทางเคมีของวัตถุเดิมที่มีการทดแทน ฉันหันไปหาผลงานของ Kolbe ซึ่งพบข้อเท็จจริงหลายประการเกี่ยวกับกรดอะซิติกและกรดอะซิติกที่ จำกัด อื่น ๆ ที่สอดคล้องกับมุมมองของ Berzelius (เจอราร์ด) โดยไม่ต้องคำนึงถึงการประยุกต์ใช้มุมมองของเขากับสารประกอบอื่น ๆ . จุดเริ่มต้นของงานของ Kolbe คือการศึกษาสารผลึกซึ่งเป็นองค์ประกอบ CCl4SO2 ซึ่งได้รับก่อนหน้านี้โดย Berzelius และ Marse โดยการกระทำของ aqua regia บน CS2 และเกิดขึ้นโดย Kolbe โดยการกระทำของคลอรีนเปียกใน CS2 การเปลี่ยนแปลงของ Kolbe จำนวนหนึ่ง (ดู Kolbe "Beitrage znr Kenntniss der gepaarten Verbindungen" ("Ann. Ch. u. Ph.", 54, 1845, 145)) แสดงให้เห็นว่าร่างกายนี้เป็นไตรคลอโรเมทิลซัลโฟนิกคลอรีนแอนไฮไดรด์ กรด CCl4SO2 = CCl3.SO2Cl (Kolbe เรียกมันว่า Schwefligsaures Kohlensuperchlorid) สามารถให้เกลือของกรดที่สอดคล้องกัน - CCl3.SO2 (OH) ภายใต้อิทธิพลของด่าง [ตาม Kolbe H2O + C2Cl3S2O5 - Chlorkohlenunterschwefelsaure] (ตุ้มน้ำหนักอะตอม: H =2, Cl=71 , C \u003d 12 และ O \u003d 16 ดังนั้นที่ตุ้มน้ำหนักอะตอมสมัยใหม่ มันคือ C4Cl6S2O6H2.) ซึ่งภายใต้อิทธิพลของสังกะสีจะแทนที่อะตอม Cl หนึ่งอะตอมด้วยไฮโดรเจนก่อนก่อตัวเป็นกรด CHCl2.SO2 (OH) [ตาม Kolbe - wasserhaltige Chlorformylunterschwefelsaure (Berzelius (" Jahresb. "25, 1846, 91) ตั้งข้อสังเกตว่ามันถูกต้องที่จะพิจารณาว่าเป็นการรวมกันของกรดไดไทโอนิก S2O5 กับคลอโรฟอร์มิลทำไมเขาเรียก CCl3SO2 (OH) Kohlensuperchlorur (C2Cl6) - Dithionsaure (S2O5) Berzelius ไม่ได้คำนึงถึงน้ำที่มีความชื้นตามปกติ ) และ เรากินและอื่น ๆ ก่อตัวเป็นกรด CH2Cl.SO2 (OH) [ตาม Kolbe - Chlorelaylunterschwefelsaure] และสุดท้ายในระหว่างการลดลงด้วยกระแสหรือโพแทสเซียมอะมัลกัม (ปฏิกิริยาก่อนหน้านี้ถูกใช้โดย Melsance เพื่อลดกรดไตรคลอโรอะซิติกเป็นอะซิติก กรด) แทนที่ด้วยไฮโดรเจนและอะตอม Cl ทั้งสาม เกิดเป็นกรดเมทิลซัลโฟนิก CH3.SO2(OH) [ตาม Kolbe - Methylunterschwefelsaure] ความคล้ายคลึงของสารประกอบเหล่านี้กับกรดคลอโรอะซิติกนั้นโดดเด่นโดยไม่ได้ตั้งใจ แน่นอน ด้วยสูตรนั้น ได้ชุดคู่ขนานสองชุด ดังที่เห็นได้จากตารางต่อไปนี้: S2O5 H2O + C2H6.C2O3 สิ่งนี้ไม่ได้หนีจาก Kolbe ผู้ซึ่งกล่าวไว้ (I. p. 181): "ไปยังกรดกำมะถันที่รวมกัน อธิบายไว้ข้างต้นและโดยตรงในกรดคลอโรคาร์บอนซัลเฟอร์ (เหนือ - H2O + C2Cl6 S2O5) ติดกับกรดคลอโรออกซาลิกหรือที่เรียกว่ากรดคลอโรอะซิติก คลอโรคาร์บอนเหลว - СCl (Сl=71, С=12; ตอนนี้เราเขียน C2Cl4 - นี่คือคลอโรเอธิลีน) อย่างที่ทราบกันดีอยู่แล้วว่ากลายเป็นแสงภายใต้อิทธิพลของคลอรีน - เฮกซะคลอโรอีเทน (ตามศัพท์ในเวลานั้น - Kohlensuperchlorurur) และเราสามารถคาดหวังได้ว่าถ้ามันอยู่ภายใต้การกระทำของน้ำในเวลาเดียวกันเช่นบิสมัทคลอไรด์คลอรีนพลวง ฯลฯ ในช่วงเวลาของการก่อตัวก็จะแทนที่คลอรีนด้วยออกซิเจน ประสบการณ์ยืนยันสมมติฐาน "ภายใต้การกระทำของแสงและคลอรีนบน C2Cl4 ซึ่งอยู่ใต้น้ำ Kolbe ได้รับพร้อมกับ hexachloroethane กรดไตรคลอโรอะซิติกและแสดงการเปลี่ยนแปลงดังนี้: (เนื่องจาก C2Cl4 สามารถรับได้จาก CCl4 โดยผ่าน a ให้ความร้อน) หลอด และ CCl4 เกิดขึ้นจากการกระทำ เมื่อให้ความร้อนของ Cl2 บน CS2 จากนั้นปฏิกิริยา Kolbe คือการสังเคราะห์กรดอะซิติกครั้งแรกจากธาตุต่างๆ) “ไม่ว่ากรดออกซาลิกอิสระจะเกิดขึ้นพร้อมกันหรือไม่ก็ยาก ตัดสินใจเนื่องจากคลอรีนออกซิไดซ์ทันทีเป็นกรดอะซิติกในแสง "... มุมมองของ Berzelius เกี่ยวกับกรดคลอโรอะซิติก "น่าแปลกใจ (auf eine tiberraschende Weise) ได้รับการยืนยันโดยการดำรงอยู่และความเท่าเทียมกันของคุณสมบัติของกรดกำมะถันรวมและดูเหมือนว่าจะ ฉัน (Kolbe I. p. 186) กล่าว ก้าวไปไกลกว่าขอบเขตของสมมติฐานและได้รับความน่าจะเป็นในระดับสูง สำหรับถ้ากรดคลอโรอะซิติก (Chlorkohlenoxalsaure ตามที่ Kolbe เรียกว่ากรดคลอโรอะซิติก) มีองค์ประกอบ องค์ประกอบเหมือนกรดคลอโรคาร์บอนิกนั้นเรายังต้องพิจารณากรดอะซิติกซึ่งเป็นตัวกำหนดของกรดเมทิลซัลฟอรัสเป็นกรดรวมและพิจารณาว่าเป็นกรดเมทิลออกซาลิก: C2H6.C2O3 (นี่คือมุมมองที่เจอราร์ดแสดงไว้ก่อนหน้านี้) ไม่น่าเชื่อว่าในอนาคตเราจะถูกบังคับให้ใช้กรดรวมเป็นจำนวนมากของกรดอินทรีย์เหล่านั้นซึ่งในปัจจุบันเนื่องจากข้อ จำกัด ของข้อมูลของเราเราจึงยอมรับอนุมูลสมมุติ ... "" สำหรับปรากฏการณ์ ของการแทนที่ในกรดรวมเหล่านี้ จากนั้นพวกเขาก็ได้รับคำอธิบายง่ายๆ ว่าสารประกอบไอโซมอร์ฟิคหลายชนิดสามารถแทนที่กันในบทบาทของกลุ่มรวม (เช่น Paarlinge, l. p. p. 187) โดยไม่เปลี่ยนแปลงคุณสมบัติที่เป็นกรดของกรด ร่างกายรวมกับพวกเขา "การยืนยันการทดลองเพิ่มเติมเราพบมุมมองนี้ในบทความโดย Frankland และ Kolbe: "Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen "Nitrile" bekannten Verbindunge" ("Ann. Chem . n. Pharm.", 65, 1848, 288) จากแนวคิดที่ว่ากรดทั้งหมดของซีรีส์ (CH2)2nO4 ถูกสร้างขึ้นเหมือนกรดเมทิลออกซาลิก (ตอนนี้เราเขียน CnH2nO2 และเรียกกรดเมทิลออกซาลิก - อะซิติก) พวกเขาสังเกตเห็นสิ่งต่อไปนี้ ทั่วไป: "ถ้าสูตร H2O + H2.C2O3 แสดงถึงการแสดงออกที่แท้จริงขององค์ประกอบที่เป็นเหตุเป็นผลของกรดฟอร์มิก นั่นคือถ้าถือว่าเป็นกรดออกซาลิกรวมกับไฮโดรเจนที่เทียบเท่ากัน (นิพจน์ไม่ถูกต้อง แทน H. Frankland และ Kolbe ใช้ตัวอักษรที่ขีดฆ่าซึ่งเทียบเท่ากับ 2 N.) จากนั้นให้แปลงด้วย อุณหภูมิสูงแอมโมเนียมก่อตัวเป็นกรดไฮโดรไซยานิกที่เป็นน้ำ เพราะโดเบอไรเนอร์เป็นที่รู้จักและค้นพบว่าแอมโมเนียมออกซาเลตสลายตัวเมื่อถูกความร้อนในน้ำและสีฟ้า เมื่อรวมกันในกรดฟอร์มิก ไฮโดรเจนมีส่วนร่วมในปฏิกิริยาโดยข้อเท็จจริงที่ว่าเมื่อรวมกับสีฟ้า จะเกิดกรดไฮโดรไซยานิก: การศึกษาย้อนกลับกรดฟอร์มิกจากกรดไฮโดรไซยานิกภายใต้อิทธิพลของอัลคาลิสไม่มีอะไรมากไปกว่าการทำซ้ำของการเปลี่ยนแปลงที่รู้จักกันดีของไซยาไนด์ที่ละลายในน้ำเป็นกรดออกซาลิกและแอมโมเนียโดยมีความแตกต่างเพียงอย่างเดียว ว่าในขณะที่การก่อตัวของกรดออกซาลิกจะรวมกับไฮโดรเจนของกรดไฮโดรไซยานิก "ความจริงที่ว่าเบนซีนไซยาไนด์ (C6H5CN) เช่นตาม Fehling ไม่มีคุณสมบัติเป็นกรดและไม่ก่อให้เกิดกระป๋องปรัสเซียนสีน้ำเงินตาม Kolbe และแฟรงก์แลนด์ควบคู่ไปกับเอทิลคลอไรด์ที่ไม่สามารถทำปฏิกิริยากับ AgNO3 และโคลเบและแฟรงก์แลนด์พิสูจน์ความถูกต้องด้วยการสังเคราะห์โดยใช้วิธีไนไตรล์ (พวกเขาได้ไนไตรล์จากการกลั่นกรดซัลฟิวริกด้วย KCN (โดยวิธีดูมัสและมาลากุตติด้วยเลอบลัง) : R "SO3 (OH) + KCN \u003d R. CN + KHSO4) อะซิติก, โพรพิโอนิก (ตามนั้น, เมธ-อะซิโตน) และกรดคาโปรอิก จากนั้นในปีต่อมา Kolbe ได้ใช้เกลืออัลคาไลน์ของกรดอิ่มตัวโมโนเบสิก เพื่ออิเล็กโทรไลซิสและตามรูปแบบของเขาสังเกตในเวลาเดียวกันในระหว่างการอิเล็กโทรไลซิสของกรดอะซิติกการก่อตัวของอีเทนกรดคาร์บอนิกและไฮโดรเจน: H2O+C2H6.C2O3=H2+ และในอิเล็กโทรไลซิสของกรดวาเลอริก - ออกเทน , กรดคาร์บอนิกและไฮโดรเจน: H2O+C8H18.C2O3=H2+. อย่างไรก็ตาม เป็นไปไม่ได้ที่จะไม่สังเกตว่า Kolbe คาดว่าจะได้รับเมทิล (CH3) "รวมกับไฮโดรเจน เช่น ก๊าซหนอง จากกรดอะซิติก และบิวทิล C4H9 จากกรดวาเลอริก รวมกับไฮโดรเจน เช่น C4H10 (เขาเรียกว่า C4H9 vallyl) แต่ในความคาดหวังนี้ต้องเห็นการยอมจำนนต่อสูตรของเจอราร์ดซึ่งได้รับสิทธิการเป็นพลเมืองที่สำคัญแล้วซึ่งละทิ้งมุมมองก่อนหน้านี้เกี่ยวกับกรดอะซิติกและถือว่าไม่ใช่สำหรับ C4H8O4 ซึ่งสูตรตัดสินโดยข้อมูลการแช่แข็งก็มีอยู่จริง แต่สำหรับ C2H4O2 ตามที่เขียนไว้ในตำราเคมีสมัยใหม่ทั้งหมด
โดยผลงานของ Kolbe โครงสร้างของกรดอะซิติกและในเวลาเดียวกันกรดอินทรีย์อื่น ๆ ทั้งหมดได้รับการอธิบายในที่สุดและบทบาทของนักเคมีที่ตามมาก็ลดลงเพียงการแบ่ง - เนื่องจากการพิจารณาทางทฤษฎีและอำนาจของเจอราร์ดสูตรของ Kolbe ในครึ่ง และแปลเป็นภาษาของมุมมองเชิงโครงสร้าง เนื่องจากสูตร C2H6.C2O4H2 กลายเป็น CH3.CO(OH)
2. คุณสมบัติของกรดอะซิติก
กรดคาร์บอกซิลิก- สารประกอบอินทรีย์ที่มีหมู่คาร์บอกซิลอย่างน้อยหนึ่งหมู่ -COOH ที่เกี่ยวข้องกับอนุมูลไฮโดรคาร์บอน
คุณสมบัติของกรดกรดคาร์บอกซิลิกเกิดจากการเปลี่ยนความหนาแน่นของอิเล็กตรอนไปเป็นออกซิเจนคาร์บอนิล และทำให้เกิดโพลาไรเซชันเพิ่มเติม (เมื่อเทียบกับแอลกอฮอล์) ของพันธะ O–H
ในสารละลายที่เป็นน้ำ กรดคาร์บอกซิลิกจะแยกตัวออกเป็นไอออน:
เมื่อน้ำหนักโมเลกุลเพิ่มขึ้น ความสามารถในการละลายของกรดในน้ำจะลดลง
ตามจำนวนกลุ่มคาร์บอกซิล กรดจะแบ่งออกเป็น monobasic (monocarboxylic) และ polybasic (dicarboxylic, tricarboxylic เป็นต้น)
ตามลักษณะของอนุมูลไฮโดรคาร์บอนกรดอิ่มตัวไม่อิ่มตัวและอะโรมาติกมีความโดดเด่น
ชื่อกรดอย่างเป็นระบบจะได้รับจากชื่อของไฮโดรคาร์บอนที่สอดคล้องกันด้วยการเติมคำต่อท้าย -ovayaและคำพูด กรด. มักจะใช้ชื่อที่ไม่สำคัญเช่นกัน
กรดโมโนเบสิกอิ่มตัวบางชนิด
| สูตร | ชื่อ |
|
| เป็นระบบ | ไร้สาระ |
|
| HCOOH | มีเทน | แบบฟอร์ม |
| อีเทน | อะซิติก | |
| โพรเพน | โพรพิโอนิก | |
| บิวเทน | มันเยิ้ม | |
| เพนเทน | valerian | |
| เฮกเซน | kapron | |
| pentadecanoic | palmitic | |
| ตับอ่อน | สเตียริก | |
กรดคาร์บอกซิลิกมีปฏิกิริยาสูง พวกมันทำปฏิกิริยากับสารต่าง ๆ และสร้างสารประกอบต่าง ๆ ซึ่งมีความสำคัญอย่างยิ่ง อนุพันธ์เชิงฟังก์ชัน, เช่น. สารประกอบที่เกิดจากปฏิกิริยาที่หมู่คาร์บอกซิล
2.1 การก่อตัวของเกลือ
ก) เมื่อทำปฏิกิริยากับโลหะ:
2RCOOH + Mg ® (RCOO) 2 มก. + H 2
b) ในปฏิกิริยากับโลหะไฮดรอกไซด์:
2RCOOH + NaOH ® RCOONa + H 2 O
แทนที่จะใช้กรดคาร์บอกซิลิก กรดเฮไลด์ของพวกมันมักถูกใช้แทน:
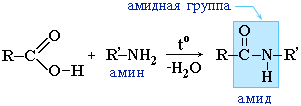 |
เอไมด์ยังเกิดขึ้นจากปฏิกิริยาของกรดคาร์บอกซิลิก (เฮไลด์หรือแอนไฮไดรด์ของพวกมัน) กับอนุพันธ์อินทรีย์ของแอมโมเนีย (เอมีน):
เอไมด์มีบทบาทสำคัญในธรรมชาติ โมเลกุลของเปปไทด์และโปรตีนธรรมชาติถูกสร้างขึ้นจากกรดอะมิโนโดยมีส่วนร่วมของกลุ่มเอไมด์ - พันธะเปปไทด์
อะซิติก (กรดเอทาโนอิก)
สูตร: CH 3 - COOH; ของเหลวใสไม่มีสีมีกลิ่นฉุน ใต้จุดหลอมเหลว (mp 16.6 องศาเซลเซียส) มวลเหมือนน้ำแข็ง (ดังนั้น กรดอะซิติกเข้มข้นจึงเรียกว่ากรดอะซิติกน้ำแข็ง) ละลายในน้ำเอทานอล
ตารางที่ 1. คุณสมบัติทางกายภาพของกรดอะซิติก
| ชื่อ | สูตร | เดือด | วิธีการแก้- | คา |
||||
| กรด | เกลือของเธอ |
|||||||
| อะซิติก | อีเทน | อะซิเตท | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
กรดอะซิติกเกรดอาหารสังเคราะห์เป็นของเหลวใสไม่มีสีและติดไฟได้ มีกลิ่นน้ำส้มสายชูจัด กรดอะซิติกเกรดอาหารสังเคราะห์ผลิตจากเมทานอลและคาร์บอนมอนอกไซด์บนตัวเร่งปฏิกิริยาโรเดียม กรดอะซิติกสำหรับอาหารสังเคราะห์ใช้ในอุตสาหกรรมเคมี ยา และอุตสาหกรรมเบา เช่นเดียวกับใน อุตสาหกรรมอาหารเป็นสารกันบูด สูตร CH 3 COOH.
กรดอะซิติกเกรดอาหารสังเคราะห์มีความเข้มข้น (99.7%) และอยู่ในรูปของสารละลายในน้ำ (80%)
ตามตัวชี้วัดทางกายภาพและทางเคมี กรดอะซิติกสำหรับอาหารสังเคราะห์ต้องเป็นไปตามมาตรฐานต่อไปนี้:
ตารางที่ 2. ข้อกำหนดทางเทคนิคหลัก
| ชื่อของตัวบ่งชี้ | |
| 1. รูปร่าง | ของเหลวใสไม่มีสีไม่มีสิ่งเจือปนทางกล |
| 2. ความสามารถในการละลายน้ำ | โซลูชั่นที่สมบูรณ์ ชัดเจน |
| 3. เศษส่วนมวลของกรดอะซิติก % ไม่น้อยกว่า | 99,5 |
| 4. เศษส่วนมวลของอะซีตัลดีไฮด์% ไม่มาก | 0,004 |
| 5. เศษส่วนมวลของกรดฟอร์มิก % ไม่มาก | 0,05 |
| 6. เศษส่วนมวลของซัลเฟต (SO 4),%, ไม่มาก | 0,0003 |
| 7. เศษส่วนมวลของคลอไรด์ (Cl),%, ไม่มาก | 0,0004 |
| 8. เศษโลหะหนักที่ตกตะกอนด้วยไฮโดรเจนซัลไฟด์ (Pb),% ไม่มาก | 0,0004 |
| 9. เศษส่วนของเหล็ก (Fe),%, ไม่มาก | 0,0004 |
| 10. เศษส่วนมวลสารตกค้างไม่ระเหย% ไม่มาก | 0,004 |
| 11. ความคงทนของสีของสารละลายโพแทสเซียมเปอร์แมงกาเนต ขั้นต่ำ ไม่น้อย | 60 |
| 12. เศษส่วนของสารออกซิไดซ์โดยโพแทสเซียมไดโครเมต cm 3 สารละลายโซเดียมไธโอซัลเฟตความเข้มข้น c (Na 2 SO 3 * 5H 2 O) \u003d 0.1 mol / dm 3 (0.1H) ไม่มาก | 5,0 |
กรดอะซิติกอาหารสังเคราะห์เป็นของเหลวไวไฟ ตามระดับของผลกระทบต่อร่างกาย มันเป็นของสารประเภท 3 อันตราย เมื่อทำงานกับกรดอะซิติก ให้ใช้ หมายถึงบุคคลการป้องกัน (กรองหน้ากากป้องกันแก๊สพิษ) การปฐมพยาบาลเบื้องต้นสำหรับการเผาไหม้ - ล้างด้วยน้ำปริมาณมาก
กรดอะซิติกอาหารสังเคราะห์ถูกเทลงในรถถังรางสะอาด, รถบรรทุกถังด้วย พื้นผิวด้านในตั้งแต่สแตนเลส ไปจนถึงภาชนะสแตนเลส ภาชนะและถังที่มีความจุสูงถึง 275 dm3 เช่นเดียวกับในขวดแก้วและถังโพลีเอทิลีนที่มีความจุสูงถึง 50 dm3 ภาชนะโพลีเมอร์เหมาะสำหรับอ่าวและการเก็บรักษากรดอะซิติกภายในหนึ่งเดือน กรดอะซิติกเกรดอาหารสังเคราะห์ถูกเก็บไว้ในถังสแตนเลสแบบสุญญากาศ ภาชนะ ภาชนะ ถัง บาร์เรล ขวด และขวดโพลีเอทิลีนถูกเก็บไว้ในโกดังหรือใต้หลังคา ไม่อนุญาตให้จัดเก็บร่วมกับสารออกซิไดซ์อย่างแรง (กรดไนตริก กรดซัลฟิวริก โพแทสเซียมเปอร์แมงกาเนต ฯลฯ)
มันถูกขนส่งในถังรถไฟที่ทำจากสแตนเลสเกรด 12X18H10T หรือ 10X17H13M2T ที่มีการปล่อยด้านบน
3. รับกรดอะซิติก
กรดอะซิติกเป็นผลิตภัณฑ์เคมีที่สำคัญที่สุดซึ่งใช้กันอย่างแพร่หลายในอุตสาหกรรมเพื่อการผลิตเอสเทอร์ โมโนเมอร์ (ไวนิลอะซิเตท) ในอุตสาหกรรมอาหาร ฯลฯ การผลิตทั่วโลกถึง 5 ล้านตันต่อปี จนกระทั่งเมื่อไม่นานมานี้ การผลิตกรดอะซิติกใช้วัตถุดิบปิโตรเคมีเป็นหลัก ในกระบวนการวอล์คเกอร์ เอทิลีนใน สภาพไม่รุนแรงออกซิไดซ์ด้วยออกซิเจนในบรรยากาศเป็นอะซีตัลดีไฮด์ต่อหน้าระบบเร่งปฏิกิริยา PdCl2 และ CuCl2 นอกจากนี้ อะซีตัลดีไฮด์ยังถูกออกซิไดซ์เป็นกรดอะซิติก:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
ตามวิธีการอื่น กรดอะซิติกได้มาจากการออกซิไดซ์ n-butane ที่อุณหภูมิ 200 C และความดัน 50 atm ต่อหน้าตัวเร่งปฏิกิริยาโคบอลต์
กระบวนการวอล์คเกอร์ที่สง่างามซึ่งเป็นหนึ่งในสัญลักษณ์ของการพัฒนาปิโตรเคมีค่อยๆ ถูกแทนที่ด้วยวิธีการใหม่โดยใช้วัตถุดิบถ่านหิน วิธีการผลิตกรดอะซิติกจากเมทานอลได้รับการพัฒนา:
CH3OH + COCH3COOH
ปฏิกิริยานี้ ซึ่งมีความสำคัญทางอุตสาหกรรมอย่างมาก เป็นตัวอย่างที่ดีเยี่ยมของความสำเร็จของตัวเร่งปฏิกิริยาที่เป็นเนื้อเดียวกัน เนื่องจากทั้งสององค์ประกอบของปฏิกิริยา - CH3OH และ CO - สามารถหาได้จากถ่านหิน กระบวนการคาร์โบนิเลชั่นจึงควรประหยัดมากขึ้นเมื่อราคาน้ำมันสูงขึ้น มีสองกระบวนการทางอุตสาหกรรมสำหรับคาร์บอนิลเลชันของเมทานอล วิธีการแบบเก่าที่พัฒนาโดย BASF ใช้ตัวเร่งปฏิกิริยาโคบอลต์ สภาวะของปฏิกิริยารุนแรง: อุณหภูมิ 250°C และความดัน 500-700 atm อีกกระบวนการหนึ่งที่มอนซานโตเชี่ยวชาญในการใช้ตัวเร่งปฏิกิริยาโรเดียม ปฏิกิริยาได้ดำเนินการที่มากกว่า อุณหภูมิต่ำ(150-200 C) และแรงดัน (1-40 atm) ประวัติการค้นพบกระบวนการนี้น่าสนใจ นักวิทยาศาสตร์ของบริษัทได้ตรวจสอบการเกิดไฮโดรฟอร์มมิเลชันโดยใช้ตัวเร่งปฏิกิริยาโรเดียมฟอสฟีน ผู้อำนวยการด้านเทคนิคของแผนกปิโตรเคมีแนะนำให้ใช้ตัวเร่งปฏิกิริยาเดียวกันสำหรับเมทานอลคาร์บอนิลเลชั่น ผลของการทดลองเป็นลบ และนี่เป็นเพราะความยากลำบากในการสร้างพันธะโลหะและคาร์บอน อย่างไรก็ตาม เมื่อระลึกถึงการบรรยายโดยที่ปรึกษาของบริษัทเกี่ยวกับการเติมเมทิลไอโอไดด์อย่างง่ายลงในสารเชิงซ้อนของโลหะ นักวิจัยจึงตัดสินใจเพิ่มโปรโมเตอร์ไอโอดีนลงในส่วนผสมของปฏิกิริยาและได้ผลลัพธ์ที่ยอดเยี่ยม ซึ่งในตอนแรกไม่เชื่อ นักวิทยาศาสตร์จากบริษัท Union Carbide ซึ่งเป็นบริษัทคู่แข่งก็ได้ค้นพบสิ่งที่คล้ายกัน ซึ่งล้าหลังเพียงไม่กี่เดือน ทีมพัฒนาเทคโนโลยีเมทานอลคาร์บอนิลเลชันหลังจากทำงานอย่างเข้มข้นเพียง 5 เดือน ได้สร้างกระบวนการทางอุตสาหกรรมของมอนซานโต ด้วยความช่วยเหลือซึ่งได้กรดอะซิติก 150,000 ตันในปี 2513 กระบวนการนี้ได้กลายเป็นลางสังหรณ์ของสาขาวิทยาศาสตร์ที่เรียกว่า C1-chemistry
กลไกการเกิดคาร์บอนิลเลชันได้รับการตรวจสอบอย่างกว้างขวาง เมทิลไอโอไดด์ที่จำเป็นสำหรับปฏิกิริยาได้มาจากสมการ
CH3OH + สวัสดี CH3I + H2O
วัฏจักรตัวเร่งปฏิกิริยาสามารถแสดงได้ดังนี้:
เมทิลไอโอไดด์ถูกเติมเข้าไปในสารเชิงซ้อนทรงสี่เหลี่ยมระนาบ - (I) เพื่อสร้างสารเชิงซ้อนหกประสาน II จากนั้นเป็นผลมาจากการแนะนำของ CO ผ่านพันธะเมทิลโรเดียมทำให้เกิดอะเซทิลโรเดียมคอมเพล็กซ์ (III) การกำจัดกรดอะซิติกไอโอไดด์ที่ลดลงจะสร้างตัวเร่งปฏิกิริยาขึ้นมาใหม่ และการไฮโดรไลซิสของไอโอไดด์จะให้กรดอะซิติก
การสังเคราะห์ทางอุตสาหกรรมของกรดอะซิติก:
ก) ตัวเร่งปฏิกิริยาออกซิเดชันของบิวเทน
2CH3–CH2–CH2–CH3 + 5O2 เสื้อ 4CH3COOH + 2H2O
b) ให้ความร้อนกับส่วนผสมของคาร์บอนมอนอกไซด์ (II) และเมทานอลบนตัวเร่งปฏิกิริยาภายใต้ความกดดัน
CH3OH + COCH3COOH
การผลิตกรดอะซิติกโดยการหมัก (การหมักกรดอะซิติก)
วัตถุดิบ: ของเหลวที่มีเอทานอล (ไวน์ น้ำหมัก) ออกซิเจน
สารเพิ่มปริมาณ: เอนไซม์ของแบคทีเรียกรดอะซิติก
ปฏิกิริยาเคมี: เอทานอลถูกออกซิไดซ์ทางชีวภาพไปเป็นกรดอะซิติก
CH 2 - CH - OH + O 2 CH 2 - COOH + H 2 O
ผลิตภัณฑ์หลัก: กรดอะซิติก
4. การใช้กรดอะซิติก
กรดอะซิติกใช้เพื่อให้ได้ยาและสารอะโรมาติก เป็นตัวทำละลาย (เช่น ในการผลิตเซลลูโลสอะซิเตท) ในรูปของน้ำส้มสายชูบนโต๊ะในการผลิตเครื่องปรุงรส หมัก และอาหารกระป๋อง
สารละลายกรดอะซิติกในน้ำใช้เป็นสารปรุงแต่งรสและสารกันบูด (เครื่องปรุงสำหรับอาหาร เห็ดดอง ผัก)
องค์ประกอบของน้ำส้มสายชูประกอบด้วยกรดเช่นมาลิก, แลคติก, แอสคอร์บิก, อะซิติก
น้ำส้มสายชูแอปเปิ้ลไซเดอร์ (กรดอะซิติก 4%)
น้ำส้มสายชูหมักจากแอปเปิ้ลมีสารสำคัญ 20 ชนิด แร่ธาตุและธาตุ เช่นเดียวกับอะซิติก โพรพิโอนิก แลคติกและ กรดมะนาว,เอ็นไซม์และกรดอะมิโนจำนวนหนึ่ง ใยอาหารอันทรงคุณค่า เช่น โปแตช เพคติน น้ำส้มสายชูแอปเปิ้ลไซเดอร์ใช้กันอย่างแพร่หลายในการปรุงอาหารและบรรจุกระป๋อง เข้ากันได้ดีกับสลัดทุกชนิด ทั้งจากผักสด เนื้อสัตว์และปลา สามารถใช้หมักเนื้อ แตงกวา กะหล่ำปลี เคเปอร์ เพอร์เลน และทรัฟเฟิล อย่างไรก็ตาม ทางตะวันตก น้ำส้มสายชูหมักจากแอปเปิลเป็นที่รู้จักกันเป็นอย่างดีในเรื่อง สรรพคุณทางยา. ใช้สำหรับสูง ความดันโลหิต,ไมเกรน, หอบหืด, ปวดหัว, โรคพิษสุราเรื้อรัง, เวียนศีรษะ, โรคไขข้อ, โรคไต, ไข้สูง, แผลไฟไหม้, แผลกดทับ ฯลฯ
คนรักสุขภาพขอแนะนำให้ใช้เครื่องดื่มเพื่อสุขภาพและความสดชื่นทุกวัน: ผสมน้ำผึ้งหนึ่งช้อนในน้ำหนึ่งแก้วและเติมน้ำส้มสายชูแอปเปิ้ลไซเดอร์ 1 ช้อน หากคุณต้องการลดน้ำหนัก เราขอแนะนำให้คุณดื่มน้ำไม่หวานหนึ่งแก้วกับน้ำส้มสายชูแอปเปิ้ลไซเดอร์สองช้อนโต๊ะทุกครั้งที่คุณกิน
น้ำส้มสายชูใช้กันอย่างแพร่หลายในการบรรจุกระป๋องที่บ้านเพื่อเตรียมน้ำดองที่มีจุดแข็งต่างๆ ที่ ยาพื้นบ้านน้ำส้มสายชูใช้เป็นยาลดไข้ที่ไม่เฉพาะเจาะจง (โดยการถูผิวด้วยน้ำและน้ำส้มสายชูในอัตราส่วน 3: 1) เช่นเดียวกับอาการปวดหัวโดยใช้โลชั่น เป็นเรื่องปกติที่จะใช้น้ำส้มสายชูสำหรับแมลงกัดต่อยโดยการประคบ
เป็นที่ทราบกันดีว่าการใช้น้ำส้มสายชูแอลกอฮอล์ในด้านความงาม กล่าวคือ เพื่อให้ผมนุ่มสลวยเป็นเงางามหลังการดัดและทำสีถาวร ในการทำเช่นนี้ขอแนะนำให้ล้างผมด้วยน้ำอุ่นด้วยการเติมน้ำส้มสายชูแอลกอฮอล์ (น้ำส้มสายชู 3-4 ช้อนโต๊ะต่อน้ำ 1 ลิตร)
น้ำส้มสายชูองุ่น (กรดอะซิติก 4%)
น้ำส้มสายชูองุ่นใช้กันอย่างแพร่หลายโดยเชฟชั้นนำไม่เพียงแต่ในสโลวีเนียแต่ทั่วโลก ในสโลวีเนีย มีการใช้แบบดั้งเดิมในการเตรียมผักต่างๆ และสลัดตามฤดูกาล (2-3 ช้อนโต๊ะต่อชามสลัด) มันให้รสชาติที่เป็นเอกลักษณ์และประณีตแก่จาน น้ำส้มสายชูองุ่นยังเข้ากันได้ดีกับสลัดปลาและอาหารทะเลต่างๆ เมื่อเตรียมเคบับจากเนื้อสัตว์ประเภทต่างๆ แต่โดยเฉพาะอย่างยิ่งจากเนื้อหมู น้ำส้มสายชูองุ่นเป็นสิ่งที่ขาดไม่ได้
กรดอะซิติกยังใช้สำหรับการผลิต ยา.
เม็ดแอสไพริน (ES) มีกรดอะซิติลซาลิไซลิกที่ใช้งานอยู่ซึ่งเป็นอะซิติกเอสเทอร์ กรดซาลิไซลิก.
กรดอะซิทิลซาลิไซลิกผลิตโดยการให้ความร้อนกรดซาลิไซลิกด้วยกรดอะซิติกปราศจากน้ำต่อหน้ากรดซัลฟิวริกจำนวนเล็กน้อย (เป็นตัวเร่งปฏิกิริยา)
เมื่อถูกความร้อนด้วยโซเดียมไฮดรอกไซด์ (NaOH) ในสารละลายที่เป็นน้ำ กรดอะซิติลซาลิไซลิกจะไฮโดรไลซ์เป็นโซเดียมซาลิไซเลตและโซเดียมอะซิเตท เมื่อตัวกลางถูกทำให้เป็นกรด กรดซาลิไซลิกจะตกตะกอนและสามารถระบุได้ด้วยจุดหลอมเหลว (156-1600C) อีกวิธีหนึ่งในการระบุกรดซาลิไซลิกที่เกิดขึ้นระหว่างการไฮโดรไลซิสคือการทำให้สีของสารละลายเป็นสีม่วงเข้มเมื่อเติมเหล็กคลอไรด์ (FeCl3) กรดอะซิติกที่มีอยู่ในตัวกรองจะถูกแปลงโดยการให้ความร้อนด้วยเอธานอลและกรดซัลฟิวริกไปเป็นเอทอกซีเอธานอล ซึ่งสามารถรับรู้ได้ง่ายจากกลิ่นเฉพาะตัว นอกจากนี้ กรดอะซิติลซาลิไซลิกสามารถระบุได้โดยใช้วิธีโครมาโตกราฟีแบบต่างๆ
กรดอะซิติลซาลิไซลิกตกผลึกจนเกิดเป็นรูปทรงโพลีเฮดรา monoclinic ที่ไม่มีสีหรือเข็มที่มีรสเปรี้ยวเล็กน้อย มีความคงตัวในอากาศแห้ง แต่จะค่อยๆ ไฮโดรไลซ์เป็นกรดซาลิไซลิกและกรดอะซิติกในสภาพแวดล้อมที่มีความชื้น (Leeson and Mattocks, 1958; Stempel, 1961) สารบริสุทธิ์เป็นผงผลึกสีขาว แทบไม่มีกลิ่น กลิ่นของกรดอะซิติกบ่งชี้ว่าสารได้เริ่มไฮโดรไลซ์แล้ว กรดอะซิติลซาลิไซลิกผ่านเอสเทอริฟิเคชันภายใต้การกระทำของอัลคาไลน์ไฮดรอกไซด์ อัลคาไลน์ไบคาร์บอเนต และในน้ำเดือด
กรดอะซิทิลซาลิไซลิกมีฤทธิ์ต้านการอักเสบ ลดไข้ และยาแก้ปวด และมีการใช้กันอย่างแพร่หลายสำหรับไข้ ปวดศีรษะ โรคประสาท ฯลฯ และเป็นยาแก้โรคไขข้อ
กรดอะซิติกยังใช้ในอุตสาหกรรมเคมี (การผลิตเซลลูโลสอะซิเตทซึ่งได้เส้นใยอะซิเตทแก้วอินทรีย์ฟิล์มสำหรับการสังเคราะห์สีย้อมยาและเอสเทอร์) ในการผลิตฟิล์มที่ไม่ติดไฟผลิตภัณฑ์น้ำหอม ตัวทำละลายในการสังเคราะห์สีย้อม สารยาเช่น แอสไพริน เกลือของกรดอะซิติกใช้เพื่อควบคุมศัตรูพืช
บทสรุป
ในบทความนี้ ได้พิจารณาถึงประเด็นของการค้นพบกรดอะซิติก คุณสมบัติหลัก การผลิต และการใช้งานของกรดอะซิติก
ดังนั้นกรดอะซิติก (CH3COOH) ซึ่งเป็นของเหลวไวไฟไม่มีสีมีกลิ่นฉุนจึงละลายได้ดีในน้ำ มีรสเปรี้ยวนำไฟฟ้า การใช้กรดอะซิติกในอุตสาหกรรมมีขนาดใหญ่มาก
ที่กรดอะซิติกที่ผลิตในรัสเซียอยู่ในระดับมาตรฐานโลกที่ดีที่สุด มีความต้องการสูงในตลาดโลก และส่งออกไปยังหลายประเทศทั่วโลก
การผลิตกรดอะซิติกมีข้อกำหนดเฉพาะหลายประการ ดังนั้นจำเป็นต้องมีผู้เชี่ยวชาญที่มีประสบการณ์อย่างกว้างขวาง ไม่เพียงแต่ในด้านระบบอัตโนมัติทางอุตสาหกรรมและการควบคุมกระบวนการเท่านั้น แต่ยังมีความเข้าใจที่ชัดเจนเกี่ยวกับข้อกำหนดพิเศษของอุตสาหกรรมนี้ด้วย
รายชื่อวรรณกรรมที่ใช้แล้ว
1. Artemenko, อเล็กซานเดอร์ อิวาโนวิช คู่มืออ้างอิงเคมี / A.I. อาร์เตเมนโก, I.V. Tikunova, V.A. ทาสี. - ครั้งที่ 2 แก้ไข และเพิ่มเติม - ม.: ม.ต้น ปี 2545 - 367 น.
2. Akhmetov เล็บ Sibgatovich เคมีทั่วไปและอนินทรีย์: หนังสือเรียนสำหรับนักเรียน เคมี-เทคโนโลยี ผู้เชี่ยวชาญ. มหาวิทยาลัย / Akhmetov N.S. - 4th ed. / Rev. - M.: Higher School, 2002.-743 p.
3. Berezin, Boris Dmitrievich หลักสูตรเคมีอินทรีย์สมัยใหม่: Proc. เบี้ยเลี้ยงสำหรับนักเรียน มหาวิทยาลัย การศึกษา เคมี-เทคโนโลยี พิเศษ / Berezin B.D. , Berezin D.B.-M.: Higher School, 2001.-768 p.
4. I. G. Bolesov, G. S. Zaitseva กรดคาร์บอกซิลิกและอนุพันธ์ของกรดคาร์บอกซิลิก (การสังเคราะห์ การเกิดปฏิกิริยา การประยุกต์ใช้ในการสังเคราะห์สารอินทรีย์) วัสดุที่เป็นระเบียบในวิชาเคมีอินทรีย์ทั่วไป ฉบับที่ 5. มอสโก 1997
5. Sommer K. นักสะสมความรู้ด้านเคมี. ต่อ. กับภาษาเยอรมัน ฉบับที่ 2 – M.: Mir, 1985. – 294 p.
6. Karakhanov E.A. ก๊าซสังเคราะห์ทดแทนน้ำมัน I. กระบวนการ Fischer-Tropsch และการสังเคราะห์ oxo // วารสารการศึกษาโซรอส 2540 ลำดับที่ 3 ส. 69-74
เพิ่มเติมจากเคมี:
- การตรวจสอบ: วิธีทางเคมีสำหรับการสกัดน้ำและไนโตรเจนรวม
- สรุป: หน่วยกลั่นของการดำเนินการต่อเนื่องสำหรับการแยกส่วนผสมไบนารีของอะซิโตน - เอทานอล 4.1 ตันต่อชั่วโมง
โครงการหลักสูตร OHT
"วิธีอุตสาหกรรมสำหรับการผลิตกรดอะซิติก"
บทนำ
กรดอะซิติก (เอทาโนอิก) เป็นสารอินทรีย์ที่มีสูตรโมเลกุล CH 3COOH (ย่อมาจาก AcOH) เป็นกรดโมโนเบสิกที่อ่อนแรง เกลือของกรดอะซิติกและเอสเทอร์เรียกว่า อะซิเตท .
น้ำส้มสายชู (สารละลายกรดอะซิติก) เป็นที่รู้จักกันมาตั้งแต่สมัยโบราณว่าเป็นผลิตภัณฑ์หมัก ในสมัยโบราณ (ศตวรรษที่ 3 ก่อนคริสต์ศักราช) น้ำส้มสายชูถูกใช้เพื่อผลิตตะกั่วขาว ในปัจจุบัน กรดอะซิติกมีการใช้หลักสามประการ: ประการแรก เป็นตัวทำละลายสำหรับการสังเคราะห์สารอินทรีย์บางชนิด ประการที่สอง เป็นรีเอเจนต์ที่เป็นกรดอ่อน (สำหรับการดับผลิตภัณฑ์หลักที่เกิดขึ้น ฯลฯ) และสุดท้าย ประการที่สาม เพื่อผลิตอนุพันธ์ที่สำคัญเช่น กรดคลอไรด์ หรือ อะซิติกแอนไฮไดรด์ , เช่นเดียวกับเธอ อะไมด์ และอื่นๆ. อะซิลคลอไรด์และอะซิติกแอนไฮไดรด์เป็นสาร acylating ที่สำคัญที่มักใช้ในการสังเคราะห์สารอินทรีย์
สารละลายกรดอะซิติกที่ใช้ในอุตสาหกรรมอาหาร (เช่นเดียวกับการปรุงอาหารในครัวเรือนและการทำเกลือ) มีชื่อ น้ำส้มสายชู (3-15%) และ สาระสำคัญของน้ำส้มสายชู (70-80%). กรดอะซิติกแอบโซลูท (ประมาณ 99.8%) เรียกว่า น้ำแข็ง , เพราะ เมื่อถูกแช่แข็ง จะเกิดเป็นก้อนน้ำแข็ง
ปริมาณการผลิตกรดอะซิติกอยู่ที่ประมาณ 5 ล้านตัน/ปี โดยผลิตประมาณ 50% โดยวิธี Kolbe (ดูด้านล่าง)
. คุณสมบัติทางเคมีกายภาพ
ที่ n.o. กรดอะซิติกเป็นของเหลวไม่มีสีมีกลิ่นฉุนมาก ตารางด้านล่างสรุปค่าคงที่ทางกายภาพหลักของกรดอะซิติก
เอ็ม r , g/molp, g/cm 3เมลท์., เกี่ยวกับ STkip., เกี่ยวกับ สกฤต. pointRes., J/mol*KDN เกี่ยวกับ , kJ/molrKan60.051.049216.75118.1321.6 เกี่ยวกับ C 5.79 MPa123.4-4874.761.372
กรดอะซิติกมีความแปรปรวนในแง่ของตัวทำละลายเพราะ มีกลุ่มขั้ว (-COOH) และกลุ่มไม่มีขั้ว (-CH .) ในองค์ประกอบของมัน 3). ดังนั้นจึงสามารถละลายได้อย่างสมบูรณ์ในน้ำและในตัวทำละลายอินทรีย์บางชนิด นอกจากนี้ยังสร้างอะซีโอโทรปแบบคู่และสามชนิดของ "ตัวทำละลายอินทรีย์กรด-น้ำ-อินทรีย์"
กรดอะซิติกอ่อนแอ กรดอินทรีย์. สามารถทำปฏิกิริยากับโลหะแอคทีฟด้วยการปลดปล่อยไฮโดรเจน:
เปลี่ยนเป็นอนุพันธ์ของกรดภายใต้การกระทำของรีเอเจนต์ที่เหมาะสม (ปฏิกิริยาที่สำคัญในการสังเคราะห์สารอินทรีย์):
ก) เป็นกรดเฮไลด์
b) เป็นเอสเทอร์
c) เป็นเอไมด์
กู้คืนเป็นเอทิลแอลกอฮอล์:
และยังเข้าสู่ปฏิกิริยาการทดแทนที่กลุ่มเมธิลซึ่งที่สำคัญที่สุดคือปฏิกิริยา Gel-Volhard-Zelinsky ซึ่งใช้เพื่อให้ได้กรดอะมิโนที่สำคัญ - ไกลซีน:
ยิ่งกว่านั้นด้วยการแทนที่แต่ละครั้งเนื่องจากผลของการเหนี่ยวนำของฮาโลเจน ความแข็งแรงของกรดจะเพิ่มขึ้น ตัวอย่างเช่น กรดไตรฟลูออโรอะซิติกมีความแข็งแรงใกล้เคียงกับกรดแร่
. วิธีการที่จะได้รับ
ได้กำไรและชัดเจนที่สุด วิธีทางเคมีการได้รับกรดอะซิติกคือการออกซิไดซ์ของอัลดีไฮด์ที่สอดคล้องกัน ( อะซีตัลดีไฮด์ หรือ ethanal ) ซึ่งในทางกลับกัน ได้มาด้วยวิธีใดวิธีหนึ่งจากสองวิธี: การให้น้ำ อะเซทิลีน ในที่ที่มีเกลือปรอท (II) (ปฏิกิริยา Chugaev) หรือโดยการเกิดออกซิเดชัน (ดีไฮโดรจีเนชัน) เอทิลแอลกอฮอล์ เหนือทองแดงร้อน:
อะซีตัลดีไฮด์นั้นถูกออกซิไดซ์ได้ง่ายโดยออกซิเจนในบรรยากาศและค่อยๆ เปลี่ยนเป็นกรดอะซิติก
วิธีแรกในการรับเอทานอลจากปฏิกิริยา Chugaev นั้นไม่ได้ผลด้วยเหตุผลหลายประการ รวมถึงการทำงานกับอะเซทิลีนที่ระเบิดได้ การปนเปื้อนของผลิตภัณฑ์ด้วยเกลือปรอทที่เป็นพิษ เครื่องปฏิกรณ์ปริมาณมาก และอื่นๆ ที่พบมากที่สุดคือวิธีที่สองในการรับเอทิลแอลกอฮอล์ (ซึ่งผลิตในปริมาณมากและค่อนข้างถูก)
อะซีตัลดีไฮด์ที่เกิดขึ้นจะถูกออกซิไดซ์โดยออกซิเจนต่อหน้าตัวเร่งปฏิกิริยา - เกลือของแมงกานีส (II) เป็นวิธีการที่จะนำมาพิจารณาในสิ่งต่อไปนี้
ทันสมัยกว่าคือวิธีการเร่งปฏิกิริยาคาร์บอนิลเลชันของเมทานอล (วิธี Kolbe) ตามปฏิกิริยา:
วิธีนี้ทำให้สามารถบรรลุผลผลิตในลำดับ 99% สำหรับเมทานอลและ 90% สำหรับ CO ประกอบด้วยคาร์บอนมอนอกไซด์เดือดปุด ๆ ที่อุณหภูมิ 180°C และความดัน 200-700 atm ผ่านส่วนผสมของรีเอเจนต์ ตัวเร่งปฏิกิริยาคือโคบอลต์หรือโรเดียมไอโอไดด์เช่นเดียวกับสารประกอบอิริเดียมที่หายากกว่า บน ช่วงเวลานี้วิธีนี้ได้กรดอะซิติกทั้งหมดประมาณ 50% ที่ผลิตในโลก
นอกจากนี้ยังมี วิธีทางชีวเคมี(กล่าวคือ โดยการหมักน้ำตาล) อย่างไรก็ตาม น้ำตาลเหล่านี้ไม่ค่อยได้ใช้ สาเหตุหลักมาจากผลผลิตที่ต่ำและความยากลำบากในการแยกส่วนผสมที่ได้ออกจากผลิตภัณฑ์
. เหตุผลในการเลือกกระบวนการทางเทคโนโลยีโดยวิธีการออกซิเดชันของเอทานอล
วิธีนี้มีคุณสมบัติเชิงบวกหลายประการเช่น:
)น้ำยาเริ่มต้นราคาถูก
)ประสิทธิภาพสูง
)ต้นทุนพลังงานค่อนข้างต่ำ (50-60 o จาก)
)ผลตอบแทนสูงของรีเอเจนต์เริ่มต้น
)การแปลงสูงและการเลือกกระบวนการ
)การแยกส่วนผสมที่ค่อนข้างง่าย
ปฏิกิริยาจะดำเนินการในคอลัมน์ฟองสบู่ อุณหภูมิที่สูงขึ้นจำเป็นเพื่อป้องกันปฏิกิริยาข้างเคียงของการก่อตัวของเปอร์ออกไซด์ (เนื่องจากส่วนผสมที่สามารถระเบิดได้) ขีดจำกัดอุณหภูมิบนถูกกำหนดโดยความผันผวนของอะซีตัลดีไฮด์ กรดอะซิติกไม่ได้เป็นเพียงผลิตภัณฑ์จากปฏิกิริยาเท่านั้น แต่ยังเป็นตัวทำละลายด้วย ซึ่งทำให้กระบวนการนี้ง่ายขึ้นอย่างมาก
ตัวชี้วัดทางเทคโนโลยีหลักของกระบวนการสรุปไว้ในตารางด้านล่าง:
. โครงร่างเทคโนโลยีของกระบวนการ
ด้านล่างนี้คือแผนภาพการไหลแบบง่ายสำหรับการผลิตกรดอะซิติกโดยการออกซิเดชันของอะซีตัลดีไฮด์ การกำหนดที่ระบุในแผนภาพสรุปไว้ในตาราง
ของผสมเริ่มต้น (I) เข้าสู่ตัวแลกเปลี่ยนความร้อน (1) โดยให้ความร้อนจนถึงอุณหภูมิของปฏิกิริยา (50-80 °C) การทำความร้อนทำได้โดยไอน้ำร้อน (IX) ซึ่งจะถูกลบออกจากช่องว่างวงแหวนในรูปของคอนเดนเสท (X) การจ่ายอัลดีไฮด์ผลิตโดยปั๊มหอยโข่ง (5) และควบคุมโดยวาล์ว
อัลดีไฮด์ที่ร้อนจะเข้าสู่คอลัมน์ฟอง (2) ที่ติดตั้งคอยล์คูลเลอร์ (ปฏิกิริยาเป็นแบบคายความร้อน) ออกซิเจนทางเทคนิค (II) ถูกเป่าเข้าไปในคอลัมน์ การเกิดออกซิเดชันของอัลดีไฮด์เริ่มต้นขึ้น
ผลิตภัณฑ์ที่เป็นผลลัพธ์ในรูปของส่วนผสมของไอและของเหลวจะถูกปล่อยผ่านด้านบนของคอลัมน์และเข้าสู่ผู้จัดจำหน่าย (4) หลังจากนั้นส่วนหนึ่งของมวลปฏิกิริยาจะเข้าสู่คอลัมน์กลั่นแรก (3) ซึ่งออกแบบมาเพื่อขจัดสิ่งสกปรกที่ระเหยได้ ( ก๊าซไอเสีย - VII) นอกจากนี้ มวลปฏิกิริยาที่เหลือ (IV) จะเข้าสู่คอลัมน์ที่สอง ซึ่งกรดอะซิติก (V) ที่เป็นผลลัพธ์จะถูกปล่อยออกสู่ผู้บริโภคหรือไปยังคลังสินค้า เรซิดิวภาษีมูลค่าเพิ่ม (VI) ที่มีเอทิลลิดีนไดอะซิเตตจะถูกลบออกจากคอลัมน์ด้วย อะซีตัลดีไฮด์ที่ไม่ทำปฏิกิริยา (VIII) จะถูกส่งกลับไปยังคอลัมน์ฟองสบู่ ซึ่งจะช่วยลดปริมาณของอัลดีไฮด์ที่จำเป็นในขั้นต้นเพื่อให้มั่นใจถึงประสิทธิภาพที่กำหนด (การแปลงวัตถุดิบที่เพิ่มขึ้น) .
ตารางของกระแสหลักและการกำหนด:
ส่วนการชำระบัญชี
. การสร้างสมดุลของวัสดุ
การสร้างสมดุลของวัสดุเป็นหนึ่งในประเด็นหลักในการคำนวณกระบวนการทางเทคโนโลยี สาระสำคัญของมันอยู่ในกฎการอนุรักษ์มวล (ขาเข้า-ขาออก=0). ต้องขอบคุณสูตรสมการ mat เครื่องชั่ง คุณสามารถใช้งานกับตัวบ่งชี้กระบวนการต่างๆ (ความเข้มข้น การไหลของมวล ฯลฯ) เพื่อปรับกระบวนการให้เหมาะสม
คุณควรเริ่มรวบรวมงบดุลด้วยไดอะแกรมแบบง่ายในรูปแบบของบล็อก แต่ละบล็อกจะรวมหน้าที่หลัก - การผสม ออกซิเดชัน หรือการกระจาย สำหรับกระบวนการนี้ ผังงานจะมีลักษณะดังนี้ (องค์ประกอบของโฟลว์ระบุไว้ในตารางด้านบน):
จะเห็นได้ว่ารูปแบบเทคโนโลยีแบ่งออกเป็นสี่กลุ่มหลัก:
1) หน่วยผสม
)หน่วยออกซิเดชัน (ตรงคอลัมน์ฟองเอง)
)บล็อกแยก (คอลัมน์กลั่นแรกซึ่งกำจัดสารระเหยและก๊าซไอเสีย)
)กลุ่มของการแยกและการส่งคืนวัตถุดิบที่ไม่ทำปฏิกิริยาไปยังกลุ่มแรก
ในบล็อกที่สอง มวลจะถูกกระจายใหม่เนื่องจากการเปลี่ยนแปลงทางเคมีตามปฏิกิริยาหลัก:
CH 3CHO + 0.5O 2 = CH 3UNSD
และสำหรับสองคน อาการไม่พึงประสงค์การก่อตัวของเมทิลอะซิเตตและเอทิลลิดีนไดอะซิเตตตามลำดับ:
CH 3CHO + 1.5O 2= CH 3SOOSH 3+ CO2 + โฮ 2โอ
CH 3CHO + โอ 2= CH 3CH(OOCH .) 3)2+ โฮ 2โอ
ขึ้นอยู่กับผลผลิตที่กำหนดสำหรับผลิตภัณฑ์และการเลือกและระดับการแปลงสำหรับอะซีตัลดีไฮด์ ปริมาณของเอทานอลที่ต้องการสามารถคำนวณได้โดยใช้สมการพื้นฐาน:
โดยที่ N คือจำนวนโมลของอะซีตัลดีไฮด์ดั้งเดิมที่จำเป็นในการเข้าสู่เครื่องปฏิกรณ์เครื่องแรก M คือมวลโมลาร์ของผลิตภัณฑ์ (กรดอะซิติก); a และ c คือสัมประสิทธิ์ปริมาณสัมพันธ์ของสารตั้งต้นและผลิตภัณฑ์
ดังนั้นบล็อกที่ 1 ควรได้รับอะซีตัลดีไฮด์ 31.6265 กม. ควรสังเกตว่าอะซีตัลดีไฮด์เข้าสู่ทั้งบริสุทธิ์ (ดั้งเดิม) และย้อนกลับ (หลังจากบล็อกที่สี่) ผ่านการหมุนเวียน การไหลของมวลคือ:
เรายังคำนวณปริมาณของผลิตภัณฑ์พลอยได้ที่เกิดขึ้น:
ก) เมทิลอะซิเตท:
b) เอทิลลิดีนไดอะซิเตต:
โดยที่ปัจจัยการแปลง 0.5 และ 0.33 (โดยคำนึงถึงปริมาณสัมพันธ์ของปฏิกิริยา) คำนวณปริมาณออกซิเจนที่จำเป็นสำหรับปฏิกิริยา
ออกซิเจนทางเทคนิคประกอบด้วยไนโตรเจนเล็กน้อย (2.5%) ซึ่งควรคำนึงถึง:
อัลดีไฮด์ที่ไม่ทำปฏิกิริยา:
ปริมาณก๊าซคาร์บอนไดออกไซด์ที่ผลิตได้:
เกิดเป็นน้ำ โดยปฏิกิริยา:
โปรดทราบว่าน้ำยังมาพร้อมกับวัตถุดิบด้วย
อัลดีไฮด์ (สู่บรรยากาศ):
อัลดีไฮด์ (ในบล็อกที่ 4):
เนื่องจากอัลดีไฮด์ทั้งหมดที่ส่งผ่านไปยังบล็อก 4 จากนั้นกลับไปที่บล็อก 1 จึงเป็นไปได้ที่จะคำนวณปริมาณของอัลดีไฮด์สดที่เข้าสู่บล็อกแรกสำหรับการผสม:
เช่นเดียวกับปริมาณของสิ่งสกปรก (กรดอะซิติกและน้ำ) ในอัลดีไฮด์สด:
ปริมาณน้ำทั้งหมด (โดยปฏิกิริยาและกับอัลดีไฮด์สด) คือ:
กรดอะซิติกเกิดขึ้นจากปฏิกิริยาและเมื่อเข้าสู่อัลดีไฮด์สด:
ส่วนหนึ่งของน้ำจะถูกลบออกพร้อมกับกรดอะซิติก (0.2% โดยน้ำหนัก):
ความสมดุลของน้ำถูกรวบรวมดังนี้: เกิดขึ้นจากปฏิกิริยา + กับอัลดีไฮด์สด - กับกรด - สู่บรรยากาศ = 0 จากนั้น:
เพื่อความสะดวก ค่าที่คำนวณทั้งหมดจะถูกสรุปในตารางการไหลและตารางดุลวัสดุ
*หมายเหตุ #1: เมทิลอะซิเตทมีจุดเดือด 57°C และมีความผันผวนสูง ดังนั้นจึงถูกกำจัดออกด้วยก๊าซไอเสีย เช่น ในบล็อกที่สาม (คอลัมน์กลั่นแรก)
*หมายเหตุ #2: นอกจากนี้ ควรพิจารณาด้วยว่ามีกรดอะซิติก (เป็นตัวทำละลาย) ในปริมาณคงที่ในคอลัมน์ และนำอะซีตัลดีไฮด์กลับมาใช้ใหม่
บทสรุป
กรด aldehyde ethanal
โดยสรุปควรสังเกตว่าวิธีนี้เป็นวิธีหลักในการผลิตกรดอะซิติก เมื่อเร็ว ๆ นี้ มีการเปลี่ยนวิธี Kolbe (คาร์บอกซิเลชันของเมทิลแอลกอฮอล์) มากขึ้นเรื่อยๆ ซึ่งให้ผลผลิตรีเอเจนต์เริ่มต้นสูงขึ้น
วิธีการนี้ก็มีข้อเสียเช่นกัน เช่น การปล่อยสารอะซีตัลดีไฮด์ที่ไม่ทำปฏิกิริยาและเมทิลอะซิเตตออกสู่บรรยากาศ การใช้งาน ความดันโลหิตสูงการก่อตัวของผลพลอยได้ ฯลฯ
อย่างไรก็ตาม ประมาณ 50% ของกรดอะซิติกทั้งหมดที่ผลิตในโลกนั้นได้มาด้วยวิธีนี้ โดยใช้แมงกานีส (II) อะซิเตตเป็นตัวเร่งปฏิกิริยา โดยทั่วไป วิธีนี้เป็นวิธีที่สะดวกและได้เปรียบที่สุดวิธีหนึ่งสำหรับเทคโนโลยี
กรดอะซิติกเป็นวัตถุดิบที่นิยมใช้กันมากที่สุดแห่งหนึ่ง และเป็นที่ต้องการอย่างมากในอุตสาหกรรมอาหารและเคมี
รายชื่อวรรณกรรมที่ใช้แล้ว
1) "ปัจจัยด้านสิ่งแวดล้อมหรือ สิ่งแวดล้อมเพื่อกระตุ้นวิวัฒนาการของเคมีอุตสาหกรรม" โรเจอร์ เอ. เชลดอน
) "เคมีอินทรีย์". Morrison R., Boyd R. 1974
) "กลไกปฏิกิริยาในเคมีอินทรีย์". Sykes P., 1991
) "การรวบรวมการมอบหมายและแนวทางในการคำนวณความสมดุลของวัสดุของอุตสาหกรรมเคมีและเทคโนโลยี" MITHT 2008
วรรณกรรมเพิ่มเติม:
5) "หลักสูตรทั่วไปของกระบวนการและอุปกรณ์ของเทคโนโลยีเคมี" Einstein V.G., Zakharov M.K., 1999
) "หนังสืออ้างอิงโดยย่อเกี่ยวกับปริมาณทางกายภาพและเคมี" Ravdel A.A., 1999
) "แบบแผนของกระบวนการทางเคมีและเทคโนโลยี". Nosov G.A. , Vyshnepolsky V.I. , Lapshenkov G.I. , 2011
ความยาวและระยะทาง มวล การวัดปริมาตรของผลิตภัณฑ์จำนวนมากและอาหาร พื้นที่ ปริมาณและหน่วยของการวัดใน สูตรอาหารความดันอุณหภูมิ ความเค้นทางกล โมดูลัสของ Young พลังงานและการทำงาน กำลังแรง เวลา เชิงเส้น ความเร็ว มุมแบน ประสิทธิภาพเชิงความร้อนและประสิทธิภาพการใช้เชื้อเพลิง ตัวเลข หน่วยของการวัดปริมาณข้อมูล อัตราแลกเปลี่ยน ขนาดของเสื้อผ้าและรองเท้าของผู้หญิง ขนาดของเสื้อผ้าและรองเท้าของผู้ชาย ความเร็วเชิงมุมและการหมุน ความถี่ ความเร่ง ความเร่งเชิงมุม ความหนาแน่น ปริมาตรจำเพาะ โมเมนต์ของความเฉื่อย โมเมนต์ของแรง แรงบิด ค่าความร้อนจำเพาะ (โดยมวล) ความหนาแน่นของพลังงานและค่าความร้อนจำเพาะของเชื้อเพลิง (โดยปริมาตร) ความแตกต่างของอุณหภูมิ พลังงานรังสี ความหนาแน่นของฟลักซ์ความร้อน ค่าสัมประสิทธิ์การถ่ายเทความร้อน ปริมาตร การไหลของมวล อัตราการไหลของโมลาร์ ความหนาแน่นของการไหลของมวล ความเข้มข้นของโมลาร์ ความเข้มข้นของมวลในสารละลาย ความหนืดไดนามิก (สัมบูรณ์) ความหนืดจลนศาสตร์ การซึมผ่าน อัตราการถ่ายโอนไอ ระดับเสียง ความไวของไมโครโฟน ระดับความดันเสียง (SPL) ความสว่าง ความเข้มของการส่องสว่าง ความสว่าง ความละเอียดในคอมพิวเตอร์กราฟิก ความถี่และความยาวคลื่น พลังงานแสงในไดออปเตอร์และทางยาวโฟกัส กำลังในไดออปเตอร์และกำลังขยายของเลนส์ (×) ประจุไฟฟ้า ความหนาแน่นของประจุเชิงเส้น ความหนาแน่นของประจุที่พื้นผิว ความหนาแน่นของประจุจำนวนมาก ไฟฟ้าความหนาแน่นกระแสเชิงเส้น ความหนาแน่นกระแสพื้นผิว ความแรงของสนามไฟฟ้า ศักย์ไฟฟ้าและแรงดันไฟ ความต้านทานไฟฟ้า ความต้านทานไฟฟ้า การนำไฟฟ้า การนำไฟฟ้า ความจุไฟฟ้า ตัวเหนี่ยวนำ มาตรวัดลวดแบบอเมริกัน ระดับเป็น dBm (dBm หรือ dBmW), dBV (dBV), วัตต์ ฯลฯ หน่วย แรงแม่เหล็ก สนามแม่เหล็ก ความแรง ฟลักซ์แม่เหล็ก การเหนี่ยวนำแม่เหล็ก อัตราการดูดซึมของรังสีไอออไนซ์ กัมมันตภาพรังสี. การสลายตัวของกัมมันตภาพรังสี ปริมาณรังสีที่ได้รับ ปริมาณดูดซับ คำนำหน้าทศนิยม การส่งข้อมูล การพิมพ์และการประมวลผลภาพ หน่วยปริมาตรไม้ การคำนวณมวลโมลาร์ ระบบธาตุเคมีของ D. I. Mendeleev เป็นระยะ
สูตรเคมี
มวลโมลาร์ของ CH 3 COOH, กรดอะซิติก 60.05196 กรัม/โมล
12.0107+1.00794 3+12.0107+15.9994+15.9994+1.00794
เศษส่วนมวลของธาตุในสารประกอบ
การใช้เครื่องคำนวณมวลกราม
- ต้องป้อนสูตรทางเคมีตัวพิมพ์เล็กและตัวพิมพ์ใหญ่
- ดัชนีถูกป้อนเป็นตัวเลขปกติ
- จุดบนเส้นกึ่งกลาง (เครื่องหมายคูณ) ที่ใช้ ตัวอย่างเช่น ในสูตรของผลึกไฮเดรต จะถูกแทนที่ด้วยจุดปกติ
- ตัวอย่าง: แทนที่จะใช้ CuSO₄ 5H₂O ตัวแปลงจะใช้การสะกด CuSO4.5H2O เพื่อความสะดวกในการป้อนข้อมูล
เครื่องคำนวณมวลกราม
ตุ่น
สารทั้งหมดประกอบด้วยอะตอมและโมเลกุล ในวิชาเคมี การวัดมวลของสารที่เข้าสู่ปฏิกิริยาและเป็นผลมาจากปฏิกิริยานั้นอย่างแม่นยำเป็นสิ่งสำคัญ ตามคำจำกัดความ โมลคือปริมาณของสารที่มีองค์ประกอบโครงสร้างมากมาย (อะตอม โมเลกุล ไอออน อิเล็กตรอน และอนุภาคอื่นๆ หรือกลุ่มของสารดังกล่าว) เนื่องจากมีอะตอมในไอโซโทปคาร์บอน 12 กรัมที่มีมวลอะตอมสัมพัทธ์เท่ากับ 12 . ตัวเลขนี้เรียกว่าค่าคงที่หรือตัวเลข Avogadro เท่ากับ 6.02214129(27)×10²³ mol⁻¹
หมายเลข Avogadro N A = 6.02214129(27)×10²³ mol⁻¹
กล่าวอีกนัยหนึ่ง โมล คือปริมาณของสารที่มีมวลเท่ากับผลรวมของมวลอะตอมของอะตอมและโมเลกุลของสาร คูณด้วยเลขอโวกาโดร โมลเป็นหนึ่งในเจ็ดหน่วยพื้นฐานของระบบ SI และแสดงโดยโมล เนื่องจากชื่อหน่วยและสัญลักษณ์เหมือนกันจึงควรสังเกตว่าสัญลักษณ์ไม่ผันแปรเหมือนชื่อหน่วยซึ่งสามารถปฏิเสธได้ตาม กฎปกติภาษารัสเซีย. ตามคำนิยาม คาร์บอน-12 บริสุทธิ์ 1 โมล เท่ากับ 12 กรัมพอดี
มวลกราม
มวลโมลาร์เป็นสมบัติทางกายภาพของสาร ซึ่งกำหนดเป็นอัตราส่วนของมวลของสารนั้นต่อปริมาณของสารในหน่วยโมล มันคือมวลของสารหนึ่งโมล ในระบบ SI หน่วยของมวลโมลาร์คือกิโลกรัม/โมล (กก./โมล) อย่างไรก็ตาม นักเคมีคุ้นเคยกับการใช้หน่วย g/mol ที่สะดวกกว่า
มวลโมลาร์ = g/mol

มวลโมลของธาตุและสารประกอบ
สารประกอบคือสารที่ประกอบด้วยอะตอมที่แตกต่างกันซึ่งมีพันธะเคมีซึ่งกันและกัน ตัวอย่างเช่นสารต่อไปนี้ซึ่งสามารถพบได้ในครัวของแม่บ้านทุกคนคือสารประกอบทางเคมี:
- เกลือ (โซเดียมคลอไรด์) NaCl
- น้ำตาล (ซูโครส) C₁₂H₂₂O₁₁
- น้ำส้มสายชู (สารละลายกรดอะซิติก) CH₃COOH
มวลโมลาร์ขององค์ประกอบทางเคมีเป็นกรัมต่อโมลเป็นตัวเลขเท่ากับมวลของอะตอมของธาตุที่แสดงเป็นหน่วยมวลอะตอม (หรือดัลตัน) มวลโมลาร์ของสารประกอบเท่ากับผลรวมของมวลโมลาร์ของธาตุที่ประกอบเป็นสารประกอบ โดยคำนึงถึงจำนวนอะตอมในสารประกอบ ตัวอย่างเช่น มวลโมลาร์ของน้ำ (H₂O) มีค่าประมาณ 2 × 2 + 16 = 18 ก./โมล
มวลโมเลกุล

น้ำหนักโมเลกุล (ชื่อเดิมคือ น้ำหนักโมเลกุล) คือมวลของโมเลกุล ซึ่งคำนวณเป็นผลรวมของมวลของแต่ละอะตอมที่ประกอบเป็นโมเลกุล คูณด้วยจำนวนอะตอมในโมเลกุลนี้ น้ำหนักโมเลกุลเท่ากับ ไร้มิติ ปริมาณทางกายภาพ, ตัวเลขเท่ากับมวลโมลาร์ นั่นคือ, มวลโมเลกุลแตกต่างจากมวลโมลาร์ในมิติ แม้ว่าน้ำหนักโมเลกุลจะเป็นปริมาณที่ไม่มีมิติ แต่ก็ยังมีปริมาณที่เรียกว่าหน่วยมวลอะตอม (a.m.u.) หรือดาลตัน (Da) และมีค่าประมาณ เท่ากับมวลโปรตอนหรือนิวตรอนหนึ่งตัว หน่วยมวลอะตอมยังเป็นตัวเลขเท่ากับ 1 กรัม/โมล
บทความที่คล้ายกัน
-
อังกฤษ - นาฬิกา เวลา
ทุกคนที่สนใจเรียนภาษาอังกฤษต้องเจอกับการเรียกชื่อแปลกๆ น. เมตร และก. m และโดยทั่วไป ไม่ว่าจะกล่าวถึงเวลาใดก็ตาม ด้วยเหตุผลบางอย่างจึงใช้รูปแบบ 12 ชั่วโมงเท่านั้น คงจะเป็นการใช้ชีวิตของเรา...
-
"การเล่นแร่แปรธาตุบนกระดาษ": สูตร
Doodle Alchemy หรือ Alchemy บนกระดาษสำหรับ Android เป็นเกมไขปริศนาที่น่าสนใจพร้อมกราฟิกและเอฟเฟกต์ที่สวยงาม เรียนรู้วิธีเล่นเกมที่น่าตื่นตาตื่นใจนี้และค้นหาการผสมผสานขององค์ประกอบต่างๆ เพื่อทำให้การเล่นแร่แปรธาตุบนกระดาษสมบูรณ์ เกม...
-
เกมล่มใน Batman: Arkham City?
หากคุณต้องเผชิญกับความจริงที่ว่า Batman: Arkham City ช้าลง พัง Batman: Arkham City ไม่เริ่มทำงาน Batman: Arkham City ไม่ติดตั้ง ไม่มีการควบคุมใน Batman: Arkham City ไม่มีเสียง ข้อผิดพลาดปรากฏขึ้น ขึ้นในแบทแมน:...
-
วิธีหย่านมคนจากเครื่องสล็อต วิธีหย่านมคนจากการพนัน
ร่วมกับนักจิตอายุรเวทที่คลินิก Rehab Family ในมอสโกและผู้เชี่ยวชาญด้านการรักษาผู้ติดการพนัน Roman Gerasimov เจ้ามือรับแทงจัดอันดับติดตามเส้นทางของนักพนันในการเดิมพันกีฬา - จากการก่อตัวของการเสพติดไปจนถึงการไปพบแพทย์...
-
Rebuses ปริศนาที่สนุกสนาน ปริศนา ปริศนา
เกม "Riddles Charades Rebuses": คำตอบของส่วน "RIDDLES" ระดับ 1 และ 2 ● ไม่ใช่หนู ไม่ใช่นก - มันสนุกสนานในป่า อาศัยอยู่บนต้นไม้และแทะถั่ว ● สามตา - สามคำสั่ง แดง - อันตรายที่สุด ระดับ 3 และ 4 ● สองเสาอากาศต่อ...
-
เงื่อนไขการรับเงินสำหรับพิษ
เงินเข้าบัญชีบัตร SBERBANK ไปเท่าไหร่ พารามิเตอร์ที่สำคัญของธุรกรรมการชำระเงินคือข้อกำหนดและอัตราสำหรับการให้เครดิตเงิน เกณฑ์เหล่านี้ขึ้นอยู่กับวิธีการแปลที่เลือกเป็นหลัก เงื่อนไขการโอนเงินระหว่างบัญชีมีอะไรบ้าง
