Το μοριακό βάρος του οξικού οξέος είναι ίσο με. Χημεία: Οξικό οξύ, Περίληψη
Πρόγραμμα μαθημάτων για OHT
"Βιομηχανική μέθοδος για την παραγωγή οξικού οξέος"
Εισαγωγή
Οξεικό (αιθανοϊκό) οξύ είναι μια οργανική ουσία με μοριακό τύπο CH 3COOH (συντομογραφία AcOH). Είναι ένα εξαιρετικά ασθενές μονοβασικό οξύ. Τα άλατα του οξικού οξέος και οι εστέρες του ονομάζονται οξικά .
Ξύδι (διάλυμα οξικού οξέος) είναι γνωστό από την αρχαιότητα ως προϊόν ζύμωσης. Στην αρχαιότητα (περ. 3ος αιώνας π.Χ.), το ξύδι χρησιμοποιήθηκε για την παραγωγή λευκού μολύβδου. Επί του παρόντος, το οξικό οξύ έχει τρεις κύριες χρήσεις: πρώτον, ως διαλύτης για ορισμένες οργανικές συνθέσεις, δεύτερον, ως ασθενώς όξινο αντιδραστήριο (για την απόσβεση των βασικών προϊόντων που προκύπτουν κ.λπ.), και τέλος, τρίτον, για την παραγωγή σημαντικών παραγώγων όπως ως χλωριούχο οξύ ή οξικός ανυδρίτης , όπως και αυτή αμίδιο και ούτω καθεξής. Το χλωριούχο οξύ και ο οξικός ανυδρίτης είναι σημαντικοί παράγοντες ακυλίωσης που χρησιμοποιούνται συχνά οργανική σύνθεση.
Τα διαλύματα οξικού οξέος που χρησιμοποιούνται στη βιομηχανία τροφίμων (καθώς και στην οικιακή μαγειρική και το τουρσί) έχουν ονόματα ξύδι (3-15%) και απόσταγμα ξυδιού (70-80%). Απόλυτο οξικό οξύ (περίπου 99,8%) ονομάζεται πάγος , γιατί όταν παγώσει, σχηματίζει μια μάζα που μοιάζει με πάγο.
Οι όγκοι παραγωγής οξικού οξέος είναι περίπου 5 εκατομμύρια τόνοι/έτος, με περίπου το 50% να παράγεται με τη μέθοδο Kolbe (βλ. παρακάτω).
. Φυσικοχημικές ιδιότητες
Στο αρ. Το οξικό οξύ είναι ένα άχρωμο υγρό με εξαιρετικά πικάντικη οσμή. Ο παρακάτω πίνακας συνοψίζει τις κύριες φυσικές σταθερές του οξικού οξέος.
Μ r , g/molp, g/cm 3λιώστε., Ο STkip., Ο SKrit. pointResin, J/mol*KDN Ο , kJ/molrKan60.051.049216.75118.1321.6 Ο Από 5,79 MPa123,4-4874,761,372
Οξικό οξύαμφίβολο σε σχέση με τους διαλύτες, επειδή περιέχει μια πολική ομάδα (-COOH) και μια μη πολική ομάδα (-CH 3). Έτσι, είναι εξαιρετικά διαλυτό στο νερό και σε ορισμένους οργανικούς διαλύτες. Σχηματίζει επίσης διπλά και τριπλά αζεότροπα του τύπου οξικό οξύ-νερό-οργανικός διαλύτης.
Το οξικό οξύ είναι ένα ασθενές οργανικό οξύ. Είναι ικανό να αντιδρά με ενεργά μέταλλα για να απελευθερώσει υδρογόνο:
Μετασχηματισμός σε παράγωγα οξέος υπό τη δράση κατάλληλων αντιδραστηρίων (σημαντικές αντιδράσεις στην οργανική σύνθεση):
α) σε αλογονίδια οξέος
β) σε εστέρες
γ) σε αμίδια
Ανασύσταση σε αιθυλική αλκοόλη:
Και επίσης συμμετέχετε σε αντιδράσεις υποκατάστασης στην ομάδα μεθυλίου, από τις οποίες η πιο σημαντική είναι η αντίδραση Gel-Volhard-Zelinsky, η οποία χρησιμοποιείται για τη λήψη του σημαντικού αμινοξέος γλυκίνη:
Επιπλέον, με κάθε επόμενη υποκατάσταση, λόγω της επαγωγικής δράσης του αλογόνου, η ισχύς του οξέος αυξάνεται. Για παράδειγμα, το τριφθοροξικό οξύ είναι κοντά σε ισχύ με τα ανόργανα οξέα.
. Μέθοδοι απόκτησης
Το πιο κερδοφόρο και προφανές χημική μέθοδοςΗ παραγωγή οξικού οξέος περιλαμβάνει την οξείδωση της αντίστοιχης αλδεΰδης ( οξική αλδείνη ή αιθανάλη ), το οποίο, με τη σειρά του, λαμβάνεται με έναν από τους δύο τρόπους: ενυδάτωση ασετυλίνη παρουσία αλάτων υδραργύρου (II) (αντίδραση Chugaev) ή με οξείδωση (αφυδρογόνωση) αιθυλικό οινόπνευμα πάνω από ζεστό χαλκό:
Η ίδια η ακεταλδεΰδη οξειδώνεται εύκολα από το ατμοσφαιρικό οξυγόνο και αργά μετατρέπεται σε οξικό οξύ.
Η πρώτη μέθοδος παραγωγής αιθανάλης χρησιμοποιώντας την αντίδραση Chugaev δεν είναι κερδοφόρα για πολλούς λόγους, συμπεριλαμβανομένης της εργασίας με εκρηκτική ακετυλίνη, της μόλυνσης του προϊόντος με τοξικά άλατα υδραργύρου, των μεγάλων όγκων αντιδραστήρα κ.λπ. Η πιο διαδεδομένη είναι η δεύτερη μέθοδος παραγωγής από αιθυλική αλκοόλη (η οποία παράγεται σε τεράστιες ποσότητες και είναι σχετικά φθηνή).
Η προκύπτουσα ακεταλδεΰδη οξειδώνεται με οξυγόνο παρουσία καταλύτη - αλάτων μαγγανίου (II). Αυτή η μέθοδος θα εξεταστεί περαιτέρω.
Μια πιο σύγχρονη μέθοδος είναι η καταλυτική καρβονυλίωση της μεθανόλης (μέθοδος Kolbe) σύμφωνα με την αντίδραση:
Αυτή η μέθοδος καθιστά δυνατή την επίτευξη αποδόσεων περίπου 99% για μεθανόλη και 90% για CO. Αποτελείται από φυσαλίδες μονοξειδίου του άνθρακα σε θερμοκρασία 180°C και πιέσεις 200-700 atm μέσω ενός μείγματος αντιδραστηρίων. Οι καταλύτες είναι ιωδιούχα κοβάλτιο ή ρόδιο, και επίσης, λιγότερο συχνά, ενώσεις ιριδίου. Επί αυτή τη στιγμήΑυτή η μέθοδος παράγει περίπου το 50% του συνόλου του οξικού οξέος που παράγεται στον κόσμο.
Υπάρχουν επίσης βιοχημικές μεθόδους(δηλαδή μέσω της ζύμωσης των σακχάρων), ωστόσο, χρησιμοποιούνται σπάνια, κυρίως λόγω της χαμηλής παραγωγικότητάς τους και της δυσκολίας διαχωρισμού του προκύπτοντος μείγματος προϊόντων.
. Αιτιολόγηση για την επιλογή τεχνολογικής διεργασίας με μέθοδο οξείδωσης αιθανάλης
Αυτή η μέθοδοςέχει μια σειρά από θετικά χαρακτηριστικά, όπως:
)Φθηνά αντιδραστήρια εκκίνησης
)Υψηλή απόδοση
)Σχετικά χαμηλό ενεργειακό κόστος (50-60 o ΜΕ)
)Υψηλές αποδόσεις από αντιδραστήρια εκκίνησης
)Υψηλός βαθμός μετατροπής και επιλεκτικότητας της διαδικασίας
)Σχετικά απλός διαχωρισμός μείγματος
Η αντίδραση διεξάγεται σε στήλη τύπου φυσαλίδων. Πυρετόςαπαραίτητο για την πρόληψη της παράπλευρης αντίδρασης του σχηματισμού υπεροξειδίων (που μπορεί να οδηγήσει στο σχηματισμό εκρηκτικού μείγματος). Το ανώτερο όριο θερμοκρασίας καθορίζεται από την πτητότητα της ακεταλδεΰδης. Το οξικό οξύ δεν είναι μόνο προϊόν αντίδρασης, αλλά και διαλύτης, που απλοποιεί σημαντικά τη διαδικασία.
Οι κύριοι τεχνολογικοί δείκτες της διαδικασίας συνοψίζονται στον παρακάτω πίνακα:
. Διάγραμμα ροής διαδικασίας
Παρακάτω είναι ένα απλοποιημένο διάγραμμα ροής διεργασίας για την παραγωγή οξικού οξέος με την οξείδωση της ακεταλδεΰδης. Οι ονομασίες που φαίνονται στο διάγραμμα συνοψίζονται σε πίνακες.
Το αρχικό μίγμα (Ι) εισέρχεται στον εναλλάκτη θερμότητας (1), όπου θερμαίνεται στη θερμοκρασία αντίδρασης (50-80 °C). Η θέρμανση παράγεται με θέρμανση ατμού (IX), ο οποίος στη συνέχεια απομακρύνεται από τον χώρο μεταξύ των σωλήνων με τη μορφή συμπυκνώματος (Χ). Η αλδεΰδη τροφοδοτείται από φυγόκεντρες αντλίες (5) και ρυθμίζεται με βαλβίδες.
Η θερμαινόμενη αλδεΰδη εισέρχεται σε μια στήλη με φυσαλίδες (2) εξοπλισμένη με ψύκτες πηνίου (η αντίδραση είναι εξώθερμη). Το τεχνικό οξυγόνο (II) διοχετεύεται στη στήλη και αρχίζει η οξείδωση της αλδεΰδης.
Τα προκύπτοντα προϊόντα με τη μορφή μίγματος ατμού-υγρού εκκενώνονται μέσω της κορυφής της στήλης και εισέρχονται στον διανομέα (4), μετά τον οποίο μέρος της μάζας της αντίδρασης εισέρχεται στην πρώτη στήλη απόσταξης (3), που προορίζεται για καθαρισμό από πτητικές ακαθαρσίες (καυσαέρια - VII). Στη συνέχεια, το υπόλοιπο της μάζας της αντίδρασης (IV) εισέρχεται στη δεύτερη στήλη, όπου το προκύπτον οξικό οξύ (V) μεταφέρεται στον καταναλωτή ή σε μια αποθήκη. Το υπόλειμμα πυθμένα (VI), που περιέχει διοξικό αιθυλιδένιο, αφαιρείται επίσης από τη στήλη. Η ακεταλδεΰδη που δεν αντέδρασε (VIII) επιστρέφεται στη στήλη των φυσαλίδων, μειώνοντας έτσι την ποσότητα αλδεΰδης που αρχικά απαιτείται για να εξασφαλιστεί μια δεδομένη παραγωγικότητα (αύξηση της μετατροπής τροφοδοσίας). .
Πίνακες βασικών ροών και σημειώσεων:
Μέρος υπολογισμού
. Συλλογή ισορροπία υλικού
Η κατάρτιση ισοζυγίου υλικών είναι ένα από τα κύρια σημεία στον υπολογισμό των τεχνολογικών διαδικασιών. Η ουσία του βρίσκεται στον νόμο της διατήρησης της μάζας (Ερχόμενος-Αναχωρώντας = 0). Χάρη στη συλλογή μαθηματικών εξισώσεων. Η ισορροπία μπορεί να λειτουργήσει με διάφορους δείκτες διαδικασίας (συγκεντρώσεις, ροές μάζας κ.λπ.) για τη βελτιστοποίηση της διαδικασίας.
Θα πρέπει να αρχίσετε να συντάσσετε έναν ισολογισμό με ένα απλοποιημένο διάγραμμα με τη μορφή μπλοκ. Κάθε ένα από τα μπλοκ θα περιλαμβάνει μια κύρια λειτουργία - ανάμειξη, οξείδωση ή διανομή. Για αυτήν τη διαδικασία, το διάγραμμα ροής θα μοιάζει με αυτό (η σύνθεση των ροών υποδεικνύεται στον παραπάνω πίνακα):
Έτσι, μπορεί να φανεί ότι το τεχνολογικό σχήμα χωρίζεται σε τέσσερα κύρια τμήματα:
1) Μπλοκ ανάμιξης.
)Μονάδα οξείδωσης (η ίδια η στήλη φυσαλίδων).
)Μονάδα διαχωρισμού (η πρώτη στήλη απόσταξης από την οποία αφαιρούνται πολύ πτητικές ουσίες και καυσαέρια).
)Μπλοκ για διαχωρισμό και επιστροφή πρώτων υλών που δεν έχουν αντιδράσει στο πρώτο μπλοκ.
Στο δεύτερο μπλοκ, η ανακατανομή μάζας συμβαίνει λόγω χημικών μετασχηματισμών σύμφωνα με την κύρια αντίδραση:
CH 3CHO + 0,5Ο 2 = CH 3UNS
Και σε δύο ανεπιθύμητες αντιδράσειςσχηματισμός οξικού μεθυλεστέρα και διοξικού αιθυλιδενίου, αντίστοιχα:
CH 3CHO + 1,5Ο 2= CH 3SOOSN 3+ CO2 + Ν 2ΓΙΑ
CH 3CHO + O 2= CH 3CH(OOSSN 3)2+ Ν 2ΓΙΑ
Με βάση τη δεδομένη παραγωγικότητα και επιλεκτικότητα του προϊόντος και τον βαθμό μετατροπής για την ακεταλδεΰδη, η απαιτούμενη ποσότητα αιθανάλης μπορεί να υπολογιστεί χρησιμοποιώντας τη βασική εξίσωση:
όπου N είναι ο αριθμός των γραμμομορίων αρχικής ακεταλδεΰδης που απαιτούνται για την είσοδο στον πρώτο αντιδραστήρα. Μ είναι η μοριακή μάζα του προϊόντος (οξικό οξύ). a και c είναι οι στοιχειομετρικοί συντελεστές του αντιδραστηρίου και του προϊόντος,
Επομένως, 31,6265 kmol ακεταλδεΰδης θα πρέπει να εισέλθουν στο μπλοκ 1. Πρέπει να σημειωθεί ότι η ακεταλδεΰδη εισέρχεται τόσο καθαρή (αρχική) όσο και αντίστροφη (μετά το τέταρτο μπλοκ) μέσω της ανακύκλωσης. Η μαζική ροή είναι:
Ας υπολογίσουμε επίσης τις ποσότητες των παραπροϊόντων που σχηματίστηκαν:
α) οξικός μεθυλεστέρας:
β) διοξικό αιθυλιδένιο:
Όπου 0,5 και 0,33 είναι συντελεστές μετατροπής (λαμβάνοντας υπόψη τη στοιχειομετρία της αντίδρασης). Ας υπολογίσουμε την ποσότητα οξυγόνου που απαιτείται για την αντίδραση (λαμβάνοντας υπόψη τη μετατροπή της, δηλαδή τη μη πλήρη μετατροπή):
Το τεχνικό οξυγόνο περιέχει μικρή ποσότητα αζώτου (2,5%), η οποία πρέπει να λαμβάνεται υπόψη:
Αλδεΰδη που δεν αντέδρασε:
Ποσότητα παραγόμενου διοξειδίου του άνθρακα:
Σχηματίστηκε νερό από αντιδράσεις:
Θα πρέπει να ληφθεί υπόψη ότι μαζί με την πρώτη ύλη έρχεται και νερό.
Αλδεΰδη (προς ατμόσφαιρα):
Αλδεΰδη (στο 4ο μπλοκ):
Εφόσον όλη η αλδεΰδη που πηγαίνει στο μπλοκ 4 επιστρέφει στη συνέχεια στο μπλοκ 1, μπορούμε τώρα να υπολογίσουμε την ποσότητα φρέσκιας αλδεΰδης που εισέρχεται στο μπλοκ 1 για ανάμειξη:
Και επίσης η ποσότητα των ακαθαρσιών (οξικό οξύ και νερό) σε φρέσκια αλδεΰδη:
Η συνολική ποσότητα νερού (από την αντίδραση και με φρέσκια αλδεΰδη) είναι:
Το οξικό οξύ σχηματίζεται ως αποτέλεσμα της αντίδρασης και όταν παρέχεται με φρέσκια αλδεΰδη:
Μέρος του νερού αφαιρείται μαζί με οξικό οξύ (0,2% κατά βάρος):
Το ισοζύγιο νερού καταρτίζεται ως εξής: σχηματίζεται με αντίδραση + με φρέσκια αλδεΰδη - με οξύ - στην ατμόσφαιρα = 0. Στη συνέχεια:
Για ευκολία, όλες οι υπολογισμένες τιμές συνοψίζονται σε έναν πίνακα ροής και έναν πίνακα ισοζυγίου υλικού.
*Σημείωση Νο 1: ο οξικός μεθυλεστέρας έχει σημείο βρασμού 57 oC και είναι πολύ πτητική ουσία, άρα απομακρύνεται με καυσαέρια, δηλ. στο τρίτο μπλοκ (πρώτη στήλη απόσταξης).
*Σημείωση #2: Θα πρέπει επίσης να ληφθεί υπόψη ότι υπάρχει σταθερή ποσότητα οξικού οξέος (ως διαλύτης) στη στήλη, και ακεταλδεΰδης που ανακυκλοφορεί.
Σύναψη
όξινη αλδεΰδη αιθανάλη
Συμπερασματικά, θα πρέπει να σημειωθεί ότι αυτή η μέθοδος είναι πρακτικά η κύρια στην παραγωγή οξικού οξέος. Πρόσφατα, έχει αντικατασταθεί όλο και περισσότερο από τη μέθοδο Kolbe (καρβοξυλίωση μεθυλικής αλκοόλης), η οποία δίνει υψηλότερες αποδόσεις από τα αρχικά αντιδραστήρια.
Αυτή η μέθοδος έχει επίσης μειονεκτήματα, όπως, για παράδειγμα, η απελευθέρωση ακεταλδεΰδης και οξικού μεθυλεστέρα που δεν αντέδρασε στην ατμόσφαιρα, η χρήση υψηλή αρτηριακή πίεση, σχηματισμός υποπροϊόντων κ.λπ.
Ωστόσο, περίπου το 50% του συνόλου του οξικού οξέος που παράγεται στον κόσμο λαμβάνεται με αυτόν τον τρόπο, χρησιμοποιώντας οξικό μαγγάνιο (II) ως καταλύτη. Γενικά, αυτή η μέθοδος είναι από τις πιο βολικές και ωφέλιμες για την τεχνολογία.
Το οξικό οξύ είναι μια από τις πιο δημοφιλείς και χρησιμοποιούμενες πρώτες ύλες, και έχει επίσης μεγάλη ζήτηση στα τρόφιμα και χημική βιομηχανία.
Κατάλογος χρησιμοποιημένης βιβλιογραφίας
1) «Περιβαλλοντικός παράγοντας ή περιβάλλοως ερέθισμα για την εξέλιξη της βιομηχανικής χημείας». Roger A. Sheldon
) «Οργανική χημεία». Morrison R., Boyd R., 1974
) «Μηχανισμοί αντίδρασης στην οργανική χημεία». Sykes P., 1991
) «Συλλογή εργασιών και κατευθυντήριων γραμμών για τον υπολογισμό του ισοζυγίου υλικών της χημικής-τεχνολογικής παραγωγής». MITHT, 2008
Περαιτέρω ανάγνωση:
5) «Γενική πορεία διεργασιών και συσκευών χημικής τεχνολογίας». Ainstein V.G., Zakharov M.K., 1999
) "Ένα σύντομο βιβλίο αναφοράς φυσικών και χημικών ποσοτήτων." Ravdel A.A., 1999
) "Σχήματα χημικών τεχνολογικών διεργασιών." Nosov G.A., Vyshnepolsky V.I., Lapshenkov G.I., 2011
Μαθήματα
στο θέμα:
"Οξικό οξύ"
Ολοκληρώθηκε το:___________
______________________
Τετραγωνισμένος:___________
______________________
Βόλγκογκραντ 2004
Εισαγωγή…………………………………………………………….3
1. Ανακάλυψη οξικού οξέος……………………..5
2. Ιδιότητες οξικού οξέος………………………..13
3. Παρασκευή οξικού οξέος………………………19
4. Χρήση οξικού οξέος…………………….22
Συμπέρασμα………………………………………………26
Κατάλογος αναφορών……………………27
Εισαγωγή
Το ΟΞΙΚΟ ΟΞΥ, CH3COOH, είναι ένα άχρωμο εύφλεκτο υγρό με πικάντικη οσμή, εξαιρετικά διαλυτό στο νερό. Έχει χαρακτηριστική ξινή γεύση και άγει τον ηλεκτρισμό.
Το οξικό οξύ ήταν το μόνο που γνώριζαν οι αρχαίοι Έλληνες. Εξ ου και το όνομά του: "oxos" - ξινή, ξινή γεύση. Το οξικό οξύ είναι η απλούστερη μορφή οργανικά οξέα, που αποτελούν αναπόσπαστο μέρος των φυτικών και ζωικών λιπών. Υπάρχει σε μικρές συγκεντρώσεις σε τρόφιμα και ποτά και συμμετέχει σε μεταβολικές διεργασίες κατά την ωρίμανση των καρπών. Το οξικό οξύ βρίσκεται συχνά σε φυτικές και ζωικές εκκρίσεις. Τα άλατα και οι εστέρες του οξικού οξέος ονομάζονται οξικά.
Το οξικό οξύ είναι ασθενές (διασπάται μόνο εν μέρει σε υδατικό διάλυμα). Ωστόσο, δεδομένου ότι ένα όξινο περιβάλλον αναστέλλει τη δραστηριότητα των μικροοργανισμών, το οξικό οξύ χρησιμοποιείται στην κονσερβοποίηση. προϊόντα διατροφής, για παράδειγμα, σε μαρινάδες.
Το οξικό οξύ λαμβάνεται με την οξείδωση της ακεταλδεΰδης και άλλες μεθόδους και το βρώσιμο οξικό οξύ λαμβάνεται με ζύμωση αιθανόλης με οξικό οξύ. Χρησιμοποιείται για τη λήψη φαρμακευτικών και αρωματικών ουσιών, ως διαλύτης (για παράδειγμα, στην παραγωγή οξικής κυτταρίνης), με τη μορφή επιτραπέζιου ξυδιού για την παρασκευή καρυκευμάτων, μαρινάδων και κονσερβοποιημένων τροφίμων. Το οξικό οξύ εμπλέκεται σε πολλές μεταβολικές διεργασίες σε ζωντανούς οργανισμούς. Είναι ένα από τα πτητικά οξέα που υπάρχουν σχεδόν σε όλα τα τρόφιμα, ξινό στη γεύση και το κύριο συστατικό του ξιδιού.
Σκοπός αυτής της εργασίας: να μελετήσει τις ιδιότητες, την παραγωγή και τη χρήση του οξικού οξέος.
Καθήκοντα αυτή τη μελέτη:
1. Μιλήστε για την ιστορία της ανακάλυψης του οξικού οξέος
2. Μελετήστε τις ιδιότητες του οξικού οξέος
3. Περιγράψτε μεθόδους για την παραγωγή οξικού οξέος
4. Αποκαλύψτε τα χαρακτηριστικά της χρήσης οξικού οξέος
1. Ανακάλυψη οξικού οξέος
Η δομή του οξικού οξέος έχει ενδιαφέρει τους χημικούς από την ανακάλυψη του τριχλωροξικού οξέος από τον Dumas, αφού αυτή η ανακάλυψη έδωσε ένα πλήγμα στην τότε κυρίαρχη ηλεκτροχημική θεωρία του Berzelius. Το τελευταίο, διαιρώντας τα στοιχεία σε ηλεκτροθετικά και ηλεκτραρνητικά, δεν αναγνώρισε τη δυνατότητα υποκατάστασης σε οργανικές ουσίες χωρίς να τις αλλάξει σε βάθος χημικές ιδιότητες , το υδρογόνο (ένα ηλεκτροθετικό στοιχείο) με το χλώριο (ένα ηλεκτραρνητικό στοιχείο), και όμως σύμφωνα με τις παρατηρήσεις του Ντούμα ("Comptes rendus" της Ακαδημίας του Παρισιού, 1839) αποδείχθηκε ότι "η εισαγωγή χλωρίου στη θέση του υδρογόνου δεν αλλάξουν εντελώς τις εξωτερικές ιδιότητες του μορίου...», γιατί ο Ντούμας και θέτει το ερώτημα «αν οι ηλεκτροχημικές απόψεις και ιδέες για την πολικότητα που αποδίδεται στα μόρια (άτομα) απλών σωμάτων στηρίζονται σε τόσο ξεκάθαρα γεγονότα που μπορούν να θεωρηθούν αντικείμενα Η απόλυτη πίστη, αν πρόκειται να θεωρηθούν ως υποθέσεις, τότε ταιριάζουν αυτές οι υποθέσεις; για γεγονότα που, όπως είναι γνωστό, έχουν λίγες συμφωνίες με τις ηλεκτροχημικές θεωρίες. Στην οργανική χημεία, η θεωρία της υποκατάστασης παίζει τον ίδιο ρόλο.. και ίσως το μέλλον να δείξει ότι και οι δύο απόψεις συνδέονται στενότερα μεταξύ τους προκύπτουν από τους ίδιους λόγους και μπορούν να γενικευθούν με το ίδιο όνομα. Εν τω μεταξύ, με βάση τη μετατροπή του υδροχλωρικού οξέος σε χλωροοξικό οξύ και της αλδεΰδης σε χλωραλδεΰδη (χλωράλη) και από το γεγονός ότι σε αυτές τις περιπτώσεις όλο το υδρογόνο μπορεί να αντικατασταθεί από ίσο όγκο χλωρίου χωρίς να αλλάξει ο βασικός χημικός χαρακτήρας της ουσίας, μπορούμε να βγάλουμε το συμπέρασμα ότι στην οργανική χημεία υπάρχουν τύποι που διατηρούνται ακόμη και όταν εισάγουμε ίσους όγκους χλωρίου, βρωμίου και ιωδίου στη θέση του υδρογόνου. Και αυτό σημαίνει ότι η θεωρία της υποκατάστασης βασίζεται σε γεγονότα, και μάλιστα τα πιο λαμπρά, στην οργανική χημεία." Παραθέτοντας αυτό το απόσπασμα στην ετήσια έκθεσή του για τη Σουηδική Ακαδημία ("Jahresbericht etc.", vol. 19, 1840, p. 370 ο Berzelius σημειώνει: «Ο Dumas παρασκεύασε μια ένωση στην οποία έδωσε τον ορθολογικό τύπο C4Cl6O3 + H2O (Τα ατομικά βάρη είναι σύγχρονα· το τριχλωροξικό οξύ θεωρείται ως ένωση του ανυδρίτη). κατατάσσει αυτή την παρατήρηση ως ένα από τα faits les plus eclatants de la Chimie organique. αυτή είναι η βάση της θεωρίας του για την υποκατάσταση. που κατά τη γνώμη του θα ανατρέψει τις ηλεκτροχημικές θεωρίες..., και όμως αποδεικνύεται ότι αρκεί να γράψει κανείς τον τύπο του λίγο διαφορετικά για να έχει μια ένωση οξαλικού οξέος. με το αντίστοιχο χλωρίδιο, C2Cl6 + C2O4H2, το οποίο παραμένει σε συνδυασμό με το οξαλικό οξύ τόσο σε οξύ όσο και σε άλατα. Έχουμε λοιπόν να κάνουμε με έναν τύπο σύνδεσης, του οποίου είναι γνωστά πολλά παραδείγματα. πολλές... απλές και σύνθετες ρίζες έχουν την ιδιότητα ότι το οξυγονούχο μέρος τους μπορεί να συνδυαστεί με βάσεις και να τις στερήσει χωρίς να χάσει την επαφή με το τμήμα που περιέχει χλώριο. Αυτή η άποψη δεν παρουσιάστηκε από τον Δουμά και δεν υποβλήθηκε σε πειραματική επαλήθευση από τον ίδιο, και όμως, αν είναι αλήθεια, τότε η νέα διδασκαλία, η οποία, σύμφωνα με τον Ντούμα, είναι ασυμβίβαστη με τις μέχρι τότε κυρίαρχες θεωρητικές ιδέες, έχει καταρρεύσει. Έχοντας απαριθμήσει ορισμένες ανόργανες ενώσεις, παρόμοιες, κατά τη γνώμη του, με το χλωροοξικό οξύ (μεταξύ αυτών, ο Berzelius απαριθμούσε επίσης τον ανυδρίτη χλωρίου του χρωμικού οξέος - CrO2Cl2, τον οποίο θεώρησε ως ένωση του υπερχλωρικό χρώμιο (άγνωστο μέχρι σήμερα) με χρωμικό ανυδρίτη: 3CrO2Cl2 = CrCl6 + 2CrO3), ο Berzelius συνεχίζει: «Το χλωροοξικό οξύ του Dumas ανήκει προφανώς σε αυτήν την κατηγορία ενώσεων. σε αυτό η ρίζα άνθρακα συνδυάζεται τόσο με οξυγόνο όσο και με χλώριο. Μπορεί, επομένως, να είναι οξαλικό οξύ, στο οποίο το μισό οξυγόνο αντικαθίσταται από χλώριο, ή ένωση 1 ατόμου (μόριο) οξαλικού οξέος με 1 άτομο (μόριο) σεσκιχλωριούχου άνθρακα - C2Cl6. Η πρώτη υπόθεση δεν μπορεί να γίνει αποδεκτή, γιατί επιτρέπει τη δυνατότητα υποκατάστασης 11/2 ατόμων οξυγόνου με χλώριο (Σύμφωνα με τον Berzelius, το οξαλικό οξύ ήταν C2O3.). Ο Dumas εμμένει σε μια τρίτη ιδέα, εντελώς ασύμβατη με τα δύο παραπάνω, σύμφωνα με την οποία το χλώριο δεν αντικαθιστά το οξυγόνο, αλλά το ηλεκτροθετικό υδρογόνο, σχηματίζοντας τον υδρογονάνθρακα C4Cl6, ο οποίος έχει τις ίδιες ιδιότητες μιας πολύπλοκης ρίζας με το C4H6 ή το ακετύλιο, και είναι ικανό να παράγει οξύ με 3 άτομα οξυγόνου, ταυτόσημες σε ιδιότητες με το U., αλλά, όπως φαίνεται από μια σύγκριση (των φυσικών τους ιδιοτήτων), εντελώς διαφορετικό από αυτό." Πόσο βαθιά ο Berzelius εκείνη την εποχή ήταν βαθιά πεπεισμένος για τη διαφορετική σύσταση του το οξικό και το τριχλωροξικό οξύ φαίνονται καθαρά από την παρατήρηση που έκανε περίπου το ίδιο έτος («Jahresb.», 19, 1840, 558) σχετικά με το άρθρο του Gerard («Journ. f. pr. Ch.», XIV, 17): «Gerard , λέει, εξέφρασε μια νέα άποψη για τη σύνθεση της αλκοόλης, του αιθέρα και των παραγώγων τους. έχει ως εξής: η γνωστή ένωση του χρωμίου, του οξυγόνου και του χλωρίου έχει τον τύπο = CrO2Cl2, το χλώριο αντικαθιστά το άτομο οξυγόνου σε αυτό (Berzelius υπονοεί 1 άτομο οξυγόνου χρωμικού ανυδρίτη - CrO3). Το U. οξύ C4H6 + 3O περιέχει 2 άτομα (μόρια) οξαλικού οξέος, από τα οποία σε ένα όλο το οξυγόνο αντικαθίσταται από υδρογόνο = C2O3 + C2H6. Και 37 σελίδες είναι γεμάτες με αυτό το παιχνίδι τύπων. Αλλά ήδη τον επόμενο χρόνο, ο Ντούμας, αναπτύσσοντας περαιτέρω την ιδέα των τύπων, επεσήμανε ότι, μιλώντας για την ταυτότητα των ιδιοτήτων του U. και του τριχλωροξικού οξέος, εννοούσε την ταυτότητα των χημικών τους ιδιοτήτων, που εκφράζεται σαφώς, για παράδειγμα, στην αναλογία της διάσπασής τους υπό την επίδραση αλκαλίων: C2H3O2K + KOH = CH4 + K2CO8 και C2Cl3O2K + KOH = CHCl3 + K2CO8, αφού τα CH4 και CHCl3 είναι εκπρόσωποι του ίδιου μηχανικού τύπου. Από την άλλη πλευρά, οι Liebig και Graham μίλησαν δημοσίως για μεγαλύτερη απλότητα, που επιτεύχθηκε με βάση τη θεωρία της υποκατάστασης, όταν εξέτασαν τα χλωροπαράγωγα του συνηθισμένου αιθέρα και τους εστέρες μυρμηκικού οξέος και ουρανίου, που ελήφθησαν από τους Malagutti και Berzelius, αποδίδοντας σε η πίεση των νέων γεγονότων, στην 5η έκδ. του «Lehrbuch der Chemie» του (Πρόλογος Νοέμβριος 1842), έχοντας ξεχάσει τη σκληρή κριτική του για τον Gerard, βρήκε δυνατό να γράψει τα εξής: «Αν θυμηθούμε τη μετατροπή (αποσύνθεση στο κείμενο) του οξικού οξέος υπό την επίδραση του χλωρίου σε χλωροξαλικό οξύ (Chloroxalsaure - Ο Berzelius ονομάζει τριχλωροξικό οξύ ("Lehrbuch", 5η έκδ., σ. 629), τότε φαίνεται πιθανή μια άλλη άποψη για τη σύνθεση του οξικού οξέος (το οξικό οξύ ονομάζεται Acetylsaure από τον Berzelius), δηλαδή, μπορεί να είναι ένα συνδυασμένο οξαλικό οξύ, στο οποίο η συνδυαστική ομάδα (Paarling) είναι C2H6, όπως η συνδυαστική ομάδα στο χλωρο-οξαλικό οξύ είναι C2Cl6, και στη συνέχεια η επίδραση του χλωρίου στο οξικό οξύ θα συνίστατο μόνο στη μετατροπή του C2H6 σε C2Cl6 είναι σαφές ότι δεν μπορεί να αποφασιστεί εάν αυτή η άποψη είναι πιο σωστή…, ωστόσο, είναι χρήσιμο να δώσουμε προσοχή στην πιθανότητα αυτή.»
Έτσι, ο Berzelius έπρεπε να παραδεχτεί τη δυνατότητα αντικατάστασης του υδρογόνου με χλώριο χωρίς να αλλάξει η χημική λειτουργία του αρχικού σώματος στο οποίο έγινε η αντικατάσταση. Χωρίς να σταθώ στην εφαρμογή των απόψεών του σε άλλες ενώσεις, στρέφομαι στα έργα του Kolbe, ο οποίος για το οξικό οξύ και στη συνέχεια για άλλα περιοριστικά μονοβασικά οξέα, βρήκε μια σειρά από γεγονότα που ήταν σε αρμονία με τις απόψεις του Berzelius (Gerard) . Το σημείο εκκίνησης για το έργο του Kolbe ήταν η μελέτη μιας κρυσταλλικής ουσίας, της σύνθεσης CCl4SO2, που προηγουμένως ελήφθη από τους Berzelius και Marsay από τη δράση του aqua regia στο CS2 και σχηματίστηκε από τον Kolbe από τη δράση του υγρού χλωρίου στο CS2. Μέσω μιας σειράς μετασχηματισμών, ο Kolbe (Βλ. Kolbe, «Beitrage znr Kenntniss der gepaarten Verbindungen» («Ann. Ch. u. Ph.», 54, 1845, 145).) έδειξε ότι αυτό το σώμα είναι, με σύγχρονους όρους, το ανυδρίτης χλωρίου του τριχλωρομεθυλοσουλφονικού οξέος, CCl4SO2 = CCl3.SO2Cl (ο Kolbe το ονόμασε Schwefligsaures Kohlensuperchlorid), ικανός, υπό την επίδραση αλκαλίων, να δώσει άλατα του αντίστοιχου οξέος - CCl3.SO2(OH) [σύμφωνα με τον Kolbe-Clweffel3Ho. ] (Ατομικά βάρη: H = 2, Cl = 71 . Jahresb. "25, 1846, 91) σημειώνει ότι είναι σωστό να το θεωρήσουμε συνδυασμό του διθειονικού οξέος S2O5 με το χλωροφορμύλιο, γι' αυτό και αποκαλεί το CCl3SO2(OH) Kohlensuperchlorur ( C2Cl6) - Το νερό ενυδάτωσης, ως συνήθως, δεν λαμβάνεται υπόψη από τον Berzelius ., και στη συνέχεια ένα άλλο, σχηματίζοντας το οξύ CH2Cl.SO2(OH) [σύμφωνα με τον Kolbe - Chlorelaylunterschwefelsaure]. ανάγεται από το ρεύμα ή το αμάλγαμα καλίου (Η αντίδραση χρησιμοποιήθηκε πρόσφατα από την Melsans για την αναγωγή του τριχλωροξικού οξέος σε οξικό οξύ.) αντικαθιστά το υδρογόνο και τα τρία άτομα Cl, σχηματίζοντας μεθυλοσουλφονικό οξύ. CH3.SO2(OH) [σύμφωνα με τον Kolbe - Methylunterschwefelsaure]. Η αναλογία αυτών των ενώσεων με τα χλωροοξικά οξέα ήταν ακούσια εντυπωσιακή. Πράγματι, με τους τύπους εκείνης της εποχής, προέκυψαν δύο παράλληλες σειρές, όπως φαίνεται από το παρακάτω δισκίο: H2O+C2Cl6.S2O5 H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2Cl6.S2O5 H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2Cl+C2O2H. +C2H4Cl2.C2O3 H2O+C2H6 S2O5 H2O+C2H6.C2O3 Αυτό δεν ξέφυγε από τον Kolbe, ο οποίος σημειώνει (Ι. σελ. 181): «στα συνδυασμένα θειούχα οξέα που περιγράφηκαν παραπάνω και απευθείας σε χλωράνθρακα-θειικό οξύ (πάνω - H2O. C2Cl6. S2O5) είναι δίπλα στο χλωροοξαλικό οξύ, γνωστό και ως χλωροοξικό οξύ. Υγρός χλωράνθρακας - CCl (Cl = 71, C = 12, τώρα γράφουμε C2Cl4 - αυτό είναι χλωροαιθυλένιο), όπως είναι γνωστό, μετατρέπεται στο φως υπό την επίδραση του χλωρίου σε εξαχλωροαιθάνιο (σύμφωνα με την τότε ονοματολογία - Kohlensuperchlorur) και ένα μπορεί να περιμένει ότι εάν εκτεθεί ταυτόχρονα στο νερό, τότε, όπως το χλωριούχο βισμούθιο, το χλωριούχο αντιμόνιο κ.λπ., τη στιγμή του σχηματισμού, θα αντικαταστήσει το χλώριο με οξυγόνο. Η εμπειρία επιβεβαίωσε την υπόθεση." μέσω ενός θερμαινόμενου σωλήνα, και το CCl4 σχηματίζεται από τη δράση, κατά τη θέρμανση, του Cl2 στο CS2, τότε η αντίδραση του Kolbe ήταν η πρώτη χρονικά που συνέθεσε οξικό οξύ από στοιχεία. είναι δύσκολο να αποφασιστεί, καθώς υπό το φως το χλώριο το οξειδώνει αμέσως σε οξικό οξύ "... Η άποψη του Berzelius για το χλωροοξικό οξύ" επιβεβαιώνεται εκπληκτικά (auf eine tiberraschende Weise) από την ύπαρξη και τον παραλληλισμό των ιδιοτήτων των συνδυασμένων θειούχων οξέων και, όπως μου φαίνεται (λέει ο Kolbe I. σ. 186), ξεφεύγει από τη σφαίρα των υποθέσεων και αποκτά υψηλό βαθμό πιθανότητας. Διότι, εάν το χλωροοξικό οξύ (Chlorkohlenoxalsaure είναι ο τρόπος που ο Kolbe αποκαλεί τώρα το χλωροοξικό οξύ.) έχει τη σύνθεση, σαν σύνθεσηχλωροκαρβονικό οξύ, τότε πρέπει να θεωρήσουμε το οξικό οξύ, το οποίο είναι υπεύθυνο για το μεθυλοθειικό οξύ, ως συνδυασμένο οξύ και να το θεωρήσουμε ως μεθυλοοξαλικό οξύ: C2H6.C2O3 (Αυτή είναι η άποψη που εξέφρασε νωρίτερα ο Gerard). Δεν είναι απίστευτο ότι στο μέλλον θα αναγκαζόμαστε να δεχόμαστε ως συνδυασμένα οξέα σημαντικό αριθμό από εκείνα τα οργανικά οξέα στα οποία επί του παρόντος, λόγω της περιορισμένης γνώσης των πληροφοριών μας, δεχόμαστε υποθετικές ρίζες...» «Όσο για τα φαινόμενα υποκατάστασης σε αυτά τα συνδυασμένα οξέα, τότε λαμβάνουν μια απλή εξήγηση από το γεγονός ότι διάφορες, πιθανώς ισόμορφες ενώσεις είναι ικανές να αντικαθιστούν η μία την άλλη στο ρόλο συνδυαστικών ομάδων (als Raarlinge, l. p. 187), χωρίς να αλλάζουν σημαντικά οι όξινες ιδιότητες του το σώμα σε συνδυασμό με αυτά «Περαιτέρω πειραματική επιβεβαίωση Βρίσκουμε αυτή την άποψη στο άρθρο των Frankland και Kolbe: «Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen «Nitrile» bekannten Verbindungen» («Ann. Chem. , σημειώνουν τα εξής: «εάν ο τύπος H2O + H2.C2O3 αντιπροσωπεύει την αληθινή έκφραση της ορθολογικής σύνθεσης του μυρμηκικού οξέος, δηλαδή εάν θεωρείται ως οξαλικό οξύ σε συνδυασμό με ένα ισοδύναμο υδρογόνου (Η έκφραση δεν είναι σωστή. αντί για Ν έτη. Ο Frankland και ο Kolbe χρησιμοποιούν ένα διαγραμμένο γράμμα, το οποίο ισοδυναμεί με 2 N.), και στη συνέχεια ο μετασχηματισμός στο υψηλή θερμοκρασίαμυρμηκικό αμμώνιο σε υδατικό υδροκυανικό οξύ, επειδή είναι γνωστό, και βρέθηκε από τον Dobereiner, ότι το οξαλικό αμμώνιο αποσυντίθεται όταν θερμαίνεται σε νερό και κυανογόνο. Το υδρογόνο που συνδυάζεται στο μυρμηκικό οξύ συμμετέχει στην αντίδραση μόνο στο ότι ενώνεται με το κυανογόνο για να σχηματίσει υδροκυανικό οξύ: Αντίστροφη εκπαίδευσηΤο μυρμηκικό οξύ από το υδροκυανικό οξύ υπό την επίδραση αλκαλίων δεν είναι τίποτα άλλο παρά μια επανάληψη της γνωστής μετατροπής του κυανογόνου διαλυμένου στο νερό σε οξαλικό οξύ και αμμωνία, με τη μόνη διαφορά. ότι κατά τη στιγμή του σχηματισμού, το οξαλικό οξύ συνδυάζεται με το υδρογόνο του υδροκυανικού οξέος." και Frankland, να τεθούν παράλληλα με την ανικανότητα του χλωρίου του αιθυλεστέρα στην αντίδραση με AgNO3, και η ορθότητα της επαγωγής τους αποδεικνύεται από τους Kolbe και Frankland με σύνθεση με τη μέθοδο των νιτριλίων (Τα νιτρίλια ελήφθησαν με απόσταξη θειικών οξέων με KCN ( μέθοδος Dumas και Malagutti με Leblanc): R".SO3(OH)+KCN=R. CN+KHSO4) οξικό, προπιονικό (σύμφωνα με τα τότε μεθακετονικό) και καπροϊκό οξύ. Στη συνέχεια, τον επόμενο χρόνο, ο Kolbe υπέβαλε για την ηλεκτρόλυση των αλκαλικών αλάτων των μονοβασικών κορεσμένων οξέων και, σύμφωνα με το σχήμα του, παρατηρείται ταυτόχρονα, κατά την ηλεκτρόλυση του οξικού οξέος, ο σχηματισμός αιθανίου, ανθρακικού οξέος και υδρογόνου: H2O+C2H6.C2O3=H2+, και κατά τη διάρκεια η ηλεκτρόλυση βαλερικού οξέος - οκτανίου, ανθρακικού οξέος και υδρογόνου: H2O+C8H18.C2O3=H2+. Ωστόσο, είναι αδύνατο να μην παρατηρήσουμε ότι ο Kolbe αναμενόταν να λάβει από μεθύλιο οξικό οξύ (CH3)" σε συνδυασμό με υδρογόνο, δηλ. αέριο βάλτου, και από οξύ βαλεριάνας - βουτύλιο C4H9, επίσης σε συνδυασμό με υδρογόνο, δηλ. C4H10 (ονομάζει C4H9 βαλύλιο ), αλλά σε αυτή την προσδοκία πρέπει κανείς να δει μια παραχώρηση στους τύπους του Gerard, ο οποίος είχε ήδη λάβει σημαντικά δικαιώματα ιθαγένειας, ο οποίος εγκατέλειψε την προηγούμενη άποψή του για το οξικό οξύ και θεώρησε ότι δεν ήταν το C4H8O4, ο οποίος τύπος, κρίνοντας από κρυοσκοπικά δεδομένα, όντως έχει, και για το C2H4O2, όπως είναι γραμμένο σε όλα τα σύγχρονα εγχειρίδια χημείας.
Μέσα από το έργο του Kolbe, η δομή του οξικού οξέος, και ταυτόχρονα όλων των άλλων οργανικών οξέων, αποσαφηνίστηκε τελικά και ο ρόλος των επόμενων χημικών περιορίστηκε μόνο σε διαίρεση - λόγω θεωρητικών εκτιμήσεων και της εξουσίας του Gerard, οι τύποι του Kolbe στο μισό και στη μετάφραση τους στη γλώσσα των δομικών απόψεων, λόγω των οποίων ο τύπος C2H6.C2O4H2 μετατράπηκε σε CH3.CO(OH).
2. Ιδιότητες οξικού οξέος
Καρβοξυλικά οξέα- οργανικές ενώσεις που περιέχουν μία ή περισσότερες καρβοξυλομάδες –COOH, που σχετίζονται με μια ρίζα υδρογονάνθρακα.
Ιδιότητες οξέοςΤα καρβοξυλικά οξέα οφείλονται σε μια μετατόπιση της πυκνότητας ηλεκτρονίων προς το καρβονυλικό οξυγόνο και την προκύπτουσα πρόσθετη (σε σύγκριση με τις αλκοόλες) πόλωση του δεσμού Ο-Η.
Σε ένα υδατικό διάλυμα, τα καρβοξυλικά οξέα διασπώνται σε ιόντα:
Με την αύξηση του μοριακού βάρους, η διαλυτότητα των οξέων στο νερό μειώνεται.
Σύμφωνα με τον αριθμό των καρβοξυλικών ομάδων, τα οξέα χωρίζονται σε μονοβασικά (μονοκαρβοξυλικά) και πολυβασικά (δικαρβοξυλικά, τρικαρβοξυλικά κ.λπ.).
Με βάση τη φύση της ρίζας υδρογονάνθρακα, διακρίνονται τα κορεσμένα, τα ακόρεστα και τα αρωματικά οξέα.
Τα συστηματικά ονόματα των οξέων δίνονται με το όνομα του αντίστοιχου υδρογονάνθρακα με την προσθήκη ενός επιθέματος -νέοςκαι λέξεις οξύ. Συχνά χρησιμοποιούνται επίσης ασήμαντα ονόματα.
Μερικά κορεσμένα μονοβασικά οξέα
| Τύπος | Ονομα |
|
| συστηματικός | ασήμαντος |
|
| HCOOH | μεθάνιο | μυρμήγκι |
| αιθάνιο | ξύδι | |
| προπάνιο | προπιονική | |
| βουτάνιο | έλαιο | |
| πεντάνιο | βαλεριάνα | |
| εξάνιο | νάιλον | |
| πενταδεκάνιο | παλμιτική | |
| επταδεκανόβα | στεατικός | |
Τα καρβοξυλικά οξέα παρουσιάζουν υψηλή αντιδραστικότητα. Αντιδρούν με διάφορες ουσίες και σχηματίζουν μια ποικιλία ενώσεων, μεταξύ των οποίων έχουν μεγάλη σημασία λειτουργικά παράγωγα, δηλ. ενώσεις που λαμβάνονται ως αποτέλεσμα αντιδράσεων στην καρβοξυλομάδα.
2.1 Σχηματισμός αλατιού
α) όταν αλληλεπιδρούν με μέταλλα:
2RCOOH + Mg ® (RCOO) 2 Mg + H 2
β) σε αντιδράσεις με υδροξείδια μετάλλων:
2RCOOH + NaOH ® RCOONa + H 2 O
Αντί για καρβοξυλικά οξέα, τα αλογονίδια οξέων τους χρησιμοποιούνται συχνότερα:
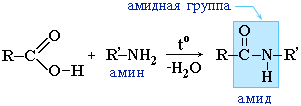 |
Τα αμίδια σχηματίζονται επίσης από την αλληλεπίδραση καρβοξυλικών οξέων (τα αλογονίδια ή ανυδρίτες τους) με οργανικά παράγωγα αμμωνίας (αμίνες):
Τα αμίδια παίζουν σημαντικό ρόλο στη φύση. Μόρια φυσικών πεπτιδίων και πρωτεϊνών κατασκευάζονται από α-αμινοξέα με τη συμμετοχή αμιδικών ομάδων - πεπτιδικών δεσμών.
Οξεικό (αιθανοϊκό οξύ).
Τύπος: CH 3 – COOH; διαυγές, άχρωμο υγρό με πικάντικη οσμή. κάτω από το σημείο τήξης (mp 16,6 βαθμοί C) υπάρχει μια μάζα που μοιάζει με πάγο (επομένως το συμπυκνωμένο οξικό οξύ ονομάζεται επίσης παγόμορφο οξικό οξύ). Διαλυτό σε νερό, αιθανόλη.
Πίνακας 1. Φυσικές ιδιότητες οξικού οξέος
| Ονομα | Τύπος | βράζει. | Διάλυμα- | Κα |
||||
| οξέα | τα άλατά του |
|||||||
| ξύδι | αιθάνιο | οξικό άλας | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
Το συνθετικό οξικό οξύ ποιότητας τροφίμων είναι ένα άχρωμο, διαφανές, εύφλεκτο υγρό με έντονη οσμή ξιδιού. Το συνθετικό οξικό οξύ ποιότητας για τρόφιμα παράγεται από μεθανόλη και μονοξείδιο του άνθρακα σε καταλύτη ροδίου. Το συνθετικό οξικό οξύ τροφίμων χρησιμοποιείται στη χημική, φαρμακευτική και ελαφριά βιομηχανία, καθώς και στη βιομηχανία τροφίμων ως συντηρητικό. Τύπος CH 3 COOH.
Το οξικό οξύ συνθετικών τροφίμων διατίθεται συμπυκνωμένο (99,7%) και σε μορφή υδατικού διαλύματος (80%).
Όσον αφορά τις φυσικοχημικές παραμέτρους, το οξικό οξύ συνθετικών τροφίμων πρέπει να πληροί τα ακόλουθα πρότυπα:
Πίνακας 2. Βασικές τεχνικές απαιτήσεις
| Όνομα δείκτη | |
| 1. Εμφάνιση | Άχρωμο, διαφανές υγρό χωρίς μηχανικές ακαθαρσίες |
| 2. Διαλυτότητα στο νερό | Πλήρες, διαφανές διάλυμα |
| 3. Κλάσμα μάζας οξικού οξέος, %, όχι λιγότερο | 99,5 |
| 4. Κλάσμα μάζας ακεταλδεΰδης, %, όχι περισσότερο | 0,004 |
| 5. Κλάσμα μάζας μυρμηκικού οξέος, %, όχι περισσότερο | 0,05 |
| 6. Κλάσμα μάζας θειικών (SO 4),%, όχι περισσότερο | 0,0003 |
| 7. Κλάσμα μάζας χλωριδίων (Cl),%, όχι περισσότερο | 0,0004 |
| 8. Κλάσμα μάζας βαρέων μετάλλων που καθιζάνει από υδρόθειο (Pb), %, όχι περισσότερο | 0,0004 |
| 9. Κλάσμα μάζας σιδήρου (Fe), %, όχι περισσότερο | 0,0004 |
| 10. Κλάσμα μάζας μη πτητικού υπολείμματος, %, όχι περισσότερο | 0,004 |
| 11. Σταθερότητα χρώματος διαλύματος υπερμαγγανικού καλίου, min, όχι λιγότερο | 60 |
| 12. Κλάσμα μάζας ουσιών που οξειδώνονται από διχρωμικό κάλιο, διάλυμα θειοθειικού νατρίου cm 3, συγκέντρωση c (Na 2 SO 3 * 5H 2 O) = 0,1 mol/dm 3 (0,1 Η), όχι περισσότερο | 5,0 |
Το οξικό οξύ συνθετικών τροφίμων είναι ένα εύφλεκτο υγρό και σύμφωνα με τον βαθμό πρόσκρουσης στον οργανισμό, ανήκει σε ουσίες της 3ης κατηγορίας κινδύνου. Όταν εργάζεστε με οξικό οξύ, χρησιμοποιήστε ατομικά μέσαπροστασία (φίλτρα μάσκες αερίων). Πρώτες βοήθειες για εγκαύματα είναι το ξέπλυμα με άφθονο νερό.
Συνθετικό οξικό οξύ τροφίμων χύνεται σε καθαρές σιδηροδρομικές δεξαμενές, βυτιοφόρα με εσωτερική επιφάνειααπό ανοξείδωτο χάλυβα, σε δοχεία, δοχεία και βαρέλια από ανοξείδωτο χάλυβα χωρητικότητας έως 275 dm3, καθώς και σε γυάλινες φιάλες και βαρέλια πολυαιθυλενίου χωρητικότητας έως 50 dm3. Τα δοχεία πολυμερούς είναι κατάλληλα για πλήρωση και αποθήκευση οξικού οξέος για ένα μήνα. Το συνθετικό οξικό οξύ ποιότητας τροφίμων αποθηκεύεται σε σφραγισμένα δοχεία από ανοξείδωτο χάλυβα. Τα δοχεία, τα δοχεία, τα βαρέλια, οι φιάλες και οι φιάλες πολυαιθυλενίου αποθηκεύονται σε αποθήκες ή κάτω από θόλο. Δεν επιτρέπεται η κοινή αποθήκευση με ισχυρά οξειδωτικά μέσα (νιτρικό οξύ, θειικό οξύ, υπερμαγγανικό κάλιο κ.λπ.).
Μεταφέρεται σε σιδηροδρομικές δεξαμενές από ανοξείδωτο χάλυβα ποιότητας 12Х18Η10Т ή 10Χ17H13Μ2Τ, με άνω εκκένωση.
3. Παρασκευή οξικού οξέος
Το οξικό οξύ είναι ένα σημαντικό χημικό προϊόν που χρησιμοποιείται ευρέως στη βιομηχανία για την παραγωγή εστέρων, μονομερών (οξικός βινυλεστέρας), στη βιομηχανία τροφίμων κ.λπ. Η παγκόσμια παραγωγή της φτάνει τα 5 εκατομμύρια τόνους ετησίως. Μέχρι πρόσφατα, η παραγωγή οξικού οξέος βασιζόταν σε πετροχημικές πρώτες ύλες. Στη διαδικασία Walker, το αιθυλένιο είναι ήπιες συνθήκεςοξειδώνεται με ατμοσφαιρικό οξυγόνο σε ακεταλδεΰδη παρουσία ενός καταλυτικού συστήματος PdCl2 και CuCl2. Στη συνέχεια, η ακεταλδεΰδη οξειδώνεται σε οξικό οξύ:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
Σύμφωνα με μια άλλη μέθοδο, το οξικό οξύ λαμβάνεται με την οξείδωση του n-βουτανίου σε θερμοκρασία 200 C και πίεση 50 atm παρουσία καταλύτη κοβαλτίου.
Η κομψή διαδικασία Walker -ένα από τα σύμβολα της ανάπτυξης των πετροχημικών- αντικαθίσταται σταδιακά από νέες μεθόδους που βασίζονται στη χρήση πρώτων υλών άνθρακα. Έχουν αναπτυχθεί μέθοδοι για την παραγωγή οξικού οξέος από μεθανόλη:
CH3OH + CO CH3COOH
Αυτή η αντίδραση, η οποία έχει μεγάλη βιομηχανική σημασία, είναι ένα εξαιρετικό παράδειγμα που δείχνει την επιτυχία της ομοιογενούς κατάλυσης. Δεδομένου ότι τόσο το CH3OH όσο και το CO μπορούν να παραχθούν από άνθρακα, η διαδικασία καρβονυλίωσης θα πρέπει να γίνει πιο οικονομική καθώς αυξάνονται οι τιμές του πετρελαίου. Υπάρχουν δύο βιομηχανικές διαδικασίες για την καρβονυλίωση της μεθανόλης. Στην παλαιότερη μέθοδο, που αναπτύχθηκε στη BASF, χρησιμοποιήθηκε ένας καταλύτης κοβαλτίου, οι συνθήκες αντίδρασης ήταν σκληρές: θερμοκρασία 250 C και πίεση 500-700 atm. Σε μια άλλη διαδικασία, την οποία κατέχει η Monsanto, χρησιμοποιήθηκε ένας καταλύτης ροδίου, η αντίδραση διεξήχθη σε περισσότερες χαμηλές θερμοκρασίες(150-200 C) και πίεση (1-40 atm). Η ιστορία της ανακάλυψης αυτής της διαδικασίας είναι ενδιαφέρουσα. Οι επιστήμονες της εταιρείας ερεύνησαν την υδροφορμυλίωση χρησιμοποιώντας καταλύτες ροδίου φωσφίνης. Ο τεχνικός διευθυντής του τμήματος πετροχημικών πρότεινε τη χρήση του ίδιου καταλύτη για την καρβονυλίωση της μεθανόλης. Τα αποτελέσματα των πειραμάτων αποδείχθηκαν αρνητικά και αυτό συνδέθηκε με τη δυσκολία σχηματισμού δεσμού μετάλλου-άνθρακα. Ωστόσο, θυμούμενοι μια διάλεξη από έναν σύμβουλο εταιρείας σχετικά με την εύκολη οξειδωτική προσθήκη ιωδιούχου μεθυλίου σε σύμπλοκα μετάλλων, οι ερευνητές αποφάσισαν να προσθέσουν έναν υποκινητή ιωδίου στο μείγμα αντίδρασης και έλαβαν ένα λαμπρό αποτέλεσμα, το οποίο δεν πίστευαν στην αρχή. Μια παρόμοια ανακάλυψη έκαναν επίσης επιστήμονες από μια ανταγωνιστική εταιρεία, την Union Carbide, οι οποίοι έμειναν μόνο λίγους μήνες πίσω. Η ομάδα που αναπτύσσει την τεχνολογία για την καρβονυλίωση μεθανόλης, μετά από μόλις 5 μήνες εντατικής εργασίας, δημιούργησε τη βιομηχανική διαδικασία Monsanto, με τη βοήθεια της οποίας παρήχθησαν 150 χιλιάδες τόνοι οξικού οξέος το 1970. Αυτή η διαδικασία έγινε ο προάγγελος του πεδίου της επιστήμης που ονομάστηκε C1 χημεία.
Ο μηχανισμός της καρβονυλίωσης έχει διερευνηθεί διεξοδικά. Το ιωδιούχο μεθύλιο που απαιτείται για την αντίδραση λαμβάνεται από την εξίσωση
CH3OH + HI CH3I + H2O
Ο καταλυτικός κύκλος μπορεί να αναπαρασταθεί ως εξής:
Το ιωδιούχο μεθύλιο προστίθεται οξειδωτικά στο τετράγωνο-επίπεδο σύμπλοκο (Ι) για να σχηματιστεί σύμπλοκο με έξι συντεταγμένες II, και στη συνέχεια, ως αποτέλεσμα της εισαγωγής CO στον δεσμό μεθυλ-ροδίου, σχηματίζεται ένα σύμπλοκο ακετυλοροδίου (III). Η αναγωγική αποβολή του ιωδιούχου οξικού οξέος αναγεννά τον καταλύτη και η υδρόλυση του ιωδιούχου οξικού οξέος παράγει οξικό οξύ.
Βιομηχανική σύνθεση οξικού οξέος:
α) καταλυτική οξείδωση του βουτανίου
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
β) θέρμανση ενός μείγματος μονοξειδίου του άνθρακα (II) και μεθανόλης σε καταλύτη υπό πίεση
CH3OH + CO CH3COOH
Παραγωγή οξικού οξέος με ζύμωση (οξικό οξύ ζύμωση).
Πρώτες ύλες: υγρά που περιέχουν αιθανόλη (κρασί, ζυμωμένοι χυμοί), οξυγόνο.
Έκδοχα: ένζυμα βακτηρίων οξικού οξέος.
Χημική αντίδραση: Η αιθανόλη οξειδώνεται βιοκαταλυτικά σε οξικό οξύ.
CH 2 – CH – OH + O 2 CH 2 – COOH + H 2 O
Κύριο προϊόν: οξικό οξύ.
4. Εφαρμογή οξικού οξέος
Το οξικό οξύ χρησιμοποιείται για τη λήψη φαρμακευτικών και αρωματικών ουσιών, ως διαλύτης (για παράδειγμα, στην παραγωγή οξικής κυτταρίνης), με τη μορφή επιτραπέζιου ξυδιού για την παρασκευή καρυκευμάτων, μαρινάδων και κονσερβοποιημένων τροφίμων.
Ένα υδατικό διάλυμα οξικού οξέος χρησιμοποιείται ως αρωματικό και συντηρητικό (καρύκευμα για τρόφιμα, τουρσί μανιταριών, λαχανικών).
Το ξύδι περιέχει οξέα όπως μηλικό, γαλακτικό, ασκορβικό και οξικό.
Μηλόξυδο (4% οξικό οξύ)
Το μηλόξυδο περιέχει 20 απαραίτητα ορυκτάκαι μικροστοιχεία, καθώς και οξικό, προπιονικό, γαλακτικό και κιτρικό οξύ, μια σειρά από ένζυμα και αμινοξέα, πολύτιμες ουσίες έρματος, όπως ποτάσα, πηκτίνη. Το μηλόξυδο χρησιμοποιείται ευρέως στην προετοιμασία διαφόρων πιάτων και στην κονσερβοποίηση. Ταιριάζει με όλων των ειδών τις σαλάτες, τόσο με φρέσκα λαχανικά όσο και με κρέας και ψάρι. Μπορείτε να μαρινάρετε κρέας, αγγούρια, λάχανο, κάπαρη, γλιστρίδα και τρούφες σε αυτό. Ωστόσο, στη Δύση, το μηλόξυδο είναι περισσότερο γνωστό για το φαρμακευτικές ιδιότητες. Χρησιμοποιείται για υπερυψωμένα αρτηριακή πίεση, ημικρανίες, άσθμα, πονοκέφαλοι, αλκοολισμός, ζάλη, αρθρίτιδα, νεφρική νόσο, υψηλός πυρετός, εγκαύματα, κατακλίσεις κ.λπ.
Υγιείς άνθρωποιΣυνιστάται να πίνετε ένα υγιεινό και δροσιστικό ρόφημα κάθε μέρα: ανακατεύετε μια κουταλιά μέλι σε ένα ποτήρι νερό και προσθέτετε 1 κουταλιά μηλόξυδο. Για όσους θέλουν να χάσουν βάρος, συνιστούμε να πίνετε ένα ποτήρι νερό χωρίς ζάχαρη με δύο κουταλιές της σούπας μηλόξυδο κάθε φορά που τρώτε.
Το ξύδι χρησιμοποιείται ευρέως στην οικιακή κονσερβοποίηση για την παρασκευή μαρινάδων διαφόρων δυνατοτήτων. ΣΕ λαϊκή ιατρικήΤο ξύδι χρησιμοποιείται ως μη ειδικό αντιπυρετικό (σκουπίζοντας το δέρμα με διάλυμα νερού και ξιδιού σε αναλογία 3:1), καθώς και για πονοκεφάλους χρησιμοποιώντας τη μέθοδο λοσιόν. Είναι σύνηθες να χρησιμοποιείται ξύδι για τσιμπήματα εντόμων μέσω κομπρέσων.
Η χρήση του αλκοολούχου ξυδιού στην κοσμετολογία είναι γνωστή. Δηλαδή, για να δώσει απαλότητα και λάμψη στα μαλλιά μετά από περμανάντ και μόνιμο βάψιμο. Για να γίνει αυτό, συνιστάται να ξεπλύνετε τα μαλλιά σας με ζεστό νερό με την προσθήκη αλκοολούχου ξιδιού (3-4 κουταλιές της σούπας ξύδι ανά 1 λίτρο νερού).
Ξίδι σταφυλιού (4% οξικό οξύ)
Το ξύδι από σταφύλι χρησιμοποιείται ευρέως από κορυφαίους σεφ όχι μόνο στη Σλοβενία, αλλά σε όλο τον κόσμο. Στη Σλοβενία χρησιμοποιείται παραδοσιακά για την παρασκευή διαφόρων σαλατών λαχανικών και εποχής (2-3 κουταλιές της σούπας ανά σαλατιέρα), επειδή δίνει μια μοναδική και εκλεπτυσμένη γεύση στο πιάτο. Το ξίδι σταφυλιού ταιριάζει επίσης με διάφορες ψαροσαλάτες και πιάτα με θαλασσινά. Όταν ετοιμάζετε κεμπάπ από διάφορα είδη κρέατος, αλλά κυρίως χοιρινό, το σταφύλι είναι απλά αναντικατάστατο.
Το οξικό οξύ χρησιμοποιείται επίσης για την παραγωγή φάρμακα.
Τα δισκία ασπιρίνης (AS) περιέχουν το δραστικό συστατικό ακετυλοσαλικυλικό οξύ, το οποίο είναι ένας οξικός εστέρας σαλικυλικό οξύ.
Ακετυλοσαλικυλικό οξύπαράγεται με θέρμανση του σαλικυλικού οξέος με άνυδρο οξικό οξύ παρουσία μικρής ποσότητας θειικού οξέος (ως καταλύτη).
Όταν θερμαίνεται με υδροξείδιο του νατρίου (NaOH) σε υδατικό διάλυμα, το ακετυλοσαλικυλικό οξύ υδρολύεται σε σαλικυλικό νάτριο και οξικό νάτριο. Όταν το μέσο οξινίζεται, το σαλικυλικό οξύ κατακρημνίζεται και μπορεί να αναγνωριστεί από το σημείο τήξης του (156-1600 C). Μια άλλη μέθοδος αναγνώρισης του σαλικυλικού οξέος που σχηματίζεται κατά την υδρόλυση είναι να χρωματιστεί το διάλυμά του σκούρο μωβ όταν προστεθεί χλωριούχος σίδηρος (FeCl3). Το οξικό οξύ που υπάρχει στο διήθημα μετατρέπεται με θέρμανση με αιθανόλη και θειικό οξύ σε αιθοξυαιθανόλη, η οποία μπορεί εύκολα να αναγνωριστεί από τη χαρακτηριστική της οσμή. Επιπλέον, το ακετυλοσαλικυλικό οξύ μπορεί να αναγνωριστεί χρησιμοποιώντας διάφορες χρωματογραφικές μεθόδους.
Το ακετυλοσαλικυλικό οξύ κρυσταλλώνεται για να σχηματίσει άχρωμα μονοκλινικά πολύεδρα ή βελόνες, ελαφρώς ξινή στη γεύση. Είναι σταθερά στον ξηρό αέρα αλλά σταδιακά υδρολύονται σε σαλικυλικό οξύ και οξικό οξύ σε υγρά περιβάλλοντα (Leeson and Mattocks, 1958· Stempel, 1961). Η καθαρή ουσία είναι μια λευκή κρυσταλλική σκόνη χωρίς σχεδόν καμία οσμή. Η μυρωδιά του οξικού οξέος δείχνει ότι η ουσία έχει αρχίσει να υδρολύεται. Το ακετυλοσαλικυλικό οξύ υφίσταται εστεροποίηση υπό την επίδραση αλκαλικών υδροξειδίων, αλκαλικών διττανθρακικών και επίσης σε βραστό νερό.
Το ακετυλοσαλικυλικό οξύ έχει αντιφλεγμονώδη, αντιπυρετική και αναλγητική δράση και χρησιμοποιείται ευρέως για πυρετώδεις καταστάσεις, πονοκεφάλους, νευραλγίες κ.λπ., καθώς και ως αντιρευματικός παράγοντας.
Το οξικό οξύ χρησιμοποιείται στη χημική βιομηχανία (παραγωγή οξικής κυτταρίνης, από την οποία παράγονται οξικές ίνες, οργανικό γυαλί, φιλμ· για τη σύνθεση βαφών, φαρμάκων και εστέρων), στην παραγωγή μη εύφλεκτων μεμβρανών, προϊόντων αρωματοποιίας, διαλυτών στη σύνθεση βαφών, φαρμακευτικές ουσίεςγια παράδειγμα ασπιρίνη. Τα άλατα του οξικού οξέος χρησιμοποιούνται για τον έλεγχο των παρασίτων των φυτών.
Σύναψη
Αυτή η εργασία συζήτησε την ανακάλυψη του οξικού οξέος, τις βασικές του ιδιότητες, την προετοιμασία και τη χρήση του.
Έτσι, το οξικό οξύ (CH3COOH), ένα άχρωμο εύφλεκτο υγρό με έντονη οσμή, είναι εξαιρετικά διαλυτό στο νερό. Έχει χαρακτηριστική ξινή γεύση και άγει τον ηλεκτρισμό. Η χρήση οξικού οξέος στη βιομηχανία είναι πολύ μεγάλη.
UΤο οξικό οξύ που παράγεται στη Ρωσία είναι στο επίπεδο των καλύτερων παγκόσμιων προδιαγραφών, έχει μεγάλη ζήτηση στην παγκόσμια αγορά και εξάγεται σε πολλές χώρες σε όλο τον κόσμο.
Η παραγωγή οξικού οξέος έχει μια σειρά από δικές της ειδικές απαιτήσεις, επομένως χρειάζονται ειδικοί που έχουν μεγάλη εμπειρία όχι μόνο στον τομέα της αυτοματοποίησης παραγωγής και του ελέγχου διεργασιών, αλλά και κατανοούν σαφώς τις ειδικές απαιτήσεις αυτής της βιομηχανίας.
Κατάλογος χρησιμοποιημένης βιβλιογραφίας
1. Αρτεμένκο, Αλεξάντερ Ιβάνοβιτς. Οδηγός αναφοράς χημείας / A.I. Artemenko, I.V. Tikunova, V.A. Βαμμένο. - 2η έκδ., αναθεωρημένη. και επιπλέον - Μ.: Ανώτερη Σχολή, 2002. - 367 σελ.
2. Αχμέτοφ, Νάιλ Σιμπγκάτοβιτς. Γενική και ανόργανη χημεία: Εγχειρίδιο για μαθητές. χημική τεχνολογία ειδικός. πανεπιστήμια / Akhmetov N.S - 4th ed / αναθεωρημένη - M.: Higher School, 2002. - 743 p.
3. Berezin, Boris Dmitrievich. Μάθημα σύγχρονης οργανικής χημείας: Proc. βοήθεια για μαθητές πανεπιστήμια, εκπαιδευτικά στη χημική τεχνολογία special/ Berezin B.D., Berezin D.B.-M.: Higher school, 2001.-768 p.
4. I. G. Bolesov, G. S. Zaitseva. Καρβοξυλικά οξέα και τα παράγωγά τους (σύνθεση, αντιδραστικότητα, εφαρμογή στην οργανική σύνθεση). Μεθοδολογικά υλικάστο γενικό μάθημα της οργανικής χημείας. Τεύχος 5. Μόσχα 1997
5. Sommer K. Συσσωρευτής γνώσεων στη χημεία. Ανά. με γερμανικά, 2η έκδ. – Μ.: Μιρ, 1985. – 294 σελ.
6. Karakhanov E.A. Αέριο σύνθεσης ως εναλλακτική λύση στο πετρέλαιο. I. Διαδικασία Fischer-Tropsch και οξο-σύνθεση // Soros Educational Journal. 1997. Αρ. 3. Σ. 69-74.
Περισσότερα από την ενότητα Χημεία:
- Δοκιμή: Χημικές μέθοδοι για την παραγωγή νερού και διοξειδίου του αζώτου
- Περίληψη: Μονάδα συνεχούς ανόρθωσης για διαχωρισμό 4,1 t/h δυαδικού μείγματος ακετόνης - αιθανόλης
Μήκος και απόσταση Μάζα Μέτρα όγκου χύδην στερεών και τροφίμων Περιοχή Όγκος και μονάδες μέτρησης σε μαγειρικές συνταγέςΘερμοκρασία Πίεση, μηχανική καταπόνηση, μέτρο του Young Ενέργεια και εργασία Ισχύς Δύναμη Χρόνος Γραμμική ταχύτητα Γωνία αεροπλάνου Θερμική απόδοση και απόδοση καυσίμου Αριθμοί Μονάδες μέτρησης της ποσότητας πληροφοριών Ισοτιμίες συναλλάγματος Μεγέθη γυναικείων ενδυμάτων και υποδημάτων Μεγέθη ανδρικών ενδυμάτων και υποδημάτων Γωνιακή ταχύτητα και ταχύτητα περιστροφής Επιτάχυνση Γωνιακή επιτάχυνση Πυκνότητα Ειδικός όγκος Ροπή αδράνειας Ροπή δύναμης Ροπή Ειδική θερμότητα καύσης (κατά μάζα) Ενεργειακή πυκνότητα και ειδική θερμότητα καύσης καυσίμου (κατ' όγκο) Διαφορά θερμοκρασίας Συντελεστής θερμικής διαστολής Θερμική αντίσταση Ειδική θερμική αγωγιμότητα Ειδική θερμική ικανότητα Έκθεση ενέργειας , Ισχύς θερμικής ακτινοβολίας Πυκνότητα ροής θερμότητας Συντελεστής μεταφοράς θερμότητας Ροή όγκου Ταχύτητα ροής μάζας Μοριακός ρυθμός ροής Πυκνότητα ροής μάζας Μοριακή συγκέντρωση Συγκέντρωση μάζας σε διάλυμα Δυναμικό (απόλυτο) ιξώδες Κινηματικό (απόλυτο) ιξώδες Κινηματικό ιξώδες Επιφανειακή τάση Διαπερατότητα ατμών Ευαισθησία ατμών, ταχύτητα μεταφοράς ατμών Επίπεδο ήχου μικροφώνου πίεσης S επίπεδο (SPL) Φωτεινότητα Φωτεινή ένταση Φωτισμός Ανάλυση σε γραφικά υπολογιστή Συχνότητα και μήκος κύματος Οπτική ισχύςσε διόπτρες και εστιακή απόσταση Οπτική ισχύς σε διόπτρες και μεγέθυνση φακού (×) Ηλεκτρικό φορτίο Γραμμική πυκνότητα φορτίου Πυκνότητα επιφανειακής φόρτισης Πυκνότητα φόρτισης όγκου Ηλεκτρικό ρεύμαΓραμμική πυκνότητα ρεύματος Πυκνότητα επιφανειακού ρεύματος Ισχύς ηλεκτρικού πεδίου Ηλεκτροστατικό δυναμικό και τάση Ηλεκτρική αντίσταση Ηλεκτρική αντίσταση Ηλεκτρική αντίσταση Ηλεκτρική αγωγιμότητα Ηλεκτρική αγωγιμότητα Ηλεκτρική χωρητικότητα Επαγωγή Αμερικανικό μετρητή καλωδίων Επίπεδα σε dBm (dBm ή dBmW), dVmo ισχύς και άλλα μαγνητικά πεδία Μαγνητική ροή Μαγνητική επαγωγή Ρυθμός απορροφούμενης δόσης ιονίζουσας ακτινοβολίας Ραδιενέργεια. Ραδιενεργή διάσπαση Ακτινοβολία. Δόση έκθεσης Ακτινοβολία. Απορροφημένη δόση Δεκαδικά προθέματα Μετάδοση δεδομένων Τυπογραφία και επεξεργασία εικόνας Μονάδες όγκου ξυλείας Υπολογισμός μοριακής μάζας Περιοδικός πίνακας χημικών στοιχείων D. I. Mendeleev
Χημικός τύπος
Μοριακή μάζα CH 3 COOH, οξικό οξύ 60.05196 g/mol
12.0107+1.00794 3+12.0107+15.9994+15.9994+1.00794
Κλάσματα μάζας στοιχείων στην ένωση
Χρήση του Υπολογιστή Μοριακής Μάζας
- Οι χημικοί τύποι πρέπει να εισάγονται με διάκριση πεζών-κεφαλαίων
- Οι συνδρομητές εισάγονται ως κανονικοί αριθμοί
- Το σημείο στη μεσαία γραμμή (σύμβολο πολλαπλασιασμού), που χρησιμοποιείται, για παράδειγμα, στους τύπους των κρυσταλλικών υδριτών, αντικαθίσταται από ένα κανονικό σημείο.
- Παράδειγμα: αντί για CuSO4·5H2O στον μετατροπέα, για ευκολία εισαγωγής, χρησιμοποιείται η ορθογραφία CuSO4.5H2O.
Υπολογιστής μοριακής μάζας
Τυφλοπόντικας
Όλες οι ουσίες αποτελούνται από άτομα και μόρια. Στη χημεία, είναι σημαντικό να μετρηθεί με ακρίβεια η μάζα των ουσιών που αντιδρούν και παράγονται ως αποτέλεσμα. Εξ ορισμού, mole είναι η ποσότητα μιας ουσίας που περιέχει τον ίδιο αριθμό δομικών στοιχείων (άτομα, μόρια, ιόντα, ηλεκτρόνια και άλλα σωματίδια ή ομάδες αυτών) όσο υπάρχουν άτομα σε 12 γραμμάρια ισοτόπου άνθρακα με σχετικό άτομο μάζα 12. Αυτός ο αριθμός ονομάζεται σταθερά ή αριθμός Avogadro και ισούται με 6,02214129(27)×1023 mol-1.
Αριθμός Avogadro N A = 6,02214129(27)×10²3 mol-1
Με άλλα λόγια, ένα mole είναι μια ποσότητα ουσίας ίση σε μάζα με το άθροισμα των ατομικών μαζών των ατόμων και των μορίων της ουσίας, πολλαπλασιαζόμενη με τον αριθμό του Avogadro. Η μονάδα ποσότητας μιας ουσίας, το mole, είναι μία από τις επτά βασικές μονάδες SI και συμβολίζεται με το mole. Επειδή το όνομα της μονάδας και το σύμβολό της είναι το ίδιο, θα πρέπει να σημειωθεί ότι το σύμβολο δεν απορρίπτεται, σε αντίθεση με το όνομα της μονάδας, το οποίο μπορεί να απορριφθεί με κανονικούς κανόνεςΡωσική γλώσσα. Εξ ορισμού, ένα mole καθαρού άνθρακα-12 ισούται με ακριβώς 12 g.
Μοριακή μάζα
Η μοριακή μάζα είναι μια φυσική ιδιότητα μιας ουσίας, που ορίζεται ως ο λόγος της μάζας αυτής της ουσίας προς την ποσότητα της ουσίας σε mol. Με άλλα λόγια, αυτή είναι η μάζα ενός mole μιας ουσίας. Η μονάδα μοριακής μάζας SI είναι kg/mol (kg/mol). Ωστόσο, οι χημικοί συνηθίζουν να χρησιμοποιούν την πιο βολική μονάδα g/mol.
μοριακή μάζα = g/mol

Μοριακή μάζα στοιχείων και ενώσεων
Οι ενώσεις είναι ουσίες που αποτελούνται από διαφορετικά άτομα που συνδέονται χημικά μεταξύ τους. Για παράδειγμα, οι ακόλουθες ουσίες, που μπορούν να βρεθούν στην κουζίνα κάθε νοικοκυράς, είναι χημικές ενώσεις:
- άλας (χλωριούχο νάτριο) NaCl
- ζάχαρη (σακχαρόζη) C12H22O11
- ξύδι (διάλυμα οξικού οξέος) CH3COOH
Η μοριακή μάζα ενός χημικού στοιχείου σε γραμμάρια ανά mole είναι αριθμητικά ίδια με τη μάζα των ατόμων του στοιχείου εκφρασμένη σε μονάδες ατομικής μάζας (ή dalton). Η μοριακή μάζα των ενώσεων είναι ίση με το άθροισμα των μοριακών μαζών των στοιχείων που αποτελούν την ένωση, λαμβάνοντας υπόψη τον αριθμό των ατόμων της ένωσης. Για παράδειγμα, η μοριακή μάζα του νερού (H2O) είναι περίπου 2 x 2 + 16 = 18 g/mol.
Μοριακό βάρος

Η μοριακή μάζα (το παλιό όνομα είναι μοριακό βάρος) είναι η μάζα ενός μορίου, που υπολογίζεται ως το άθροισμα των μαζών κάθε ατόμου που συνθέτει το μόριο, πολλαπλασιαζόμενο με τον αριθμό των ατόμων σε αυτό το μόριο. Το μοριακό βάρος είναι αδιάστατο φυσική ποσότητα, αριθμητικά ίσο με τη μοριακή μάζα. Ήτοι, μοριακό βάροςδιαφέρει από τη μοριακή μάζα σε διάσταση. Αν και η μοριακή μάζα είναι αδιάστατη, εξακολουθεί να έχει μια τιμή που ονομάζεται μονάδα ατομικής μάζας (amu) ή dalton (Da), η οποία είναι περίπου ίση με τη μάζα ενός πρωτονίου ή νετρονίου. Η μονάδα ατομικής μάζας είναι επίσης αριθμητικά ίση με 1 g/mol.
Σχετικά άρθρα
-
Αγγλικά - ρολόι, ώρα
Όποιος ενδιαφέρεται να μάθει αγγλικά έχει συναντήσει περίεργους συμβολισμούς p. m.
-
και α. m, και γενικά, όπου αναφέρεται χρόνος, για κάποιο λόγο χρησιμοποιείται μόνο η μορφή των 12 ωρών. Μάλλον για εμάς που ζούμε...
«Αλχημεία στο χαρτί»: συνταγές
-
Το Doodle Alchemy ή Alchemy on paper για Android είναι ένα ενδιαφέρον παιχνίδι παζλ με όμορφα γραφικά και εφέ. Μάθετε πώς να παίζετε αυτό το καταπληκτικό παιχνίδι και επίσης βρείτε συνδυασμούς στοιχείων για να ολοκληρώσετε το παιχνίδι Αλχημείας σε χαρτί. Παιχνίδι...
Batman: Arkham City δεν θα ξεκινήσει;
-
Εάν αντιμετωπίζετε το γεγονός ότι το Batman: Arkham City επιβραδύνει, κολλάει, το Batman: Arkham City δεν ξεκινά, το Batman: Arkham City δεν εγκαθίσταται, τα στοιχεία ελέγχου δεν λειτουργούν στο Batman: Arkham City, δεν υπάρχει ήχος, εμφανίζονται σφάλματα στο Batman:...
Πώς να απογαλακτίσετε κάποιον από τους κουλοχέρηδες Πώς να απογαλακτίσετε κάποιον από τα τυχερά παιχνίδια
-
Μαζί με έναν ψυχοθεραπευτή στην κλινική Moscow Rehab Family και έναν ειδικό στη θεραπεία του εθισμού στον τζόγο, τον Roman Gerasimov, η Rating Bookmakers εντόπισε το μονοπάτι ενός εθισμένου στον τζόγο στο αθλητικό στοίχημα - από τον σχηματισμό εθισμού έως την επίσκεψη σε γιατρό,...
Rebuses Διασκεδαστικά rebuses γρίφοι γρίφους
-
Παιχνίδι "Riddles Rebuses Charades": απάντηση στην ενότητα "RIDLES" Επίπεδο 1 και 2 ● Ούτε ποντίκι, ούτε πουλί - γλεντάει στο δάσος, ζει στα δέντρα και ροκανίζει ξηρούς καρπούς. ● Τρία μάτια - τρεις παραγγελίες, το κόκκινο είναι το πιο επικίνδυνο.
Επίπεδο 3 και 4 ● Δύο κεραίες ανά...
